 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Площинна хроматографія. Хроматографія у тонкому шарі сорбенту (ТШХ) ⇐ ПредыдущаяСтр 4 из 4
Для розділення речовин за допомогою методу ТШХ використовують пластинки зі скла, металу, пластмаси, покриті тонким шаром сорбенту (силікагелю, алюмінію оксиду тощо). Розрізняють пластинки з незакріпленим та закріпленим шаром сорбенту. На відміну від пластинок з незакріпленим шаром сорбенту, при виготовленні пластинок з закріпленим шаром до сорбенту додають в’яжучий (закріплюючий) матеріал (гіпс, крохмаль), внаслідок чого шар сорбенту стає стійкішим до механічних впливів. Залежно від завдань розміри пластинок можуть бути різними. Перед хроматографуванням на поверхні пластинки обережно відмічають лінію старту (1,5-3 см від нижнього краю пластинки) і лінію фронту розчинника (рис.4.4). На лінію старту пластинки наносять (мікрошприцом, капіляром) досліджуваний розчин, що містить суміш речовин, переважно у вигляді крапель (з аналітичною метою) або смуг (з препаративною метою). Часто одночасно з нанесенням проби досліджуваних речовин на лінію старту наносять розчини речовин-стандартів, а також речовин-«свідків» (тих, вміст яких передбачається у досліджуваній пробі) (рис.4.5). Пластинки з нанесеним розчином підсушують і вносять у камеру для хроматографування, на дно якої налитий шар розчинника або суміші розчинників (рухома фаза), підібраних для конкретного аналізу (рис.4.2). Під впливом капілярних сил рухома фаза переміщається через шар сорбенту від лінії старту до лінії фронту, переносячи з собою компоненти досліджуваної суміші, які рухаються з різною швидкістю, у результаті чого відбувається їхнє розділення. Розділення компонентів суміші залежить від їх спорідненості з нерухомою фазою. Речовини 2 і 3 (рис.4.4) мають меншу спорідненість з нерухомою фазою, ніж речовина 1, тому ці речовини рухаються швидше, ніж речовина 1. Окрім того, рухома фаза відіграє роль не тільки розчинника, який переносить досліджувані речовини через шар сорбенту. Вона також конкурує з компонентами проби за місце в адсорбційному шарі. Якщо розчинник адсорбується сильніше, то досліджуваним речовинам буде важче заміщати його у процесі хроматографування. У такому випадку досліджувана речовина достатньо довго буде знаходитись у рухомій фазі і швидко рухатись з нею через шар сорбенту, не затримуючись у ньому. Отже, швидкість міграції досліджуваних речовин через шар сорбенту часто залежить також від адсорбційних властивостей рухомої фази.
1. Кришка 2. Скляна камера 3. Пластинка з тонким шаром сорбенту 4. Сорбент 5. Місце нанесення проби 6. Розчинник Механізми процесу розділення речовин у тонкому шарі сорбенту можуть бути різними. Залежно від природи аналізованих речовин, складу тонкого шару, властивостей використовуваних розчинників розділення речовин на пластинках може відбуватись у результаті адсорбції або в результаті розподілу компонентів суміші між двома рідинами, що не змішуються між собою. У деяких випадках розділення речовин на пластинках, покритих тонким шаром сорбенту, досягається внаслідок іонного обміну тощо. На практиці спостерігається поєднання декількох механізмів розділення у процесі аналізу одних і тих же речовин у однакових умовах. Для ефективного застосування хроматографічного методу вирішальне значення має правильний вибір умов проведення аналізу, тобто вибір сорбенту та розчинника (елюента). Для підбору умов можна скористатись наочною схемою Шталя (рис.4.4). За цією схемою трикутник (заштрихований на малюнку) обертається навколо центру, при цьому один кут трикутника вказує на властивості досліджуваних речовин, другий – на необхідну активність сорбенту, а третій – на полярність розчинника. Активність сорбенту – це його здатність сорбувати (утримувати) компоненти аналізованої суміші. Активність сорбенту залежить від природи активних центрів і їх концентрації на поверхні сорбенту (наприклад, гідроксильних груп), від ступеня дисперсності частинок сорбенту, від розмірів поверхні сорбенту і вмісту у ньому води, від природи рухомої фази, що взаємодіє з сорбентом. Чим більше води містить сорбент, тим нижчою є його активність, оскільки молекули води, зв’язуючись з активними центрами, блокують їх.
Рис. 4.4. Схема підбору умов для хроматографування у тонкому шарі за Шталем Способи хроматографування. Аналіз речовин на пластинках для ТШХ можна проводити декількома способами: висхідним, низхідним та радіальним (круговим) хроматографуванням. У випадку висхідного хроматографування система розчинників рухається знизу вверх під впливом капілярних сил, при використанні низхідного хроматографування систему розчинників подають зверху; і розчинник, і аналізовані речовини рухаються зверху вниз. При радіальному (круговому) хроматографуванні використовують горизонтальний рух розчинника і компонентів проби від центру пластинки до периферії. Ефективність розділення можна збільшити, використовуючи безперервний рух розчинника у шарі сорбенту (проточне елюювання) або повторне хроматографування декілька разів (програмоване багатократне хроматографування). Зразок можна також послідовно елюювати у двох взаємно перпендикулярних напрямках (двомірна хроматографія). Після досягнення рухомою фазою (розчинником) лінії фронту розчинника Н хроматографування зупиняють, пластинку виймають з хроматографічної камери, висушують на повітрі і визначають положення плям (проявляють зони) речовин 1, 2 і 3 (рис. 4.4) на поверхні пластинки, тобто відстані h1, h2 і h3. Детектування. Важливою проблемою ТШХ є локалізація і проявляння зон речовин на пластинках, більшість з яких є незабарвленими. Для проявляння зон використовують у основному три методи: флуоресцентний, обприскування реагентами і обвуглювання. Проявляння зон, що базується на збудженні флуоресценції, може бути прямим і непрямим (опосередкованим). Пластинку опромінюють УФ-лампою з довжиною хвилі випромінювання 254 нм (короткохвильове) і 350 нм (довгохвильове). Пряме збудження флуоресценції можливе при розділенні флуорогенів (речовин, які здатні флуоресціювати випромінюванням різної довжини хвилі (різного забарвлення)). Флуорогени можуть утворюватись також як продукти хімічної реакції на хроматографічній пластинці. Непряме проявляння використовується для ширшого кола речовин і передбачає введення флуоресціюючих речовин до складу сорбенту. У цьому випадку під дією УФ-випромінювання починає флуоресціювати вся поверхня пластинки за винятком зон речовин, які частково або повністю гасять флуоресценцію. При цьому зони виступають у вигляді темних плям на флуоресціюючому фоні. Хімічні (проявляючі) реагенти розпилюють у вигляді аерозолю по пластинці за допомогою пульверизатора. Випробовувані речовини утворюють забарвлені продукти з реагентом за рахунок взаємодії з однією або декількома функціональними групами. При відповідному підборі реагентів таким способом можна виявити практично будь-яку сполуку. Хімічні реагенти умовно класифікують на універсальні та селективні. До універсальних реагентів відносять кислий водний розчин калію перманганату (зони речовин спостерігаються у вигляді жовтих або коричневих плям на фіолетово-червоному фоні сорбенту), розчин фосфорномолібденової кислоти при нагріванні (поява синіх плям речовин на жовтому фоні) тощо. Як селективні використовують, наприклад, реактив Драгендорфа (комплексна сполука вісмуту і калію йодиду), реактив Цімермана (лужно-спиртовий розчин динітробензолу), суміш нінгідрину з етанолом і ацетатною кислотою. Реактив Драгендорфа використовується для виявлення амінів, алкалоїдів, стероїдів, реактив Цімермана – для стероїдів, за допомогою розчину нінгідрину детектують плями амінів, амінокислот, білків. Зони речовин на хроматограмах можна виявляти також хімічним або термічним обвуглюванням. Термічне обвуглювання використовується рідко через інтенсивне відбивання теплового випромінювання білою поверхнею сорбенту. Хімічне обвуглювання проводять концентрованою сульфатною кислотою або насиченим розчином калію дихромату у 70 % розчині сульфатної кислоти. Якісний аналіз. Для ідентифікації речовин на хроматографічних пластинках використовують коефіцієнт рухливостіRf(або Rf –фактор) і відносний коефіцієнт рухливості Rst.
У ТШХ величину Rf визначають як відношення відстані, пройденої центром зони речовини (h), до відстані, пройденої фронтом розчинника (H): Rf = Відносний коефіцієнт рухливості Rst дорівнює відношенню Rf випробовуваної речовини (Rfi) до Rf речовини-стандарту (Rfst) або відношенню відстаней, пройдених випробовуваною речовиною і речовиною-стандартом:
Rst =
Величину Rst визначають у тих випадках, коли пробу і стандарт аналізують одночасно на одній пластинці. При визначенні Rf дуже важко добитись відтворюваності результатів, оскільки вона залежить від активності сорбенту, площі зони, товщини шару, ступеня насичення камери, відносної вологості сорбенту і температури. Величина Rst є більш універсальною характеристикою, як і всі відносні характеристики утримування в інших видах хроматографії. Однак, часто для порівняння результатів розділення величин Rst недостатньо і необхідно додатково описувати особливості форми зони, її площу і форму фронту розчинника. Як стандарт часто вибирають таку речовину, для якої у даних умовах Rf » 0,5. За хімічною природою стандарт вибирають близьким до досліджуваних речовин. При застосуванні стандарту величина Rst звичайно знаходиться в межах Rst = 0,1-10, оптимальні межі - 0,5-2. Для надійнішої ідентифікації досліджуваних компонентів використовують речовини-«свідки» - еталонні речовини, присутність яких передбачається в досліджуваній пробі. Якщо Rf досліджуваного компонента збігається (дорівнює) Rf речовини-«свідка», то можна з достатньо великою ймовірністю твердити, що речовина-«свідок» присутня у досліджуваній суміші (рис.4.5). Кількісний аналіз. Кількісне детектування в ТШХ проводять або безпосередньо на пластинці, або після видалення з пластинки випробовуваної речовини. Перший спосіб має переваги у тому випадку, коли аналізують велику кількість сполук, а другий – при аналізі обмеженої кількості компонентів. Речовину можна вимити з шару сорбенту на пластинці розчинником і отриманий розчин проаналізувати за допомогою тих чи інших методів (спектрофотометричним, газо-хроматографічним чи за допомогою ВЕРХ). Детектування безпосередньо на пластинці можна проводити візуально, а також вимірюючи флуоресценцію, площу зон або інтенсивність відбитого (пропущеного) світла. Візуальна оцінка дозволяє в кращому випадку отримати напівкількісні (приблизні) дані, вона найбільш зручна у випадку чергування зон випробовуваних речовин і стандартів. Всі зони випробовуваних речовин повинні містити однакову кількість компонента, а зони стандарту – послідовне збільшення кількості. Після розділення порівнюють розміри зон речовини і стандарту і інтенсивність їх забарвлення і таким чином визначають кількість випробовуваної речовини. Методи вимірювання флуоресценції застосовувані до флуоресціюючих речовин і сполук, з яких через відповідні перетворення можна отримати їхні флуоресціюючі похідні. Оскільки інтенсивність флуоресценції зони не залежить від її форми, то попередньо будують калібрувальний графік залежності кількості речовини від інтенсивності флуоресценції. Промисловість випускає спеціальні пристрої для проведення таких вимірювань. Вимірювання площ зон є достатньо трудомістким процесом порівняння розміру зон. Площа зони – це не лінійна функція концентрації, однак графік залежності кореня квадратного з площі зони від концентрації переважно представляє пряму лінію. Якщо зона має чіткі межі, вимірювання можна проводити будь-яким методом: візуальним порівнянням з зонами стандартів, репродукуванням ручним або іншим способом зон з наступним зважуванням вирізаних проекцій, підрахунком площі за допомогою планіметра. Кращим методом кількісного детектування в ТШХ є вимірювання пропускання світла пластинкою. Цей спосіб базується на поглинанні світла забарвленими або обвугленими зонами. Графік залежності поглинання світла від кількості речовини у зоні переважно лінійний. На цьому принципі базується робота денситометрів. Метод відбивання базується на тому ж принципі з тією лишень різницею, що вимірюють не пропущене світло, а відбите. Для вимірювання відбитого світла також використовують прилади. Безпосередньо на хроматограмах кількісний аналіз можна проводити також спектрофотометричними методами за спектрами поглинання (фотоденситометрія) і за спектрами відбивання, а також флуориметричним, рентгенфлуоресцентним і радіометричним методами. Останнім часом поширюється мікротонкошарова хроматографія, яка використовує пластинки розміром 6´6 см з товщиною шару 150-200 мкм, сорбенти з розміром частинок 2-5 мкм, шлях проходження розчинника до 5 см. Цим методом можна визначати залишкові кількості токсичних елементів у воді, відходах і тому він з успіхом може бути використаним при аналізі об’єктів навколишнього середовища. Створений ТШХ-аналізатор, який дозволяє після розділення автоматично вимивати компоненти із шару сорбенту на пластинці для наступного визначення. Практикують використання комп’ютерів у складній детектуючій системі, а також зміни температури вздовж хроматографічної пластинки, градієнтне елюювання у процесі розділення тощо. Використання комп’ютерів дозволяє створити експресний і високоточний метод високоефективної тонкошарової хроматографії, повністю автоматизувати процес детектування з використанням спеціальних програм.
Поиск по сайту: |
 Рис. 4.3. Камера для хроматографічного аналізу речовин у тонкому шарі сорбенту
Рис. 4.3. Камера для хроматографічного аналізу речовин у тонкому шарі сорбенту



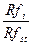 .
.