 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Лабораторна робота № 6.1
Лабораторна робота №6 ХІМІЧНА КІНЕТИКА Мета роботи – ознайомитися з методами вивчення кінетики гомогенних та гетерогенних реакцій, навчитися експериментальним шляхом визначати константу швидкості реакції. Теоретичні відомості Хімічна кінетика вивчає швидкість проходження хімічних реакцій та залежність її від різноманітних чинників – концентрації реагуючих речовин, температури, впливу каталізаторів тощо. Прості речовини та хімічні сполуки, що вступають до реакції, називаються вихідними речовинами. Кінцеві речовини, які утворюються в реакції і не зазнають змін в ході перебігу подальших хімічних перетворень, називаються продуктами реакції. Речовини, що виникають в одних і зникають в інших стадіях хімічного процесу, називаються проміжними, а реакції утворення та розкладу цих речовин – проміжними. Розрізняють два типи реакцій: гомогенні та гетерогенні. Гомогенними називають такі реакції, при яких всі вихідні речовини і продукти реакції перебувають в одній і тій самій фазі, наприклад, в газовій, або в розчині. Гетерогенними називають такі реакції, при яких процес відбувається на межі розділу двох фаз, і речовини, що беруть участь у реакції (в тому числі і каталізатор), перебувають у різних фазах. Швидкістю хімічної реакції називають зміну концентрації будь-якої з речовин, що беруть участь у реакції за одиницю часу і в одиниці певного об’єму. Швидкість реакції знаходять, як правило, за концентрацією вихідних речовин. Позначивши через υ швидкість реакції, що проходить за постійної температури, dС – зміну концентрації однієї з вихідних речовин за нескінченно малий час реакції dτ, одержуємо:
Знак "–" у рівнянні (6.1)береться тому, що позитивному приросту часу відповідає негативна зміна концентрації; а за фізичним змістом швидкість реакції завжди позитивна. В основі хімічної кінетики одностадійних реакцій лежить закон дії мас, згідно з яким швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин. Причому кожна з концентрацій береться в степені, що дорівнює стехіометричному коефіцієнту (п1, п2, п3,...), який стоїть перед формулою даної сполуки в рівнянні реакції. На підставі цього закону можна записати:
Коефіцієнт пропорційності К для даної реакції при сталій температурі є величиною постійною і називається константою швидкості реакції. На відміну від швидкості υ константа швидкості реакції К не залежить від концентрації для даної реакції при даній температурі. З рівняння (6.2) випливає фізична суть константи швидкості: вона чисельно дорівнює швидкості реакції за умови, що концентрація кожної з вихідних речовин дорівнює одиниці C1=C2 =С3 =1 Кінетично хімічні реакції розрізняють за ознакою молекулярності або порядку реакції. Молекулярність реакції визначається числом молекул, одночасною взаємодією яких здійснюється елементарний акт хімічного перетворення. Розрізняють реакції мономолекулярні, бімолекулярні, тримолекулярні. (Останні трапляються надзвичайно рідко). Молекулярність реакції не відбиває наявності проміжних стадій. Швидкість складної реакції визначається швидкістю найповільнішої стадії, тобто кінетично складна реакція описується закономірностями цієї стадії. У зв’язку з цим складні реакції зручніше характеризувати не молекулярністю, а порядком. Порядок реакції дорівнює сумі показників степенів концентрацій у рівнянні, яке передає залежність швидкості реакції від концентрації реагуючих речовин. Для реакцій першого порядку кінетичне рівняння включає концентрацію однієї речовини:
Поділяючи змінні та інтегруючи рівняння (6.3), одержуємо:
Сталу інтегрування визначають, беручи до уваги, що при τ=0 і С=Со (Со– початкова концентрація), lnСо=const. Підставляючи це значення у рівняння (6.4), одержуємо кінетичне рівняння реакції першого порядку:
Якщо початкову концентрацію позначити а (тобто Cо), акількість речовини, яка зазнала змін за час τ, через х (тобто C = а – x),одержуємо:
Одна з важливих кінетичних характеристик – період піврозпаду τ1/2 – час, за який прореагує половина початкової кількості речовини, тобто момент, коли х=а/2. Підставивши це значення у рівняння (6.6), одержуємо період піврозпаду для реакції першого порядку:
Отже, період піврозпаду для реакцій першого порядку не залежить від початкової концентрації. Якщо один з компонентів міститься у великому надлишку, тобто його концентрація практично не змінюється з часом, то такі бімолекулярні реакції протікають за законами реакцій першого порядку. Класичним прикладом такої реакції є реакція гідролізу (інверсії) сахарози у водному розчині або розчинення бензойної кислоти у воді. Такі реакції називаються псевдомономолекулярними. Порядок реакції встановлюється експериментально. Один з простих методів полягає в тому, що дослідні дані зміни концентрації з часом підставляють в кінетичне рівняння першого або другого порядків. Порядок реакції визначають за рівнянням, яке найкраще задовольняє умову сталості константи швидкості. Якщо період піврозпаду не залежить, від початкової концентрації, говорять про реакцію першого порядку; якщо він обернено пропорційний початковій концентрації – про реакцію другого порядку. При підвищенні температури швидкість хімічних реакцій зростає. Для більшості реакцій справджується приблизне правило Вант-Гоффа, згідно з яким при підвищенні температури на 10 °С збільшується константа швидкості реакції в 2–4рази. Математично це можна записати так:
Більш точно залежність константи швидкості реакції від температури Т можна пояснити, використавши рівняння Арреніуса:
де Е –енергія активації; R – універсальна газова стала. Після інтегрування рівняння (6.9) набуває вигляду:
або представивши в експоненційній формі, отримаємо:
де Ko – емпірична константа, яка називається передекспоненційним множником. Розглянемо фізичний зміст поняття "енергія активації". Умовою протікання реакції є ефективне зіткнення часток, число яких становить малу частку від загального числа зіткнень. Ефективними є зіткнення між активними часточками, які мають підвищений запас енергії. Енергія активації – це мінімальна енергія, яку повинні мати реагуючі часточки, щоб зіткнення між ними призвело до реакції. Частки, енергія яких більше або дорівнює Е, називаються активними. Активацію можна здійснити, підводячи до системи енергію за рахунок нагрівання системи, або здійснюючи електричний розряд опроміненням. Енергію активації визначають експериментально. Каталізаторами називають речовини, які, як правило, прискорюють хімічну реакцію, беруть участь в тій чи іншій стадії реакції, але в результаті реакції залишаються незмінними хімічно. Збільшення швидкості реакції під дією каталізатора можна пояснити тим, що каталізатор знижує енергію активації реакції, збільшуючи тим самим частину активних молекул. Одночасно каталізатор збільшує ентропію активації. За агрегатним станом каталізатора і речовин, які беруть участь у реакції, каталіз поділяють на гомогенний і гетерогенний. У випадку гетерогенного каталізу хімічна реакція проходить на межі розділу фаз, каталізатор – реагуючі речовини. При гомогенному каталізі каталізатори перебувають в одній фазі з реагуючими речовинами. Найпоширеніші гомогенні каталізатори – кислоти, основи, іони перехідних металів та їх комплекси і біологічні каталізатори (ферменти або ензими). Каталітичним реакціям притаманні такі особливості: – у процесі реакції кількість каталізатора залишається незмінною; – каталізатор не змінює хімічних властивостей, але може змінюватись фізично – старіти, "отруюватись"; – мізерно мала кількість каталізатора порівняно з кількістю реагуючої речовини значно змінює швидкість реакції; – як правило, дія каталізатора специфічна, але існують каталізатори, які прискорюють багато реакцій, наприклад, іони Н+ у гомогенному каталізі; – у оберненій реакції каталізатор не зміщує рівноваги, однаковою мірою прискорюючи пряму та зворотну реакції. На реакції, які термодинамічно неможливі, каталізатор не впливає. У гетерогенному процесі взаємодія відбувається на поверхні поділу фаз або в безпосередній близькості від неї. У системах з двох або більше компонентів взаємодія на поверхні розділу фаз призводить до виникнення різниці у складах поверхневого і внутрішнього шарів даної фази і, отже, процесу вирівнювання складів цих шарів. Якщо процес не прискорюється перемішуванням, а відбувається лише внаслідок дифузії, швидкість всього процесу, як правило, визначається швидкістю вирівнювання складів (швидкість найповільнішої стадії). На поверхні поділу фаз рівновага досягається значно скоріше. Прикладом гетерогенного процесу може бути процес розчинення бензойної кислоти у воді. У більшості гетерогенних процесів спільна швидкість дуже збільшується при перемішуванні. Але вплив дифузії в цьому випадку не зникає, бо при перемішуванні вирівнюється концентрація в більшій частині об’єму, але біля самої поверхні поділу завжди залишається невеликий дифузійний шар, який не перемішується, і вирівнювання концентрації здійснюється через нього за допомогою дифузії. Чим інтенсивніше перемішування, тим тонший дифузійний шap, тим менша роль дифузії у зменшенні швидкості процесу в цілому. В деяких випадках це може привести до того, що швидкість вирівнювання складів може стати більшою за швидкість взаємодії на самій поверхні, і тоді загальна швидкість всього процесу буде визначатися швидкістю цієї взаємодії як найповільнішої стадії сумарного процесу. Необхідно відзначити також вплив поверхні поділу фаз та її стану на швидкість реакції. Швидкість зростає при збільшенні площі поверхні поділу фаз при проведенні процесу за умов, коли ця поверхня безперервно оновлюється. Вимірювання швидкості реакції базується на визначенні концентрації реагуючих речовин. Концентрації визначають поляриметричним та рефрактометричним методами, вимірюванням електричної провідності, титруванням тощо. Класичний приклад гетерогенної реакції – це розчинення твердої речовини в рідкому розчиннику. Кінетика таких гетерогенних реакцій найкраще вивчена. В цьому випадку процес розчинення складається з двох стадій: самого розчинення і відведення розчиненої речовини в об’єм розчину за допомогою дифузії. Обидві стадії мають різні швидкості і кінетика розчинення залежить від співвідношення цих швидкостей. У багатьох випадках швидкість розчинення твердих тіл визначається швидкістю дифузійних процесів як найповільніших. Шар насиченого розчину товщиною d при перемішуванні прилипає до твердої поверхні, але при збільшенні швидкості перемішування товщина шару d зменшується і збільшується швидкість дифузії речовини з прилеглого шару товщиною d в об’єм розчину. Оскільки швидкість дифузії визначає швидкість всього процесу, швидкість розчинення зростає при збільшенні інтенсивності перемішування.
Лабораторна робота № 6.1
Поиск по сайту: |
 (6.1)
(6.1) (6.2)
(6.2)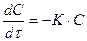 ,(6.3)
,(6.3)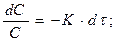
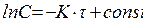 (6.4)
(6.4)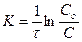 (6.5)
(6.5)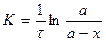 (6.6)
(6.6) . (6.7)
. (6.7) (6.8)
(6.8)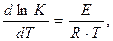 (6.9)
(6.9) (6.10)
(6.10)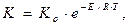 (6.11)
(6.11)