 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Экспериментальные методы определения порядка реакции
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ
Основные понятия химической кинетики Химическая термодинамика позволяет прогнозировать направление самопро-извольной реакции, однако не может предсказывать время самопроизвольного превращения. На этот вопрос отвечает химическая кинетика. Химическая кинетика — раздел физической химии, посвященный изучению механизма, особенностей, скорости протекания химических реакций, влияния на них различных факторов. Изучением математической зависимости скорости реакции от различных факторов (времени, условий процесса, концентрации) занимается формальная кинетика. Молекулярная же кинетика занимается изучением механизма химического взаимодействия. Методы химической кинетики широко используются в биологии, медицине и большое значение имеют для фармации. Скорости протекания различных этапов превращения веществ в организме изучает хемобиокинетика. Обычно скорости биохимических реакций в организме сбалансированы. Изменение скорости какой- либо реакции может вызвать патологию с одной стороны, с другой – лежать в основе защитной и компенсаторной функции организма. Поэтому, физиоте-рапевтические методы лечения основаны на изменении условий протекания реакций, а фармакотерапевтические методы – на введении веществ, влияющих на скорость биохимической реакции. Также при хранении лекарственных препаратов могут протекать реакции, скорость которых определяет срок годности лекарств. В связи с этим можно выделить ферментативную (изучает биохимические реакции, катализируемые ферментами), фармакологическую (изучает процессы поступления в организм, превращения в нем и выведения из него лекарственных препаратов), токсикологическую кинетику (изучает процессы попадания в организм, превращения в нем и выведения из него токсических веществ). В зависимости от агрегатного состояния участников химической реакции, раз-личают гомогенные и гетерогенные реакции. Поэтому точное определение ско-рости реакции отсутствует. Обычно под ней подразумевается число элементарных актов в единице объема за единицу времени (для гомогенных реакций) или число элементарных актов на единице поверхности в единицу времени. Под элементар-ным актом понимают единичный акт взаимодействия или превращения частиц, в результате которого образуются новые частицы. Различают мгновенную и среднюю скорости химической реакции.
ка зависимости концентрации от времени). Изменение концентрации вещества во времени называют средней скоростью реакции: u = + Скорость реакции зависит от природы реагирующих веществ, температуры, наличия катализатора, концентрации, давления (в случае газофазного реагента) и других факторов. Влияние температуры на скорость реакции определяется правилом Вант- Гоффа ( и природу веществ. Величина энергии активации зависит от температуры. При небольших интервалах температур этой зависимостью можно пренебречь, тогда
Зависимость скорости реакции от концентрации реагирующих веществ подчи-няется закону действующих масс: «скорость химической реакции прямо пропор-циональна произведению действующих масс — молярных концентраций реаген-тов, взятых в степенях, равных стехиометрическим коэффициентам в уравнении химической реакции», например: для гомофазной (газо- или жидкофазной) реак-ции aA + bB = cAB скорость химической реакции описывается формулой u = k.Ca(A).Cb(B). k - константа химической реакции - это скорость химической реакции при концентрациях реагирующих веществ, равных единице. Константа скорости зависит от природы веществ, температуры, наличия катализатора, но не зависит от концентрации. Сумма показателей степени при концентрациях (a + b) в кинетическом урав-нении определяет суммарный (общий) порядок реакции. Однако, во многих урав-нениях реакций коэффициенты могут быть достаточно большими и если подста-вить их в формулу, то скорость реакции окажется невероятно большой. Это гово-рит о том, что такие реакции являются сложными, многостадийными, а скорость таких реакций определяется её самой медленной стадией, которая называется лимитирующей. Для упрощения сложных реакций вводятся понятия молекуляр-ность и порядок реакции. По числу молекул, участвующих в элементарном акте химического превращения, различают моно-, би- и тримолекулярные реакции. Вероятность одновременного столкновения трех молекул ничтожно мала, поэтому трехмолекулярные реакции немногочисленны, а четырехмолекулярные реакции вообще отсутствуют. К одномолекулярным реакциям относятся процессы распада молекул на более простые составные части, например: СН3СОСН3®С2Н4 +СО+Н2, СаСО3 ® СаО + СО2 и др. Примером двумолекулярной реакции является H2 + I2 ® 2HI, Нb + O2 ® HbO2, а тримолекулярной реакции – 2NO + O2 ® 2NO2. По величине (a + b) различают реакции нулевого, дробного, первого, второго и третьего порядков. Экспериментальные методы определения порядка реакции Определение порядка реакции способствует выяснению ее механизма. Существует несколько способов нахождения порядка реакции. Метод подстановки. По этому методу в начале определяют концентрации веществ в различные моменты времени от начала реакции, а затем производят расчет констант скоростей, используя уравнения нулевого, первого, второго, третьего порядка. Выясняют, по какому уравнению расчет дает практически постоянную величину константы с небольшими отклонениями. Этому порядку подчиняется исследуемая реакция. Графический метод заключается в построении графика, выражающего зависи-мость различных функций концентрации от времени: для реакции первого порядка – lgС = f(t), для реакции второго порядка – 1/C = f (t), для реакции третьего по-рядка 1/C2 =f(t). Отложив на оси абсцисс время t, а на оси ординат lgС, 1/C и 1/C2 для изучаемой реакции получают при линии. Та из них, которая будет прямой, соответствует этому порядку реакции, две другие линии окажутся кривыми. Метод определения периода полупревращений основан на определении промежутка времени, в течение которого концентрации или количества исходных веществ уменьшаются ровно в два раза. Если период полупревращений не зависит от концентрации, то реакция является реакцией первого порядка, если обратно пропорционален начальной концентрации в первой степени, то реакция второго порядка; если период полупревращений обратно пропорционален начальной концентрации во второй степени, то реакция третьего порядка. Метод Вант-Гоффа или изоляции (избытка) заключается в экспериментальном определении, каким образом влияет изменение концентрации только одного из реагентов на скорость реакции. Определяя скорость реакции при различных кон-центрациях реагентов и строя график зависимости логарифма скорости реакции
Классификация реакций Характер протекания химического превращения зависит от его механизма. По механизму различают простые и сложные реакции. Простые реакции осуществ-ляются посредством однотипных элементарных актов (в результате непосред-ственного взаимодействия молекул или частиц реагентов), например: взаимодействие ионов: Ag+ + Hal- = AgHal, Ba2+ + SO42- = BaSO4 и др. Простые реакции являются одностадийными. Если превращение состоит из двух и более актов (простых реакций), то реакция является сложной. Все биохимические процессы являются сложными. Кинетика сложных реакций зависит от формы связи между простыми реакциями, от соотношения их скоростей. По принципу независимости простых реакций, если в системе протекают одновременно несколько реакций, то каждая из них независима друг от друга и ее скорость определяется кинетическими уравнениями простых реакций. По степени сложности реакции подразделяются на обратимые, необратимые, параллельные, сопряженные, последовательные и цепные. Обратимыми являются реакции, протекающие одновременно в двух противоположных направлениях. Скорость обратимой реакции определяется разностью скоростей прямой и обратной реакций. Последовательными называются сложные реакции, состоящие из нескольких стадий, следующих друг за другом. В последовательных реакциях образование конечного продукта реакции (Р) из исходных веществ (S) происходит через ряд промежуточных продуктов или интермедиатов (Х1, Х2): S ®X1 ® X2 ® ….® P.
Скорость таких реакций определяется скоростью наиболее медленной (лими-тирующей) стадии. В ходе превращений концентрация субстрата монотонно уменьшается со временем, а интермедиата вначале возрастает, а затем умень-шается, а концентрация конечного вещества монотонно увеличивается (рис.16). Подобными закономерностями в фармакокинетике описывают метаболизм лекарств, который рассматривают как последовательность процессов всасывания лекарства в кровь и выведения его из крови в мочу. Исходя из такого подхода можно прогнозировать вводимую дозу лекарства и время приема очередной зоны. Если исходные вещества одновременно реагируют в нескольких направлениях, то такие реакции называются параллельными. Для таких реакций характерно протекание нескольких процессов с участием одних и тех же исходных веществ. Они завершаются образованием разных продуктов реакции. Например, в организме глюкоза одновременно окисляется (до СО2 и Н2О), превращается в этанол, молочную, масляную и лимонную кислоты. Скорость таких реакций определяется скоростью наиболее быстрой стадии. Сопряженными (или конкурирующими) являются реакции типа А + В ® С, А + М ® D, из которых одна протекает лишь совместно с другой, т.е когда одна реакция вызывает протекание другой, неосуществимой в отсутствии первой. В таких реакциях, например, вещество В служит индуктором (катализатором, инициатором) второй реакции, а вещество М будет акцептором. Вещество А является общим для обеих реакций и оно называется актором. Примером сопряженных реакций являются реакции: FeSO4 + H2O2 ® Fe2(SO4)3 + H2O, HI + H2O2 ® I2 + H2O. Вторая реакция может идти только при одновременном протекании первой. H2O2 – актор, FeSO4 – индуктор, HI – акцептор. Реакции, протекающие через ряд регулярно повторяющихся элементарных реакций с участием радикалов, атомов или ионов, называют цепными реакциями. К ним относят реакции горения, крекинга, полимеризации, конденсации, распада ядер, фотохимические реакции, пероксидное окисление липидов в организме. Механизм цепных реакций состоит в том, что свободные радикалы и атомы, имеющие неспаренные электроны, обладают высокой химической активностью. Они легко реагируют с устойчивыми молекулами и приводят их в активное состояние. Эти молекулы, в свою очередь, образуют продукты реакции и новые активные частицы (радикалы), инициирующие цепь дальнейших взаимодействий. Цепная реакция продолжается до тех пор, пока не прореагирует все вещество или пока не исчезнут активные частицы. Цепные реакции включают этап зарождения, развития и обрыва цепи. Зарождение цепи начинается с элементарного химического акта, в результате которого образуется активная частица. Это эндотермический процесс, который может идти при нагреве вещества или при облучении светом. Развитие цепи представляет собой периодическое повторение стадий реакции с участием активных частиц. По особенностям стадии развития цепные реакции делятся на разветвленные и неразветвленные. В случае неразветвленных реакций число активных частиц остается неизменным, а в случае разветвленных реакций число активных частиц увеличивается. Обрыв цепи соответствует исчезновению активных частиц. Потеря активности частицами может происходить при адсорбции частиц стенками сосуда, при столкновении двух активных частиц с третьей, которая отбирает избыточную энергию. Скорость цепных реакций определяется скоростью лимитирующей стадии зарождения цепи. Реакции, которые осуществляются под воздействием электромагнитных колебаний видимого и ультрафиолетового спектра света, называются фотохимическими реакциями. В них молекулы вещества поглощают квант энергии и активизируются, участвуюя в последующих реакциях, не требующих освещения для своего протекания. Скорость фотохимических реакций определяется интенсивностью света, концентрацией вещества, длиной волны и частотой света. Примером фотохимической реакции служит фотосинтез углеводов, синтез витамина Д из холестерола и эргостерола под действием УФ-света, фотоизомеризация цис-ретиналя в транс-ретиналь Почти все биохимические процессы имеют каталитический характер. В качестве катализаторов биохимических процессов выступают ферменты (энзимы). Поэтому эти процессы называются ферментативным катализом. Например, 1 моль фермента каталазы при 00С за 1 мин обеспечивает разложение 5 млн. молекул Н2О2 или гидролиз мочевины в присутствии следов уреазы ускоряется в миллиарды раз, тогда как в обычных условиях мочевина разлагается в течение 32 лет. В настоящее время известно около двух тысяч ферментов, из них 150 удалось выделить в чистом виде. В отличие от обычных катализаторов, ферменты ускоряют реакции в сотни и тысячи раз, проявляют каталитическую активность в довольно мягких условиях (35 – 400С, атмосферное давление), обладают высокой избирательностью, т.е. ускоряют только одну определенную биохимическую реакцию. В связи с этим различают субстратную и групповую специфичность. Многие ферменты проявляют каталитическую активность только по отношению к одному субстрату. Ферменты с групповой специифичностью обеспечивают превращения разных субстратов, имеющих определенные структурные фрагменты. Например, пищеварительные ферменты (пепсин, трипсин) расщепляют пептидные связи самых разных белков. Большинство ферментативных реакций описывается кинетическими уравне-ниями нулевого порядка. При высокой концентрации субстрата, обеспечивающей полное насыщение всех активных центров фермента, скорость реакции перестает зависеть от концентрации субстрата. Однако скорость реакции будет зависеть от концентрации фермента, т.е. она имеет первый порядок по катализатору. Механизм ферментативной реакции в общем виде можно представить следующей схемой: E + S « ES « E + P Где Е - фермент (энзим), S - субстрат, т.е объект, на которое действует биохимический катализатор; ES - фермент-субстратный комплекс (интермедиат), Р - конечный продукт. Фермент-субстратный комплекс распадается по двум путям: по одному пути образуется исходная молекула субстрата и фермента Е, а по другому пути образуется молекула продукта Р и регенирируется молекула фермента Е. Распад фермент-субстратного комплекса протекает по уравнению первого порядка и эта стадия является более медленной, т.е. лимитирующей стадией. Количественное соотношение между скоростью ферментативной реакции и концентрацией субстрата определяется уравнением Михаэлиса-Ментена (1913 г.):
uмах - скорость химической реакции в присутствии катализатора, С(S) - равно-весная концентрация субстрата, КМ - константа Михаэлиса, которая определяется природой катализатора и имеет значение от 0,1 до 10-6 моль/л.
Поиск по сайту: |

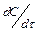 ). Её опреде-ляют как тангенс угла наклона каса-тельной к кинетической кривой (графи-
). Её опреде-ляют как тангенс угла наклона каса-тельной к кинетической кривой (графи-
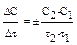 . Единицей измерения скорости химических реакций в СИ является моль/л.с. В биохимических исследованиях может применяться единица мг/100 мл.с. Скорость химической реакции определяют химическими (титриметрия, графиметрия и др.), физическими (по спектрам поглощения в УФ, видимой и инфра-красной областях, ЭПР и ЯМР) и биохимическими методами.
. Единицей измерения скорости химических реакций в СИ является моль/л.с. В биохимических исследованиях может применяться единица мг/100 мл.с. Скорость химической реакции определяют химическими (титриметрия, графиметрия и др.), физическими (по спектрам поглощения в УФ, видимой и инфра-красной областях, ЭПР и ЯМР) и биохимическими методами. ) и уравнением Аррениуса (
) и уравнением Аррениуса (  ). Последнее учитывает
). Последнее учитывает .
. Рис.15. Определение порядка реакции по
методу Вант-Гоффа
Рис.15. Определение порядка реакции по
методу Вант-Гоффа
 Рис.16. Кинетические кривые субстрата (Cs), интермедиата (Cx) и продукта (Cp) в последовательной реакции S ®X® P
Рис.16. Кинетические кривые субстрата (Cs), интермедиата (Cx) и продукта (Cp) в последовательной реакции S ®X® P
 , где
, где Рис. 17. Определение константы Михаэлиса по Лайнуиверу и Бэрку.
Рис. 17. Определение константы Михаэлиса по Лайнуиверу и Бэрку.
 . По значению КМ можно судить о прочности фермент-субстратного комплекса: чем меньше значение КМ, тем прочнее комплекс.
. По значению КМ можно судить о прочности фермент-субстратного комплекса: чем меньше значение КМ, тем прочнее комплекс.