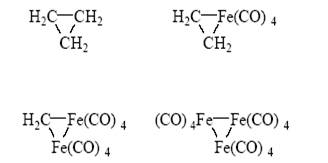|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Место каталитической химии в системе химических знаний ⇐ ПредыдущаяСтр 3 из 3
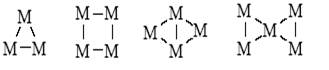
В первой половине ХХ века две области химии – неорганическая и органическая – развивались весьма обособленно. Сильно различались структуры соединений, использовались разные подходы к реакционной способности, нарабатывались свои собственные эмпирические правила[16]. В неорганической химии активно синтезировали и изучали комплексные соединения с центральным атомом металла (особенно в растворах), изучали структуры и свойства кристаллических и аморфных соединений металлов (оксиды, соли, карбиды, нитриды, гидриды) и интерметаллидов. Связь элемент–элемент была характерной для бороводородов, полимеров серы (S8, S12) и фосфора (P4), твердых металлов и интерметаллидов (InAs, Nb3Sn, Fe3Ni, LaNi5 и др.) Химики-органики имели дело в основном с линейными и циклическими цепочками из атомов углерода и с соединениями, содержащими связи элемент–углерод (элемент – O, Hal, N, S, Si, P, B, Al, щелочные и щелочно-земельные и непереходные металлы). Общими для этих двух областей химии были лишь представления о локализованных двухэлектронных двухцентровых связях и метод валентных схем (метод резонанса), хотя в неорганической химии отдавали предпочтение теории кристаллического поля (для комплексов переходных металлов). Начиная с открытия структур ферроцена и дибензолхрома быстрыми темпами стала развиваться химия металлоорганических соединений переходных металлов, особенно после того как были подвергнуты ревизии правила Менделеева и Несмеянова о принципиальной нестабильности связи М–С, если М – переходный металл[17]. Стало ясно, что дело не в прочности связи (энергия связи Pt–C оказалась в 2 раза и более выше энергии связи Hg–C в стабильных ртутьорганических соединениях), а в кинетической лабильности таких молекул, то есть в их очень высокой реакционной способности[18]. Вторая половина текущего века ознаменовалась синтезом соединений с цепочками и циклами из атомов металла, связанных с лигандами, в неорганической и металлоорганической химии (кластеры металлов):
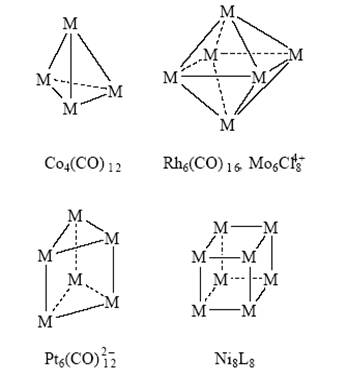
В органической химии синтезировали каркасные соединения (полиэдраны) – призман, тетраэдран, кубан и др. Такие же и более сложные полиэдры, но из атомов металла получены в координационной химии:
Рекордные значения m в металлических кластерах получены в комплексах палладия (m = 561)[19]. К началу 1990-х годов стало ясно, что нет принципиальной разницы в структурах молекул, содержащих скелеты из атомов металла, атомов углерода или из атомов других элементов. Химия самого углерода пополнилась новым классом молекул – полиэдранов Сn (С60, С70 и др.). Молекула С60 (фуллерен), растворимая в ароматических углеводородах, имеет структуру усеченного икосаэдра и участвует в разнообразных химических реакциях. Метод молекулярных орбиталей становится единым подходом для описания природы связи в любых соединениях и их реакционной способности. Предложенный Р. Хофманом анализ фрагментов и “принцип изолобальности” завершил объединение теоретических подходов к реакционной способности органических, металлоорганических и металлокомплексных соединений[20]. Согласно этому принципу, легко реагируют группы (фрагменты молекул, молекулы), имеющие одинаковое число электронов на граничных орбиталях, одинаковую симметрию орбиталей и близкие энергии орбиталей (изолобальные группы). Так, группы :СH2 и :Fe(CO)4 изолобальны и поэтому могут образовать следующий ряд соединений:
(Fe2(CO)8 присоединяет еще одну молекулу СО и дает стабильный Fe2(CO)9):
Таким образом, появились единые типы структур и единый язык теоретического анализа. Естественно, каждая область химии продолжает развиваться в рамках своих собственных задач и внутренней логики, однако можно утверждать, что концептуальное объединение в химии (структуры, природа связи, теория реакционной способности) совершилось. На фоне объединения различных областей химии и продолжающейся дифференциации химических наук (биоорганическая и бионеорганическая химия) рассмотрим эволюцию химии каталитических процессов. Из скромного раздела физической химии (химическая кинетика и катализ) действительно сформировалась самостоятельная область химии – каталитическая химия. Интересно отметить, что еще в пятидесятые годы А.А. Баландин часто использовал такое название, считая каталитическую химию вершиной химических знаний[21]. Сегодня каталитическая химия и концептуально, и предметно, на уровне веществ, объединила различные области химии. Во-первых, каталитическая химия вобрала в себя все достижения координационной, органической и металлоорганической химии, ферментативного катализа, химии твердого тела, теории растворов и теории реакционной способности. Во-вторых, исходный катализатор (активный центр) и все промежуточные вещества в катализе металлсодержащими катализаторами практически всегда суть координационные соединения, а в катализе органических реакций промежуточные вещества почти всегда являются и металлоорганическими соединениями. Если еще принять во внимание сложность организации каталитического процесса (циклический характер), можно заключить, что каталитическая химия представляет собой сегодня высшую ступень эволюции химических знаний. Заключение Итак, катализ – это ускорение или возбуждение химических реакций в присутствии веществ – катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих после каждого цикла свой первоначальный химический состав[22]. Это определение не содержит никаких указаний на причину, по которой такое промежуточное взаимодействие между катализатором и реагентами вызывает ускорение химической реакции, но лишь описывает новый путь, по которому идет эта реакция с участием катализатора. Катализ занимает особое место как в системе наших знаний о веществах и их превращениях, так и в практической деятельности человека. Он лежит в основе существования растительного и животного мира, обеспечивая с помощью ферментов функционирование живых систем. В истории нашей цивилизации катализ не раз становился решающим фактором технического прогресса. Достаточно назвать лишь три промышленных каталитических процесса: синтез аммиака, крекинг нефти и полимеризация олефинов, чтобы убедиться в этом. Все сказанное в достаточной мере характеризует ту важную роль, которую играет катализ в сфере научной и практической деятельности современного человека. Существует, однако, одна специфическая особенность катализа, которая делает постановку вопроса, вынесенного в заголовок статьи, хотя и несколько неожиданной, но вполне оправданной. В отличие от других разделов химии в катализе пока не существует общей теории, способной заранее предсказать, будет ли данное вещество ускорять какую-либо реакцию. Широко известные теории катализа такие, как мультиплетная теория Баландина, теория активных ансамблей Кобозева, теория катализа на полупроводниках Доудена и многие другие теоретические концепции являются не общими, а частными моделями, относящимися к сравнительно узкому кругу каталитических систем. Но и эти частные теории лишь объясняют опытные факты. Отсутствие научной теории, способной предсказать каталитические свойства веществ, как раз и породило неоднократно встречавшееся в специальной литературе суждение о катализе скорее как об искусстве, чем науке. Полуторавековая история катализа как самостоятельного раздела химии показывает, что все известные катализаторы были открыты либо случайно, либо интуитивно, эмпирически. Объективную причину столь необычной в современной науке ситуации следует, по-видимому, искать в самой природе катализа и поразительном разнообразии каталитических процессов. Даже сейчас, когда новейшие экспериментальные методы позволяют подойти к изучению процессов катализа, а также самих катализаторов на атомно-молекулярном уровне и в масштабе реального времени, Природа не открывает тайну, как она это делает. Как в свое время отмечал Н.Н. Семенов, вопрос о теории катализа лежит в контексте более общей проблемы реакционной способности веществ. Принципиальные пути решения этой проблемы квантово-химическими методами сейчас достаточно детально разработаны, и прогресс полностью определяется уровнем развития вычислительной техники.
Список использованной литературы 1. Боресков Г.К. Гетерогенный катализ. – М.: Наука, 1999. – 304 с. 2. Боресков Г.К. Катализ. Избранные труды. – Новосибирск: Наука, 2004. 3. Боресков Г.К. Некоторые проблемы катализа. – М.:Знание, 2001. 4. Волков В.А., Вонский Е.В., Кузнецов Г.И. Выдающиеся химики мира. Биографический справочник. / Под ред. В.И.Кузнецова. М.: Высшая школа, 2004. 5. Гейтс Б., Кетцир Дж., Шуйт Г. Химия каталитических процессов. – М.: Мир, 2000. 6. Егоров В.В. Теоретические основы неорганической химии. Краткий курс для студ.cельхоз.вузов: Учебник. – Спб.: Лагь. – 2005. – 192 с. 7. Коллмен Дж., Хигедас Л., Нортон Дж., Финке Р. Металлоорганическая химия переходных металлов. – М.: Мир, 2004. 8. Коттон Ф.А., Уилкинсон Дж. Современная неорганическая химия. – М.: Мир, 1999. – Т. 3. 9. Коттон Ф.А., Уолтон Р. Кратные связи металл–металл. – М.: Мир, 1999. – Т. 1, 2. 10. Кузнецов В.И. Развитие учения о катализе. – М.: Наука, 1994. 11. Миронов А.Ф. Биосинтез тетрапиррольных пигментов // Соросовский Образовательный Журнал. – 2000. – № 7. 12. Моисеев И.И. Комплексы в жидкофазном окислении олефинов. – М.: Наука, 2002. 13. Моисеев И.И., Варгафтик М.Н. Успехи химии. – М.: 1999. – Т. 59. – № 12. 14. Романовский Б.В. Соединения включения на основе цеолитов: синтез, физико-химические свойства и применение как катализаторов // Кинетика и катализ. – 2003. – № 5. 15. Танабе К. Твердые кислоты и основания. – М.: Мир, 2003. 16. Темкин О.Н., Шестаков Г.К., Трегер Ю.А. Ацетилен. Химия. Механизмы реакций. Технология. – М.: Химия, 2003. 17. Химическая энциклопедия. – М.: Советская энциклопедия, 1988 – 1994. Т. 1 – 4. [1] Кузнецов В.И. Развитие учения о катализе. – М.: Наука, 1994.
[2] Волков В.А., Вонский Е.В., Кузнецов Г.И. Выдающиеся химики мира. Биографический справочник. / Под ред. В.И.Кузнецова. М.: Высшая школа, 2004.
[3] Боресков Г.К. Катализ. Избранные труды. – Новосибирск: Наука, 2004.
[4] Моисеев И.И. Комплексы в жидкофазном окислении олефинов. – М.: Наука, 2002.
[5] Моисеев И.И. Комплексы в жидкофазном окислении олефинов. – М.: Наука, 2002.
[6] Гейтс Б., Кетцир Дж., Шуйт Г. Химия каталитических процессов. – М.: Мир, 2000.
[7] Химическая энциклопедия. – М.: Советская энциклопедия, 1988 – 1994. Т. 1 – 4.
[8] Боресков Г.К. Катализ. Избранные труды. – Новосибирск: Наука, 2004.
[9] Гейтс Б., Кетцир Дж., Шуйт Г. Химия каталитических процессов. – М.: Мир, 2000.
[10] Танабе К. Твердые кислоты и основания. – М.: Мир, 2003.
[11] Коттон Ф.А., Уолтон Р. Кратные связи металл–металл. – М.: Мир, 1999. – Т. 1, 2.
[12] Моисеев И.И., Варгафтик М.Н. Успехи химии. – М.: 1999. – Т. 59. – № 12.
[13] Боресков Г.К. Некоторые проблемы катализа. – М.:Знание, 2001.
[14] Темкин О.Н., Шестаков Г.К., Трегер Ю.А. Ацетилен. Химия. Механизмы реакций. Технология. – М.: Химия, 2003.
[15] Боресков Г.К. Гетерогенный катализ. – М.: Наука, 1999. – 304 с.
[16] Егоров В.В. Теоретические основы неорганической химии. Краткий курс для студ.cельхоз.вузов: Учебник. – Спб.: Лагь. – 2005. – 192 с.
[17] Коттон Ф.А., Уилкинсон Дж. Современная неорганическая химия. – М.: Мир, 1999. – Т. 3.
[18] Коллмен Дж., Хигедас Л., Нортон Дж., Финке Р. Металлоорганическая химия переходных металлов. – М.: Мир, 2004.
[19] Моисеев И.И., Варгафтик М.Н. Успехи химии. – М.: 1999. – Т. 59. – № 12.
[20] Химическая энциклопедия. – М.: Советская энциклопедия, 1988 – 1994. Т. 1 – 4.
[21] Романовский Б.В. Соединения включения на основе цеолитов: синтез, физико-химические свойства и применение как катализаторов // Кинетика и катализ. – 2003. – № 5.
[22] Егоров В.В. Теоретические основы неорганической химии. Краткий курс для студ.cельхоз.вузов: Учебник. – Спб.: Лагь. – 2005. – 192 с.
Поиск по сайту: |