 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
тарау. КАТАЛИЗ ТЕОРИЯЛАРЫ
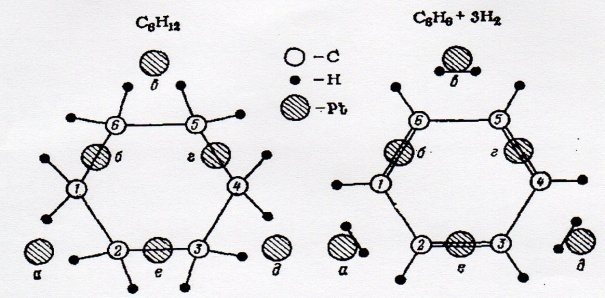
Қазіргі кезде катализдің біртұтас және танымал теориясы жоқ. Әр уақытта түрлі елдердің зерттеушілері бір-бірін толықтыратын каталитикалық әсерге түрліше физико-химиялық негізделетін жеке теорияларын ұсынды. Оларды екі топқа бөлуге болады: 1) катализатор қасиетіне физикалық, жеке алғанда адсорбционды негізделетін катализдегі бекітіліп, ие болатын теориялар; 2) каталитикалық әсердің мәніне химиялық тәсілмен негізделетін теориялар. I топқаадсорбцияның келесі түрлерімен болатын адсорбционды катализ теорияларын жатқызады: - біртекті және әртекті бетке нүктелік (бір орталықты) адсорбциялау (И.Лэнгмюр, X.С.Тейлор, С. З.Рогинский, Я.Б.Зельдович, М.И.Темкин және т.б.); - көп орталықты адсорбциясы (А.А.Баландиннің мультиплетті теориясы, геометриялық сәйкестілік принципі) және Н.И.Кобозевтің активті ансамбльдер теориясы. II группаға жатқызуға болады: - аралық химиялық қосылыстың бұрынғы теориясы (Д.И.Менделеев, П.Сабатье, Н.Д.Зелинский, В.Н.Ипатьев); - катализдің электрондық теориясы (Ф.Ф.Волькенштейн); - А.А.Баландиннің энергетикалық сәйкестілік принципіндегі мультиплетті теория; - Г.К.Боресковтың гетерогенді катализдегі қазіргі физико-химиялық теориясы (каталитикалық әсерді болжау теориясы). Катализде каталитикалық әсер физикалық және химиялық жағынан да маңызды екенін айта кеткен жөн. Сонымен, катализдің химиялық мәнінің білімінсіз катализатордың химиялық құрамын және таңду типін ғылыми түрде қисынға келтіру мүмкін емес, ал берілген катализатордағы каталитикалық реакцияның кинетикалық сипаттамасын фазааралық бөліну шекарасында жүретін физикалық және физико-химиялық процестердің заңдылықтарын түсіну мүмкін емес. Мысалы, адсорбционды (хемосорбциялық) процестер. Катализдің қазіргі физико-химиялық ұсыныстарымен сәйкесінше катализатор және реагирлеуші затты реактанттар тек катализатор қатысымен химиялық өзгерісге сыналады деп емес, сонымен қатар катализатор да олармен өзара әсерде болатын каталитикалық реакционды бірлік жүйе деп қарастыруға болады. Реакционды жүйедегі мұндай өзара әсерде жүрудің нәтижесінде ктализатор бетінің каталитикалық активтілігін анықтайтын стационарлы құрам қалыптасады. Осыдан көрінгендей, катализатор реакцияны жүзеге асырудың жәй ғана орны емес, химиялық әсердің тікелей қатысушысы деп қарастыру керек және оның каталитикалық активтілігі катализатордың химиялық табиғатымен және реактанттарға химиялық жақындылығымен шартталған. Каталитикалық реакционды жүйедегі химиялық табиғат әсерінің негізгі постулаттарына сүйене отырып каталитикалық әсерді болжаудың біршама маңызды термодинамикалық және кинетикалық принциптерін сипаттауға болды: 1. Катализатор реагирлеуші заттар компонентінің ең болмаса біреуімен химиялық әсерде болуы керек (координационды, ионды немесе ковалентті байланыстың түзілуі). 2. Каталитикалық реакционды жүйеде процесс кезіндегі еркін энергияның өзгерісі катализдеуші реакцияның еркін энергиясының өзгерісінен мейлінше теріс болуы керек. Яғни катализатор мен реагирлеуші заттың қосылысы реакция өніміне қарағанда термодинамикалық тұрақты болуы шарт (егер бұл талап орындалмаса катализатор қайта қалпына келмйтін берік химиялық қосылысты түзе отырып жүйеден тез шығып кетеді. 3. Егер әр сатыда еркін энергияның өзгерісі шамамен бірдей және жалпы процестің жылулық эффект өзгерісінің жартысына тең болса, көпсатылы каталитикалық процесс термодинамикалық жағынан тиімді (шынайы) болып табылады. 4. Егер аралық химиялық әрекеттің нәтижесінде катализатор химиялық реакцияның активтену энергиясын төмендетсе (немесе біруақытта Аррениустың предэкспоненциалды көбейткішін жоғарылатса), каталитикалық реакция кинетикалық жағынан жоғары жылдамдықпен жүреді. Бұл ереже катализдегі бұзылатын байлныстың компенсациялық эффектке сәйкес келеді. Ол А.А: Баландиннің мультиплетті теориясындағы энергетикалық сәйкестілік принципіне сай. 5. Қатты заттың кристалдық құрылым типі мен каталитикалық әсердің ерекшелігінің арасында белгілі бір заңдылықтар қалыптасқан. Ионды және электронды, сонымен қатар аралық кристалл түрдің (ионды-металдық) каталитикалық активтілігін ионды және металдық кристалл құрылымына сәйкес келетін қатты зат көрсетеді. Катализ қатысында молекулалы және ковалентті кристалдар іс жүзінде инертті. Катализдің практикалық мағынасы негізгі мақсаты – берілген реакция үшін катализаторды саналы таңдау мүмкіндігі болып табылатын теорияны қалыптастыру. Қазірге дейін ондай теория қалыптаспады, алайда түрлі бағыттағы ғылыми мектептердің теориялық тәсілдері бар. 4.1 А.А. Баландиннің мультиплеттік теориясы 1927 ж. А.А.Баландин нафтендердің және гетероатомды циклды қосылыстардың каталитикалық гидрлеу реакциясы мысалында катализатор әсерінің ерекшелігін ойлап тапты. 2500С температурада платиналы қатардағы катализаторлар қатысында циклогексанның бензолға дейін дегидрленуі жүреді:
1,1-диметилциклогексан ұқсас катализаторлар қатысында дегидрленбейді, ал гидроинданың әсерінде алтымүшелі сақинаға дейін жүреді:
Полиметиленді циклдердің дегидрленуі көмірсутектердің алкилтуындыларының түзілуімен (Н.Д.Зелинский, М.Б.Турова):
циклогептан метилциклогексан Гетероциклдер ұқсас ктлизаторлар қатысында бесмүшелі және алтымүшелі сақина түзе дегидрленеді (Н.Д.Зелинский, Ю.К.Юрьев):
пирролидин пиррол
А.А. Баландинге каталитикалық әсердің орныққан арнайы заңдылықтары катализатор мен реагирлеуші заттың бөліну шекарасындағы аралық әсерді шарттайтын механизмнің себебін табуға итермеледі. 1929ж. А.А. Баландин қалаған мультиплтті теорияның негізгі анықтамасы сипатталды: 1. Адсорбционды және каталитикалық активті орталықтардың бірдей еместігі; 2. Катализ байланыстардың қайта бөлінуіне және хемосорбцияның ерекше түріне негізделген физикалық және химиялық қарапайым процестерде комплекс түрінде болады. Молекулалар байланысьардың қайта бөлінуіне және әлсіретуне әкелетін бірнеше адсорбциялық орталықтарға адсорбцияланады; 3. Молекуладағы реагирлеуші заттар катализатордың атомаралық қашықтығымен сәйкес келетін атомдардың бір-біріне жақын орналасқан ерекше топтары – «индексті топ» бойынша бөлінеді; 4. Катлизатордың активті орталықтары – екі немесе одан көп атомдардан тұратын «мультиплет» деп аталатын атомдар тобы (дублет, триплет, квадруплет, секстет). Мультиплеттің активтілігі катализатордың дұрыс кристалдық құрылымын көресететін қырлары, қабырғалары, бұрыштары, дөңестері және басқа да бөлімшелердің ерекшеліктерімен шартталған. Гетерогенді каталитикалық процестер үшін қатты кристалдық катализатордың торына реагирлеуші заттың адсорбцияланған молекуласын бағдарлы салу арқылы дублетте, триплетте, квадруплетте және секстетте әсер етуі жиі жүзеге асады. А.А. Баландиннің мультиплетті теориясы маңызды екі принципке негізделген: 1. Құрылымдылық (геометриялық) сәйкестілік принципі; 2. Энергетикалық сәйкестілік принципі. Құрылымдылық (геометриялық) сәйкестілік принципі катализатордың оңтайлы кристалдық құрылымының орындалуын қажеттілігіне негізделген. Процесс реагирлеуші молекуланың атомаралық қашықтық конфигурациясына сәйкес анықталатын катализатор торының параметрлері және берілген реакцияның кристалдық құрылымы болған кезде максималды жылдамдыққа жетеді. Триплеттегі Pt катализаторы қатысында диэтил эфирінің дегидратациялану реакциясы:
Квадруплетте ацетосірке эфирінің кататаликалық ыдырауы:
Дублеттегі этил спиртінің дегидрлеу және дегидратациялау реакциялары:
Секстетте циклогексанның дегидрлену реакциясы:
Мультиплеттік теория катализатордың активті орталықтарына атомдардың бөлінуі және реалды өлшемдер есебінен реагирлеуші заттардың салыну әдістерін қарастырады. Бұл жағдайда мүмкіндігінше аралық активті комплекстегі катализатордың активті орталықтарымен индексті топ атомдарын түзуші валентті бұрыштың тұрақтылығын қадағалап отыру қажет. А.А. Баландин ұсынған мультиплет комплексінің түзілу механизмі және реакция бойынша дублетті әсерлесудің мысалында катализатор әрекетінің талғамдылық теориясы сипатталды:
Kt А С Аæ . . . öС А ¾ С | + | Û [ | | ] Û + 2 Kt , В Д В . . . Д В ¾ Д è ø Kt
А,В,С,Д атомдарында орынбасушылар; А¾В және С¾Д байланыстары жай, қос және үш байланыс бойынша және атомдар әр түрлі молекулаға тиесілі болуы мүмкін. А,В,С,Д атомдары С,Н,N,O,Cl атомдарына алмасқан кезде және байланыстың әр түрлі тіркестері үшін екі мыңға жуық каталитикалық процестерге, соның ішінде ферментативті реакциялар үшін де классификация құрылған. Бұл классификация жаңа реакцияларды болжауға және ашуға үлген септігін тигізді. Құрылымдық (геометриялық) сәйкестілік принципі мультиплеттегі катализатордың активті орталықтарын және реагирлеуші заттағы атомдар арасындағы индексті топты түзетін валентті бұрыш тұрақтылығын орындалуын талап етеді. Органикалық заттың молекуласындағы валентті бұрыштың ауытқуын болдыратын кез келген қосымша кернеу шайырлы сынықтардың түзілуіндегі байланыстың қопсытылуын емес, бұзылуына әкелуі мүмкін. Этиленнің каталитикалық гидрленуінің мысалында валентті бұрыш 1090 тең екенін көруге болады:
Егер валентті бұрыш - q (1090), катализатордың активті орталығы мен көміртектің арасындағы байланыс - в (1,82 А0), этилендегі С – С қопсытушы байланыс – с(1,54 А0) шамалары белгілі болса, онда мына формулаға сәйкес катализатордағы дублеттің атомаралық арақашықтықты а есептеуге болады:
Бұдан көрінгендей, қарастырылып отырған реакцияға кристалдық тордың 2,74-2,77 А0 параметрлеріне сәйкес келетін Pt және Pd негіздегі катализаторлары сияқты атомаралық арақашықтық 2,74 А0 болатын катализаторлар тиімді болып табылады. Тәжірибе көрсеткендей, берілген процеске кристалдық тор параметрі 2,69 А0 болатын Rh катализаторы оңтайлы болып есептеледі. Сонымен, тор параметлерін біле отырып валентті бұрыш ауытқуын есептеуге болады. Циклоалкандардың дегидрлену реакциясының катализаторлары: Pt-2,77 А0, Ni-2,48 А0, Ir-2,70 А0, Rh-2,69 А0 , Cu- 2,56 А0, - бұларға атомдардың үшбұрыштық орналасуымен болатын (октаэдрлер және базопинакоидтер түріндегі қырлар) қырлы орталықты және гексагональды кристалдық торлар сәйкес келеді.
Катализдегі энергетикалық сәйкестілік принципі. Катализатормен байланысты энергияны анықтау тәсілдері Берілген реакция үшін катализатор мен реагирлеуші заттың байланыс энергиялары қатаң түрде анықталған максималды жылдамдығы бар каталитикалық реакция жүрсе энергетикалық сәйкестілік қосылады. Катализатор бетіндегі және реакционды фаза көлеміндегі өзгеруші молекуладағы атом аралық байланыс энергиясы әр түрлі болады. Мультиплетті комплекстің түзілу (Е*) және ыдырау (Е**) энергиялары келесі теңде бойынша бейнелеуге болады:
Е*= - QАВ – QСД + (QАKt + QВKt +QСKt +QДKt) (1) Е** = QАС + QВД - (QАKt + QВKt +QСKt +QДKt) (2)
Бұл теңдеуде нақты сипаттама береді, яғни адсорбция кезінде байланыстар ажыратылмайды, тек қопсытылып көтеріледі. Нақты дәл қатынас Е* және Е** үшін Баландин А.А. көлемді енгізеді S – активация энергиясын тәжірбие жүзінде анықтау, яғни ол Е теңдеуімен байланысты: S= -3/4 Е
Сондықтанда, максимальды жылдамдықта каталитикалық реакцияның ағуы үшін, түзілу жылдамдығы және мультиплетті комплекстің бұзылуы мынадай шамада Е*=Е** тең болуы керек. Сондай-ақ, келесідей белгілер енгізіледі:
U = - QАВ – QСД + QАKt + QВKt +QСKt +QДKt,
Мұндағы U– реакцияның жылу эффектісі;
S = QАВ + QСД + QАС + QВД,
Мұндағы S – түзілетін және көтерілетін байланыстардың барлық энергияның қосындысы;
g = QАKt + QВKt +QСKt +QДKt,
мұнда g – катализатордың адсорбционды потенциалы.
Бұл өлшемдердің орналастыру жолы 1және 2 теңдеуде келесі белгілерді аламыз: Е* = - QАВ – QСД + g; Е**= QАС + QВД – g
Мына жерден: Е = U / 2; (3);
g = S / 2(4)
Сәйкесінше, 3 және 4 теңдеулері энергетикалық сәйкестікте принципі болып табылады:
Эндотермиялық реакцияның оптимальды катализаторын таңдау үшін, оның адсорбционды потенциялы әсер етуші байланыстардың (түзілуші және көтерілетін) энергияның жарты қосындысына сәйкес келуі керек;
Ең активті катализатордың энергетикалық барьерінің (энергия активациясы) көлемі реакцияның жартылай жылулық эффектісіне тең болуы керек. Бұл анықтамалар катализаторды таңдау принципінің негізі болып табылады. Сондай – ақ, U және S тек әсер етуші заттардың табиғатына тәуелді, яғни катализатордың табиғатына емес, сонымен қатар Q және g өлшемдері де әсер етуші заттардың табиғатына байланысты. Ал g өлшемі тек оптимальді болып табылатын катализатор бетінің орнын ғана сипаттайды. Сондай – ақ, катализатор бірлігі бетінің оптимальді орындары көп болса, мұндағы g = S / 2 Соғұрлым эффекті болып табылады.
Энергияның катализатормен байланысының әртүрлі әдістері бар: термиялық, компоративті, кинетикалық, адсорбционды теңөлшегіш әдіс.
Көбінесе жиі қолданылатыны кинетикалық әдіс және кинетикалық әдіс варианты.
Өзін-өзі бақылау сұрақтары: 1. А.А. Баландиннің мультиплетті теориясының негізгі жағдайлары қандай? 2. Катализде құрылымдық сәйкестік принципі немен бекітіледі? 3. Оптимальді катализаторды таңдау принципі неге байланысты? 4. Катализде энергетикалық сәйкестік деген нені білдіреді? 5. Жылу түзілудің және мультиплетті комплекстің реттелуідің термохимиялық түрде жазу. 6. Жылулық эффектісінің және катализатордың адсорбционды потенциалының оптималды белгілері қандай? 7. Тұрақты валентті бұрыш принципінің катализдегі құрылымдық сәйкестік принципін сипатта. 8. Баландиннің А.А мультиплетті теориясына негізгі анықтамалар беріңдер.
4.2 Н.И. Кобозевтің активті ансамбльдер теориясы және аггравация эффектісі
Теорияның негізгі жағдайлары: Активті тасымалдаушылар болып катализатордың кристалдануға дейінгі фазасы болып табылады (иондар немесе металл атомы), кристалдық фазаға жағылған – инертті тасымалдаушы немесе қабықша. Инертті қабықша ретінде алюминий оксиді немесе кремни және т.б жүреді. Катализатор бетіндегі активті орталықтар активті ансамбльдерде біріккен, яғни олар 1,2 және 3 атомдардан (иондардан), тұрады, катализатор бетіндегі Ван-дер-Ваальс күштерінің өзара әсерлесуі арқылы байланысқан. Органикалық молекуланың адсорбциясы айналмалы активті байланыстардың түзілуі арқылы шығарылады, сондай – ақ катализдің мультиплетті теориясында да.
Активті фаза атомды дисперционды жағу әдісі бойынша формаланады, немесе тұз ерітіндімен жағады. Мұндай катализаторларды адсорбционды деп атайды. Н.И. Кобозев адсорбционды катализатордың бетті толтырудағы дәрежесінің тәуелділігінің каталитикалық активтілігін оқытады:
a = жағылған металдың жалпы саны , көп қабатты тасымалдаушы метал саны
мұндағы a - бетті толтыру дәрежесі.
ауд. = А жалпы. / a,
мұндағы А жалпы.- жалпы активтілік; аменш.- меншікті активтілік. Н.И.Кобозев реакция қатарынан жалпы және меншікті активтілік максимум арқылы өтетінін көрсеткен, яғни металл көлемінің үлкеюі, олар өсуі қажет. Бұл автордың пікірінше осылай жасалған, яғни катализатор беті энергетикалық жағынан біртекті емес және мозайка құрылымдыға ие. Бұл миграция аймақтары бір бірінен геометриялық және энергетикалық барьерлармен бөлінген, жеке яғни, кристаллитикалық құрылымды тасымалдыаушылармен қамтамасыз етілген, яғни кристаллитикалық торлардың дефектісімен, стехиометриялық тасымалдаушылардың құрамының бұзылуымен бөлінген. Тасымалдаушылар бетінде жабық бетті құрылымдар миграция аймағында пайда болады. Активті ансамбльдер миграция аймағының тек бір шегінде түзілуі мүмкін және сонымен қатар, олар өзара әсерлеспейді және бір біріне тәуелді емес. Миграция аймағына активті атомның бұрын түскен жеріне қайтадан түсуі кездейсоқ болып табылады. Каталитикалық активті тасымалдаушылар үлкен емес атом сандарынан құралған (1-2-3-х) ансамбльдер болып табылады. Әр түрлі реакциялар үшін айналулар тәуелділіктеріне байланысты және процесс механизміне активтілік әртүрлі ансамбльдер әсер етеді. Сонымен қатар, сутегі пероксидінің бөліну реакциясында және активті бір атомды ансамбльдің тотығуы, гидрлеу және дегидрлеу реакцияларында екі атомды ансамбльдер, аммиак синтезі реакциясында үш атомды ансамбльдер болып келеді.
Катализатор тасымалдаушыда максималды меншікті активтілікке қол жеткізеді, ал заң бойынша оның бетінде көп мөлшерде керекті құрылым түзіледі. Екі типті тәуелділік бар аменш. и А жалпы от a: 1. Бір максимумды қисықта А жалпыот a (кіші енгізулерде); 2. Максимумды қисықта аменш.от a и А жалпы от a ( 10-3-10-2). Н.И.Кобозев атомдар санының ансамбльде сандық есебін, миграция аймағының көлемі, жалғыз ансамбльдің активтілігін ұсынды. Ферментативті катализде фермент екі бөліктен агон (протогон) және феррон (ақуызды молекула) құралған, ионды – органикалық комплекс ретінде қарастырылады. Агон әртүрлі функционалды группалар және металл иондары және селективтілік қасиетіне жауап беретін қасиетке ие. Ал феррон катализатордың активтілігіне жауап береді. Аггравация эффектісі – фермент молекуласындағы ақуыз бөлігінің ауырлауы, катализдеу процесі кезінде оның активтілігінің өсуіне әкеледі. Аггравация эффектісінің физикалық мәні, күрделі органикалық молекулалар спецификалық емес қасиетті ұстап немесе энергияны жаулап, басқа әдіспен немесе осы жолмен алынған, сосын оны активті орталыққа беру болып табылады. Мұндай активация механизмі энергетикалық деп аталады. Ал агграватор энергетикалық ловушка ретінде қызмет атқарады. Ферментативті катализден айырмашылығы активация механизмі гетерогенді катализде валентті деп аталады, активтеу қаншалықты электрондардың ауысуымен хемосорбция жүзінде жүреді. Өзін-өзі бақылау сұрақтары:
1. Н.И. Кобозевтің активті ансамбльдер теориясы негізгі жағдайлары қандай? 2. Катализатордың кристалды және аморфты фазаларының активтілігіне анықтама беріңдер? 3. Адсорбционды және кристалды катализаторларды Н.И.Кобозев теориясына қойып көріңдер? 4. Валентті (электронды) және энергетикалық механизмі активациясын катализде түсіндіріңдер. 5. Активті орталықтардың қатты катализаторларда мультиплет және активті ансамбльдер негізінде салыстырмалы анализ жүргізіңдер. 6. Аггравационды эффектінің катализдегі рөлі қандай? 7. Катализатордың жалпы және меншікті активтілігі активті ансамбльдер концентрациясынан (ажырау дәрежесі) тәуелділігі қандай?
4.3 С.З.Рогинскидің активті бет теориясы. Катализатордың промоторлануы және улануы. Катализаторды модификациялау.
С.З.Рогинскидің теориясының негізінде катализатордың бідей емес бетінде физикалық және химиялық факторлар жатқанымен белгілі. Бұл катализатор құрылысының деформациясы, сонымен қатар химиялық құрамы бойынша біртекті еместігі, қоспаның жеке жағдайы, промоторлаушы қоспалар, араласқан катализаторларды қолдану және т.б. Физикалық біртекті еместігі катализ жағдайына тұрақсыздығы, ол қайтымды және уақыт бойынша температура тәуелділіктеріне байланысты өзгеруі де мүмкін. Химиялық біртексіздігі температура әсеріне тұрақты. Таза (бір компонентті) және араласқан (көп компонентті) катализаторларда, араласқан көбінше эффективті екенін көрсетті. Бұл жеке катализаторда қатты фазаның араласқан типте әр түрлі химиялық құрамы жағынан жағдайланған. Катализатор өзінің химиялық құрамы бойынша біртексіз және қоспаның бөліну шекарасында фаза оның активті өсуіне әкеліп соқтырады.
С.З.Рогинскидің активті бет теориясының негізгі жағдайлары: 1.Катализаторды синтездеу процесінде әр түрлі технологиялық қоспалар оны активтеуі мүмкін. Активтеу эффектісі әртүрлі қоспалармен катализаторды жасанды промоторлау немесе промоторлармен бірдей болады. 2. Сонымен қатар, активтілер тек беттің белгілі бір аймақтарында ғана болады, яғни қоспа құрамы оптимальдымен сәйкес болатын жерінде ғана болады. Қоспаның әсер етуінің әлсіреуі катализатордың активтелуіне әкеп соқтырады. 3. Промоторлаушы және улаушы қоспалар көздері болып каталитикалық реакцияның өзі болуы да мүмкін. Жағдайдың дәлелі ретінде металдарды газды промоторлау, реакция катализаторы ретінде этиленді гидрлеуді қолданылады. Таза пластина металдары Ni, Cu, Fe, Pt, Pd, W негізгі реакцияға активсіз болып шықты. Бірақ сол пластиналы металдар дозаланған мөлшердегі газ қоспасының қатысында (N2, O2, H2 және т.б.) активті болып шықты. Газды промоторлау әдісі бойынша әртүрлі жалпақтықта бір компонентті катализаторда реакцияның жылдамдығын эффектілер айтарлықтай көтереді. С.З.Рогинский этиленді гидрлеу реакциясында басқа бір компонентті катализаторлардың активтілігін қоспаларды жабық промоторлау, яғни катализаторды дайындау процесі кезінде немесе оның келесі өңделуінде пайда болуы мүмкін екенін түсіндіреді. Осы жерде, абсолютті таза катализатор болуы мүмкін емес, ең таза реактивтердің өзінде де қоспалар қатысады, яғни олардың таралуы катализаторды дайындауда және қайта қалпына келтіру процесі кезінде болуы мүмкін. Сондықтанда, активті бет теориясын активті орталықтар арқылы аумақ бетін түсіндіреді, яғни басқаларынан химиялық құрамы бойынша ерекшеленеді немесе аумақ ерекше құрамның көлемді шекарасына қабыса жүретіні белгілі. Осы жерде белгілі контактілердің улардың (яд) өзі де P, Sn, Pb, As, Sb және т.б үлкен емес концентрацияның өзінде каталитикалық процесті активтеуі мүмкін.
Біртекті беттің шектеу(блокировка) арқылы улануы Егер катализатордың біртекті бетінің әсер етуші шекарасында немесе кинетикалық аймақта улануы жүретін болса, онда бұл құбылысты катализатор бетінің абсолютті көлемінің ұлғаюы немесе катализатор мөлшері арқылы салыстыруға болады. Осымен қоса факторлар қатары процесті сипаттаушылар өзгермейді: 1.процесс механизмі, параллельді жылдамдық қатынасында және келесі сатылардағы қосылған каталитикалық процестер, реакция өнімінің құрамы; 2. Процестің негізгі кинетикалық сипаттамалары; 3. Активтелу энергиясы улардың қатысында және катализатор бетіның улар арқылы үздіксіз толтырылуы сәйкес келуі керек. Улану кезінде катализатордың жалпы активтілігі (А) және реакция жылдамдығының константасы (k) өзгереді. А = А0 (1- a*С), Мұнда, А – жалпы активтілік, А0- уланған катализатордың активтілігі, С – удың концентрациясы, a - улану коэффициенті (бет, умен улану).
Біртексіз беттердің шектеу (блокировка) арқылы улануы. Біртексіз беттер үшін катализатор бетінде улардың араласу сипатына байланысты өзара тәуелділік пайда болады.Активті аймақтардың орналасу функцияларының активтелу энергиясынан r(Е) дан Е тәуелділігін 3жағдайда шектелуін (блокировка) қарастырамыз: 1. У Е бетінен тәуелсіз бет аумағына орналасады; 2. Улану кезінде микроскопиялық шектеу көбінесе активті аймақтарда басталады, сол кезде реакция сияқты Еmin аумағында жүзеге асады; 3. Егер, шектеу катализатор бетінің көбінесе активті аумақтарында басталатын болса, онда удың бірінші бөлігі қатты әсер етеді және активтелу энергиясы балқымалы түрде өзгереді.
Шешімдер: 1. Біртексіз беттердің улануы кезінде активтену энергиясы тез өзгереді және удың бетке орналасу сипатына байланысты; 2. Катализатордың активтілігінің өзгеруі жұтылған удың мөлшерінің экспоненциалды болуынан және басқа функция түрлерінен болады.
Компенсациялық эффект. С.З.Рогинскидің қанығу теориясы. С.З. Рогинскидің активті бет теориясынан сол бір қоспалар белгілі бір анықталған белгілерде немесе промотор немесе у ретінде басты роль болып келеді. Процесс кезінде активтілікке қоспалар қатысында көмірсутектердің тотығуы реакциясында температураның әсерін зерттеу, жылдамдықтың қисық тәуелділігі қоспа концентрациясынан максимум арқылы өтеді. Сонымен қатар, активтелу энергиясынан жылдамдықтың қисық тәуелділігі осы процес үшін сол алдыңғы қоспа концентрациясымен максимум арқылы өтеді. Бұл факт әдеттегі болжауларға қарама қайшы болғанымен, көбінесе активті катализатор жоғары активтену энергиясына ие. Сондықтанда, ең жоғары Еа жоғары жылдамдыққа және k0 сәйкес келеді. Бұл заңдылық компенсациялық эффект деп аталады. Активтелу энергиясының өзгеруі және k0 қоспалардың қатысында симбатты және катализатордың меншікті бетінің өзгеруінсіз жүреді. Аррениус теңдеуімен сипатталады: k=k0*е–Еа/RT, мұндағы k0- активті екпіндер санын сипаттайтын предэкспоненциалды көбейткіш. Сонымен қатар, Еа -ның ұлғаюы е –Еа/RT кішіреюіне әкеледі.
Негізгі сипаттамаларына Еа және k0 симбаттылығы әр түрлі әсерлерге қоспаларды егізгенде температураның өзгеруі болып табылады. Бір және сол катализатор температураның әсерінен промоторланған немесе уланған болады. Сондықтанда С.З.Рогинскиге улау және промоторлау процесіне басқа терминалогия ұсынды. Промоторлау – бұл катализатор бетінде активті орталықтар санының ұлғаюы, k0 өсуіне немесе көбінесе аз Еа жаңа активті орталықтар пайда болуын тудырады. Улану – бұл катализатор активтілігінің азаюы у бетінің қатысында бөліктің шектелуі. Бұл процеске Еа тұрақты жағдайында k0 азаюы не болмаса Еа ұзындығы бойынша аз шамада өзгеруі сәйкес келеді. Модифицирлеу - бұл Еа және k0 қоспаның төмен түсуі немесе процестің активтелу энергиясын көтеруінен тәуелді болама соған байланысты бірлесе өзгереді. Модифицирлеу бұл жалпы түсінік болып табылады, яғни өзіне жеке жағдай ретінде промоторлау және улауды қосқанда. Реакция жылдамдығы қаншалықты экспоненциалды Еа көлемімен байланыста болса, онда оның көп емес қатынаста өзгеруі процесс жылдамдығына айтарлықтай әсер етуі керек. Бірақ, мұндай өзгерулер болмаған жағдайда көптеген мысалдардың бар екені белгілі. Былай болжауға болады, мұндай сәйкессіздік жағдайлар біруақытты өзгеріске k0 жағдайланған, яғни экспоненттің тез өзгеруіне компенсациялайды. Бұл құбылыс және компенсациялық эффектіні айқындайды. Аса қанығу теориясы тасымалдаушы ретіндеактивті беттердің негізгі қасиеттерін термодинамикалық тұрақсыз жағдайын айқындайды, және қалған бос энергияға ие (пики, ямы, ансамбльдер, тордың әлсіз аумақтары және т.б). Артық қалған бос энергия беттің қанығуы үшін қызмет атқарады – бос энергияның өзгеруі берілген жүйеде тұрақты тең өлшемді жағдайы осы жағдайда өтуі. Катализатор бетінің қанығу көлемі оның дайындау әдісіне, түзілу жылдамдығына және т.б жағдайларға тәуелді. Қанығудың бірнеше типі бар: 1) дисперционды, үлкен меншікті беттің туындауына байланысты; 2) фазалы, тұрақсыз фазаларды алуға жағдайланған және фазалар өтуінің аяқталмағандығы; 3) химиялық, ерекше химиялық құраммен алынған тел пайда болуы, қоспаны жаулап алуға негізделген. Сонымен қатар химиялық құрамда аномалидің түзілуі катализаторды көбіне қанығу қамтамасыз етеді және алынған жағдайдан тұрақтылықпен қамтамасыз етіледі. Катализаторды дайындау жағдайын өзгертсеқанығу көлемін пісіруге болады.
Өзін-өзі бақылау сұрақтары: 1. С.З.Рогинскидің аса қанығу теориясы катализатор активтілігінің қанығудан тәуелділігі. 2. С.З.Рогинскидің теориясы металдарды газды промоторлау. Қоспа әсерінің екі сипаттамасы, катализаторға енгізгенде оның активтілігіне әсері. 3. Компенсациялы эффект (улау, промоторлау, катализаторды модификациялау).
Тарау 5. МҰНАЙДЫ ӨҢДЕУДЕ ГИДРОГЕНИЗАЦИЯЛЫҚ ПРОЦЕСТЕР. ГИДРОКРЕКИНГ ЖӘНЕ ГИДРОТАЗАЛАУ
Мұнай өңдеу процесі кезінде гидрогенизационды өндірістік жеке дамуы экологиялық талаптарға, оның ішінде тауарлы мұнай өнімдерін өндіретін, өз кезегінде күкіртті және жоғары күкіртті мұнайлардың өсуіне байланысты. Гидрогенизациялық процестерді мұнай өңдеуде қолдану әр түрлі құрылымда болып келеді. Мотор жанармайын гидротазалауға толықтай тексереді яғни оның құрамындағы гетероорганикалық қосылыстарды күкіртті, азотты, оттегіні, мышьякті, галогендерді металдар және алкендердің гидрленуі және оның эксплутационды сипаттамасына жақсаруына итермелейді. Гидротазалау жанармайдың коррозиялық агрессивтілігін азайтады және оның қабатында қалдықтардың түзілуіне, токсинді газ қалдықтарын қоршаған ортада мөлшерін азайтады. Бензин фракиясының терең гидротазалау үшін көмірсутекті емес қосылыстардан уланудан платиналы катализатордан қорғау риформинг процесінде жүргізіледі. Вакуумды газойльді гидротазалау нәтижесінде, каталитикалық крекингтің негізгі шикізаты болып табылатын шығыс көтеріледі және крекингтің өнімі негізінде және атмосфераның күкірт тотығымен ластануы айтарлықтай қысқартылады. Мұнай өңдеудегі гидрогенизациялық процестерде көбінесе гидрокрекинг және гидротазалау алады. Гидрокрекинг – бұл каталитикалық процесс жоғары температура мен қысымда, мұнай шикізатын сутегі қатысында деструктивті өңдеу. Ол шикізаттың терең және түзілген көмірсутектерді гидрлеу болып табылады. Шикізатты гидрокрекингтеуде әдетте ауыр мұнай дистилляттары болып табылады (tкип 350 – 5000С) және қалдық фракциялар жарты мазут, мазут, гудрон. Дистиллятты өнімдерді гидрокрекингтеу Р=7-20 МПа қысымда Т=300-4250С температурада және шикізатты көлемді жылдамдықта беру 0,3-1 ч-1 арқылы жүргізіледі. Гидрокрекинг кезінде қалдық өнімдердің қысымы 17,5 - 30,0 МПа жетеді, ал температураның төменгі шегі 3750С болады. Су құрамды газ 500-2000 м3/м3 мөлшерде шикізатта беріледі. Гидрокрекинг процесінде катализаторлар бір уақытта қысатын (расщепляющими) қасиетке изомерленетін және гидрлеуші қасиетке ие болуы керек. Гидрокрекинг шикізаттың қасиетіне байланысты және процесті тағайындау екі немесе бір сатыда жүзеге асады. Гидрогенизацияда катализатор ретінде бірінші сатыда оксидтерді немесе никель сульфидін, кобальтті, молибденді және вольфрамды алюмини оксидінде активтеу үшін алюмосиликат немесе цеолитте қолданады. Гидрогенизацияның екінші сатысы ретінде паладий немесе платинаны қолданады, цеолит түрінде жағылған. Гидрокрекингтеуде шикізаттың ауыр түріне осы екі сатыны да қолданады. Бірінші сатыға кейбір шикізаттың молекулалық массасының азаюы, оның сутекпен қанығуы және толықтай немесе жилікте күкіртті –оттегі және азот құрамды күкіртсутекті қосылыс ретінде сулар және аммиак көбінесе жоғааалып кетеді. Екінші сатыға шикізатты дайындау терең крекингтеуде сутектің қысымында стационарлы катализаторларда қолданады. Гидрокрекинг кезінде толығымен келесідей айналулар жүзеге асады:
1) Жоғары молекулалы қосылыстардың құлауы, қанықпаған өнімдердің гидрлеуде құлауы; 2) Циклді көмірсутектерді деалкилдеу; 3) Алкандардың және циклоалкандардың изомеризациясы; 4) Ароматты сақиналардың гидрленуі; 5) Күкіртті, оттекті және азотты қосылыстардың гидрленуі.
CnH2n+2 + H2 → CmH2m+2 + Cn-mH2(n-m)+2 Шикізаттың айналуы гидрокрекинг процесі жағдайында келесі бағытта жүреді: 1) Гидрогенализге бірінші кезекте көмірсутекті емес қосылыстар пайда болады, шикізатта гетероатомдар Н2О, NH3 и H2S түрінде жоғалып кетеді. Қанықпаған көмірсутектердің гидрленуі бір мезетте жүреді. 2) Арендердің гидрленуі алкендерге қарағанда қиындау. Гидрокрекинг процесі кезінде жанама тізбектердің үзілуі және полициклді арендердің гидрленуі, өте қарапайым арендердің түзілуіне әкеліп соқтыратын, сонымен қатар циклоалкандар және алкандар болады. Ароматты сақиналардың конденцасиялануы және кокстың түзілуі бақылауға алынбайды. 3) Полициклді циклоалкандар араласқан моноциклде гидрленеді. 4) Алкандар изомеризацияға және әсер етуге тексеріледі. Гидрокрекингті тексерудің оптималды температурасы әдетте 300-4250С. Өте төмен ремпературада реакция аз жылдамдықта ағады. Гидрлеу реакциясында температураны аралықты көтеру термодинамикалық факторлармен шектеледі, кокс түзілу жылдамдығы жоғарылайды, жеңіл фракция мен газдың шығуы жүреді. Ауыр газойлдар үшін оның үстіне қалған шикізаттың мақсатты түрде полициклді жүйеде айналуы, сақиналы циклоалкандардың қайтымды реакцияда дегидрленуі жоғары қысымды қажет етеді. Сутектің реакцияда шығымы процестің тағайындалуына байланысты, қолданылған шикізатқа, катализаторға, процесс режимі мен басқа да факторларға байланысты. Гидрокрекиг өнімі көп жағдайда каталитикалық крекинг өнімімен ұқсас болып келеді. Олар аз мөлшерде метаннан және этаннан; изобутанмен байытылған С4 фракциясынан, сұйық өнімде көп мөлшерде көмірсутектерден тұрады. Гидрокрекинг өнімінің каталитикалық крекинг өнімінен айырмашылығы оның қаныққан сипатқа иелігінде. С3 – С4 фракциялары пропанмен және изобутанмен сәйкестендірілген. Бензин сол сияқты алкендерден тұрмайды. Гидрокрекинг газойлы сонымен қоса, каталитикалық газойлге қарағанда аз ароматталған. Гидрокрекин процесі кезінде мұнай фракцияларын бір уақытта күкіртті және басқа да гетероатомдардан тазарту жүреді. Сондықтанда, гидрокрекинг өзіне каталитикалық крекингті гидрлеу және гидротазалау деп есептейді. Мұнай өңдеу схемасына гидрокрекингті қосу кәсіпорын эксплуатациясын қысқартуын қамтамасыз етеді. Процестің технологиялық режимін өзгерту және сұйық өнімдерді ректификациялау жағдайын сол бір қондырғыда қалаған өнімді алуға болады: яғни бензин, реактивті немесе дизель жанармайын алуға болады. Гидрокрекингтің болашақтағы бағытты өнімі майлы фракциялар болып табылады. Майды терең гидрлеу тұтқырлық индексін 36 до 85-110 жоғарылатады, күкірттің құрамын 2% до 0,04-0,1% дейін азайтады, яғни кокстеу жағдайына реттілігін азайтады. Гидрокрекингті басқа мұнай фракцияларын өңдеу процестермен салыстырғандағы негізгі иеліктері келесідей: 1) Процестің қысқалығы яғни, бір шикізаттан әр түрлі мақсатты өнім алу мүмкіндігі, сонымен қатар шикізаттың ең әр түрінен – ауыр бензиннен мұнай қалдықтарына дейін өңдеу мүмкіндігі; 2) Ашық өнімдердің үлкен шығымы; мысалға реактивті жанармайдың шығымын 2-3% - дан 15% дейін жоғарлатуға болады, ал қысқы дизель жанармайының шығымы 10-15%- дан 100% дейін; 3) Алынған өнімнің сапасының жоғарылығы.
Гидротазалау – жеңіл және ауыр мұнай шикізатын тазалауға және ары қарай өңдеуге дайындауға бағытталған каталитикалық процесс. Бұл заттардың химиялық айналуы сутектің әсерінің қатысында жоғары қысым мен температурада катализатор қатысында жүретін кең таралған процесс. Ол тауарлы мұнай өнімдеріндегі күкіртті қосылыстардың құрамын азайтуға бағытталған. Жанама реакциялар негізінде шексіз көмірсутектердің қанығуы, шайыр құрамының төмендеуі, оттек құрамды қосылыстар, сонымен қатар көмірсутек молекулаларының гидрокрекингі жүреді. Гидротазалау процесінде шикізат негізінде мұнай фракцияд ларын қолданады (тура айдалған бензин және каталитикалық крекинг; керосин; дизель жанармайы; вакуумды газойль; майлы және мұнай қалдықтары.)
Тура айдалған бензинді гидротазалау риформинг үшін гидротазаланған бензин фракцияларын шикізат негізінде алу үшін бағытталған. Процесс гидрогенолиз реакциясында және сутек молекуласының жиі декструкциялануы, нәтижесінде күкірттің органикалық қосылыстарың, азот, оттек, хлор, металдар, шикізатта түзілетіндігіне, күкіртсутекте айналуына, аммиакка, суға, хлорсутекттер мен көмірсутектердің сәйкес келуіне негізделген. Процесс 2,5-8,0 МПа қысымда, 250-450оС температурада, шикізатты беру жылдамдығы 0,5-10 сағ-1 және циркуляциялаушы су құрамды газ 360-600 м3/м3 алюмокобальтмолибденді катализатор қатысында жүргізіледі. Керосинді фракцияны гидротазалау күкірттің құрамын азайтуға және ұшқыш аппараттардағы жанармай аппаратурасын коррозияға ұшырауына себепкер болатын реактивті жанармайдағы шайырды және қозғалтқыш форсункасын кокстаушыға бағытталған. Процесс 1-3 Мпа қысымда, 370-380 °C температурада, газдағы сутектің құрамы - 75 %, сутектің қысқа циркуляциялануы 80-200 м³/м³, алюмокобальтмолибденді катализатор қатысында жүргізіледі. Мұнай фракцияларын өндірісте гидротазалау 320 – 4200С температурада мен 2,5 - 5 МПа қысымда, алюмокобальтмолибденді (АКМ) немесе алюмоникельмолибденді (АНМ) катализатор қатысында жүргізеді. Бұл катализаторлар 10 - 19 % МоО3 және 2 - 5 % промоторлардан ( СоО или NiO), активтеуге жағылған Цеолиттер жоғары оттектілігінің есебінен ең жоғары активті крекингілеуімен және сыртқы беттік катализатор тасымалдаушыыларымен ерекшеленеді. Бұл қасиет шикізатты өндіруде тек жоғары меншіктілікті ғана қамтамасыз етпейді (кіші көлемді реакторлар), сонымен қоса шикізатта жеке бірнеше азотты қосылыстардың қатысында катализатордың жұмысын да қамтамасыз етеді. Алюмокобальтмолибденді катализаторларды мұнай фракцияларын гидротазалау процесі үшін қолданады, сондықтанда олардың активтілігі күкіртсіздендіруші қасиетімен бағалану арқылы қабылданған. Мұнай фракцияларын күкіртті қосылыстардан гидротазалау процесі әр түрлі температура мен қысым интервалында жүргізілсе, парфинді және көмірсутекті нафтендердің изомеризациялану реакциясы жүреді. Гидрокрекинг кезінде температура мен қысымды көтерген кезде; жоғары температура мен сәйксінше төмен қысымда - көбінесе нафтендердің дегидрленуі және парфинді көмірсутектердің дегидроциклизациясы жүреді. Ал төмен температура мен жоғары қысымда – ароматты көмірсутектердің гидрленуі жүреді. Ал саллыстырмалы түрде олефиндердің гидрленуі жеңіл өтеді. Жоғарыда көрсетілген реакциялардың температурасы мен қысымының интенсивтілікке катализатордың табиғаты әсер етеді. Гидротазалау процесінің негізгі реакцияларына күкіртті органикалық қосылыстардың С-S байланысымен жарылуы және сутектің сәйкес көмірсутектермен түзілуі және күкіртсутекпен декструктивті гидрлеу болып табылады: RSH + H2 → RH + H2S
RSR´ + H2 → RH + R´SH
R´SH + H2 → R´H + H2S
RSSR´
Азотты қосылыстар күкіртті органикалық қосылыстарға қарағанда айтарлықтай қиын гидрленеді. Бір құрылымды тұрақтылыққа сәйксінше өсу қатары бойынша гидрленеді: Күкірт құрамды < оттек құрамды < азот құрамды органикалық қосылыстар: C6H5CH2NH2 + H2 → C6H5CH3 + NH3
C6H5NH2 + H2 → C6H6 + NH3
C5H5N + 4H2
C6H5ОН +H2 → C6H6 + H2О
C6H11СООН + 4H2 → C7H16 + 2H2О
Тарау 6 . КАТАЛИТИКАЛЫҚ РИФОРМИНГ Каталитикалық риформинг бұл – белгіленуі бойынша екінші процесс, каталитикалық крекингтен кейінгі мұнайды өңдеудегі екіншілік процесс, яғни жоғары бензин отынын (оның ішінде, авиационды және ракеталы) және бензол қатарындағы ароматты көмірсутектер алуға арналған. Процесс Т= 480 – 520 о С температурада, Н2 Р= 1,5–4,0 МПа қысымда, бифункциональді катализатор қатысында, гидрлеуші-дегидрлеуші қасиетке ие және активті орталықтардың оттекті табиғатымен жүреді. Риформинг шикізаты ретінде тура айдалған бензин фракциясы болып табылады. Осымен қоса, процесте гидротазалау іске асқаннан кейін бензин фракциясы басқа да процестерде қолданылуы мүмкін. Егер процестің мақсаты бензин өндіру болса, онда риформингте шикізаттың фракциялы құрамы температура интервалында қайнаудың басталуы мен аяқталуы 62–180 о С және 85–180оС тербеліп тұрады, С6 – С10 көмірсутек құрамына сәйкес келеді. Ал кейбір жағдайда, мақсатты өнім ретінде ароматты көмірсутектер болған кезде, шикізаттың фракциялық құрамы 62-140оС дейін төмендейді. Шикізаттың көбінесе мақсатты компоненті, циклоалкандар болып табылады. Катализатордың табиғатына байланысты риформинг өндірісі процесінің 3 негізгі айырмашылығы: 1) Платинаформинг (платформинг); 2) Ренийформинг; 3) Молибденийформинг. Көп жағдайда қолданыста болып саналатын осылардың ішіде платформинг. Катализатор ретінде Катализаторды мынадай Ir, Be, Sn, Pb, La, Ce, Nd промоторлаушы қоспаларға енгізгенде, катализатордың таңдамалылығы жоғарылайды және кейбір жанама реакциялар жүреді (арендердің дементанирленуі, циклоалкандардың әсерлесуі). Сонымен қоса, бұл қоспалар катализатордың жарамдылық мерзімін 5-тен 6 – 7 жылға дейін жоғарылатады. Катализатордың қышқылдық функциясын көтеру үшін, оны эксплуатациялаудың бастапқы сатысында, катализаторға 0,5–2 % хлор қосады. Осымен шикізатта судың үлесі 1 ррт аспауы керек. Шикізаттағы ұшқыш хлордың жоғалу компенсациясы үшін, оған хлорорганикалық қосылыстардың қоспасын СН2 Сl – CH2Cl, CCl4, CH3 – CH2Cl аздаған мөлшерде енгізеді. Риформинг процесінің негізгі реакциялары болып табылады: а) бастапқы шикізаттың дегидроциклизация жолымен н-алкандарға ароматталуы; б) алкилді циклопентендардың дегидроизомеризациясы; в) алкилді циклогександардың дегидрленуі; г) н-алкандардың изо-алкандарға изомеризациялануы; д) алкандардың және гетероатомды көмірсутектердің (күкірт және азот құрамды) гидрокрекингіленуі. Риформинг процесінің жылдамдығы каталитикалық крекингке қарағанда жоғары, қолданылған катализатордың табиғатына және процесті жүргізу жағдайына байланысты процестің жылдамдығы жоғары болып келеді. Алкандардың негізгі айналу реакциялары болып табылады: -изомеризация; -дегидроциклизация; -гидрокрекинг. Изомеризация карбкатионды механизм бойынша өтеді. Изомеризация жылдамдығы көмірсутектердің молекулярлық массасының ұлғаюымен өседі. Дегидроциклизация риформингтің теңдеу бойынша өтетін ең маңызды реакциясына байланысты:
Катализаторды кокстеу жағдайында процесс сутек қысымының жоғарылауымен жүреді. Температура Т=500 о С толуолдың құрамындағы н-гептанның конверсиясы 95 % құрайды. Алкандардың ароматталуының негізгі механизмі: 1. Дегидрлену Pt да триенге дейін оның келесі циклизациясына Pt немесе Al2O3:
2. Pt да циклді өтетін комплекс арқылы С5-циклизациялануы:
3. Pt да алкан мен алкендердің дегидрленуі және келесі Al2O3 те алкендердің циклизациялануы:
Алкандардың төмен молекулалы қосылыстардың түзуімен гидрокрекингтелуі келесі теңдеумен сипатталады:
Циклоалкандардың негізгі айналу теңдеулері болып табылады: -изомеризация; -ароматизация; -гидрокрекинг. Изомеризация процесі кезінде сақинаның сығылуы реакция теңдігі араласқан алкил түзілу жағына қарай, сондай –ақ көп жағдайда арендердің түзілу жағына қарай реакцияның тепе – теңдігі жүруі мүмкін:
Бұл процестің таңдамалылығы реакция жылдамдығының қатынасымен және бифункциональді катализатордың активтілігімен анықталады. Циклогексан гомологтарын алкилбензолда дегидрлеу жылдамдығы циклогександарға қарағанда жоғары. Гемараласқан циклогександар мына схема бойынша дегидрленеді:
Бициклогександар моноцик
Поиск по сайту: |












 -А12О3 модифициирленбеген немесе модифицирленген цеолиттен және фтордан тұрады. Мұндай жағдайда гетероатомдардың, металдардың және алкендердің гидрленуі толығымен жойылуы жүреді. Ауыр фракцияда көбінесе полициклді арендер гидрленеді.
-А12О3 модифициирленбеген немесе модифицирленген цеолиттен және фтордан тұрады. Мұндай жағдайда гетероатомдардың, металдардың және алкендердің гидрленуі толығымен жойылуы жүреді. Ауыр фракцияда көбінесе полициклді арендер гидрленеді. RSH + R´SH
RSH + R´SH  RH + R´H + 2H2S
RH + R´H + 2H2S C5H11NH2
C5H11NH2  , промотирлеуші қоспа ретінде Re қолданады. Платина үлесі 0,3 ден 0,6 масс.% дейін құрайды. Платина құрамының 0,3 % аз болуы катализатордың активтілігіне және бензиннің сапасының түсуіне әкеліп соқтырады. Рений 0,3–0,4 масс.%. мөлшерінде платиналы балқыма түзеді, оның дезактивация және кокстелуіне, процесс қысымын 3,5 1,5 МПа дейін түсіруге және бензиннің октан санымен 95(зерттеу әдісі бойынша) 6 % көлемінде шығымын жоғарылатуға мүмкіндік береді.
, промотирлеуші қоспа ретінде Re қолданады. Платина үлесі 0,3 ден 0,6 масс.% дейін құрайды. Платина құрамының 0,3 % аз болуы катализатордың активтілігіне және бензиннің сапасының түсуіне әкеліп соқтырады. Рений 0,3–0,4 масс.%. мөлшерінде платиналы балқыма түзеді, оның дезактивация және кокстелуіне, процесс қысымын 3,5 1,5 МПа дейін түсіруге және бензиннің октан санымен 95(зерттеу әдісі бойынша) 6 % көлемінде шығымын жоғарылатуға мүмкіндік береді.






