 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯСтр 1 из 2Следующая ⇒
Студент должен Знать: · сущность поверхностного натяжения, почему оно возникает; · условия самопроизвольного протекания процессов в поверхностном слое; · понятия «поверхностно-активные» и «поверхностно-инактивные» вещества, «поверхностная активность»; · сущность процесса адсорбции; · особенности физической и химической адсорбции; · понятия «избыточная», «абсолютная» и «удельная» адсорбция Студент должен уметь: · строить изотерму поверхностного натяжения и определять графически поверхностную активность; · рассчитывать поверхностную активность по уравнению Гиббса; · строить изотерму гиббсовой адсорбции и определять предельную адсорбцию ПАВ;
ВВЕДЕНИЕ Для всех коллоидных систем, частицы которых диспергированы в инертной среде и образуют в ней физическую поверхность раздела, процесс диспергирования означает значительное увеличение поверхностной энергии системы. Например, если некоторое количество вещества в виде кубика объёмом 1 см3 имеет общую поверхность 6 см2, то это же количество вещества в виде кубиков в 1мк3 будет иметь общую поверхность 60 000 см2. Таким образом, удельная поверхность вещества в диспергированном состоянии (суммарная поверхность 1 см3 вещества) резко возрастает приблизительно пропорционально уменьшению линейных размеров частиц. Значение этого фактора особенно велико для лиофобных коллоидов, частицы которых инертны по отношению к окружающей среде и не имеют сольватной оболочки, так как в этом случае увеличение удельной поверхности непосредственно связано с увеличением свободной поверхностной энергии, что лежит в основе наиболее характерных свойств лиофобных коллоидов. Дисперсные частицы и дисперсионная среда относятся к различным фазам. (Напомним, что фазой называется однородная часть системы, отделённая от других частей поверхностью раздела.) Система может существовать из разных фаз только в том случае, если межмолекулярные взаимодействия в граничных фазах различны. Единственной системой, в которой межмолекулярные взаимодействия отсутствуют, является идеальный газ. Интенсивность межмолекулярных взаимодействий возрастает при переходе от реальных газов к твёрдым телам. Рассмотрим систему, состоящую из жидкости и газа. Силы межмолекулярного взаимодействия в жидкости F1-1 больше сил взаимодействия между молекулами газа F2-2. Молекула жидкости, находящаяся внутри жидкости, окружена себе подобными молекулами. Силы взаимодействия между такими молекулами при этом взаимно уравновешиваются. Поверхностный слой жидкости находится в особых условиях по сравнению со всем объёмом вещества. Молекулы поверхностного слоя граничат не только с себе подобными молекулами, но и с молекулами газа. Поэтому равнодействующая сила (Р) в этом случае направлена вглубь жидкости; эта сила тем больше, чем больше разность между силами взаимодействия между молекулами жидкости и силами взаимодействия между молекулами газа (Р = F1-1 - F2-2). Таким образом, поверхностная молекула испытывает одностороннее притяжение со стороны жидкости, втягивающее её внутрь жидкости. Равнодействующая сил межмолекулярного взаимодействия поверхностных молекул перпендикулярна поверхности раздела и направлена в сторону фазы с более интенсивным межмолекулярным взаимодействием. Эта сила, отнесённая к единице площади поверхности раздела, носит название внутреннего давления и является важной характеристикой жидкости. Под внутренним давлением жидкости понимают силу притяжения между молекулами жидкости в её объёме. Как правило, внутреннее давление тем больше, чем выше полярность вещества. Втягивая поверхностные молекулы внутрь фазы, внутреннее давление стремится уменьшить поверхность до минимально возможной в данных условиях. Для увеличения поверхности жидкости нужно преодолеть силу внутреннего давления и совершить определённую механическую работу против сил молекулярного сцепления, против внутреннего давления. Очевидно, что чем оно больше, тем больше энергии надо затратить. Эта энергия сосредотачивается в молекулах, находящихся на поверхности, и называется поверхностной энергией. Если увеличение площади поверхности производится при постоянном давлении и температуре (изобарно-изотермический процесс) или при постоянных объёме и температуре (изохорно-изотермический процесс), то оно сопровождается увеличением поверхностной энергии системы (энергии Гиббса или энергии Гельмгольца). Избыток поверхностной энергии, приходящейся на 1 м2 межфазной поверхности, характеризуется поверхностным натяжением (σ). Бесконечно малое изменение поверхностной энергии Гиббса (dG) с изменением величины площади поверхности при постоянных р и Т равно dG = σdS, где dS –бесконечно малое изменение площади поверхности; σ – коэффициент поверхностного натяжения. Из приведённого выражения следует (при постоянстве числа молей компонентов n): σ = Таким образом, поверхностное натяжение можно представить как частную производную от величины энергии Гиббса по величине межфазной поверхности при р =const и Т=const и постоянных числах молей компонентов.
[Гиббс Джозайя Умллард (1839-1903), американский физик теоретик, один из создателей термодинамики и статистической механики. Разработал теоию термодинамического потенциала, открыл общее условие равновесия гетерогенных систем, вывел ряд уравнений.]
Коэффициент поверхностного натяжения или просто поверхностное натяжение σ, является важной характеристикой любой жидкости. Физический смысл поверхностного натяжения может иметь энергетическое и силовое выражения. Согласно энергетическому выражению, поверхностное натяжение σ есть поверхностная энергия Гиббса единицы поверхности (т.е. удельная поверхностная энергия Гиббса). В таком случае σ равно работе, затраченной на образование единицы поверхности. Энергетической единицей σ является Дж/м2. Силовое определение поверхностного натяжения формулируется так: σ – это сила, действующая на поверхности по касательной к ней и стремящаяся сократить свободную поверхность тела до наименьших возможных пределов при данном объёме. В этом случае единицей измерения σ является Н/м. Энергетическое и силовое выражения σ эквивалентны, и численная величина совпадает в обеих размерностях. Так, для воды при 298 К σ = 71,96∙10-3 Дж/м2 = 71,96∙10-3 Н/м. Одна размерность легко выводится из другой: Дж/м2 = Н∙м/м2 = Н/м. При площади поверхности раздела фаз S и поверхностном натяжении σ поверхностная энергия Гиббса выражается таким образом: GS = σS. Таким образом, поверхностное натяжение – это удельная свободная поверхностная энергия, т.е. свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности. Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше поверхностное натяжение. Для границы «конденсированная фаза (твёрдая или жидкая) – воздух» можно пренебречь межмолекулярными взаимодействиями в воздухе (Fгаз-газ ≈ 0) и, значит, поверхностное натяжение характеризует интенсивность межмолекулярных сил в конденсированной фазе. Поверхностное натяжение на границе «жидкость – жидкость» также зависит от природы соприкасающихся фаз: чем больше разность полярностей фаз, тем больше поверхностное натяжение на границе их раздела. Поверхностное натяжение жидкостей уменьшается с ростом температуры. Это означает, что при критической температуре границы раздела между фазами исчезают и система «газ – жидкость» из гетерогенной превращается в гомогенную. Поэтому величина поверхностного натяжения является мерой гетерогенности системы, причём не только «газ – жидкость», но и «жидкость – жидкость». При повышении давления увеличивается взаимодействие поверхностных молекул жидкости с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности. Поэтому с повышением давления в системе «жидкость – газ» поверхностное натяжение уменьшается.
Самопроизвольные процессы в поверхностном слое Для индивидуальных веществ поверхностное натяжение постоянно (σ = const, dσ = 0). В этих случаях самопроизвольно могут протекать процессы, сопровождающиеся уменьшением площади межфазной поверхности (dS1,2<0). К поверхностным явлениям, связанным с уменьшением поверхности, можно отнести: · стремление капель жидкости или пузырьков газа принять сферическую форму (сферические частицы имеют самую маленькую удельную поверхность); · слипание твёрдых частиц дисперсной фазы (коагуляция); · слипание капель в эмульсиях или пузырьков газа в пенах (коалесценция); · рост кристаллов. Если площадь межфазной поверхности остаётся постоянной, то это возможно за счёт уменьшения поверхностного натяжения (dσ<0), которое может быть обусловлено процессом адсорбции.
Измерение поверхностного натяжения сталагмометрическим методом Этот метод определения поверхностного натяжения заключается в измерении объёма или веса капли, медленно отрывающейся от кончика вертикальной трубки, внутренний радиус которой r. В основе метода лежит предположение, что отрыв капли происходит в тот момент, когда её вес Р становится равным силам поверхностного натяжения, действующим вертикально по окружности трубки, т.е. в момент отрыва капли Р = 2πrσ. При более точном определении σ следует учитывать, что разрыв происходит в шейке капли, которая имеет меньший радиус, чем трубка. Поэтому значение радиуса r надо умножить на некоторый коэффициент k, зависящий от отношения объёма капли v к кубу радиуса трубки, k = f( Для определения веса капли пользуются сталагмометром, который представляет собой стеклянную трубку с расширением посредине, заканчивающуюся внизу капилляром. Трубка обычно имеет горизонтальную коленчатую часть, в которую впаян капилляр для того, чтобы жидкость капала медленнее. Расширенная часть трубки ограничена двумя метками. Для измерения поверхностного натяжения сталагмометр заполняют исследуемой жидкостью выше верхней метки; когда уровень жидкости опустится до верхней метки, начинают считать число капель n жидкости, вытекающей из трубки, до тех пор, пока уровень жидкости не достигнет нижней метки. Если известны объём расширенной части сталагмометра V и плотность жидкости ρ, то вес капли Р можно вычислить по формуле Р = где g – ускорение силы тяжести. k2πrσ Очевидно, что при отрыве капли должно соблюдаться равенство k2πrσ = Обычно проводят относительное определение σ, сравнивая истечение из данного сталагмометра исследуемой жидкости и жидкости с известным поверхностным натяжением. В этом случае пользуются для расчёта следующей формулой:
σх = σст ∙
В этом уравнении индекс х относится к параметрам исследуемой жидкости, а индекс «ст» – к параметрам жидкости с известным поверхностным натяжением. Если стандартной жидкостью является вода, величину nст называют «водяным числом сталагмометра», значение этой величины для воды при 20°С равно 72,8 мДж/м2. И для разбавленных водных растворов, плотность которых мало отличается от единицы, формулу можно упростить: σх = σводы Из полученной формулы следует, что для определения поверхностного натяжения достаточно подсчитать число капель исследуемой жидкости. Изменение поверхностного натяжения биологических жидкостей используется в диагностических целях. Например, поверхностное натяжение плазмы крови значительно изменяется при различных заболеваниях (анафилактический шок, рак, и др.). С возрастом у человека поверхностное натяжение сыворотки крови уменьшается. Из многочисленных методов измерения поверхностного натяжения при биохимических, физиологических и клинических исследованиях чаще всего используют сталагмометрический метод и метод продавливания пузырьков воздуха.
ПОВЕРХНОСТНЫЕ СВОЙСТВА РАСТВОРОВ Поверхностные свойства растворов отличаются от поверхностных свойств чистых жидкостей прежде всего тем, что состав поверхностного слоя раствора в той или иной степени отличен от состава внутренних слоёв раствора. Растворённые вещества в зависимости от природы могут по-разному влиять на поверхностное натяжение жидкостей. Способность растворённых веществ изменять поверхностное натяжение растворителя называется поверхностной активностью. Все вещества по способности изменять поверхностное натяжение растворителя делятся на три группы. 1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными вещества (ПАВ). По отношению к водным растворам поверхностно-активными веществами являются спирты, жирные кислоты и их соли (мыла), сложные эфиры, амины, белки и некоторые другие вещества, имеющие дифильное строение. В молекулах таких веществ различают неполярную (гидрофобную) часть – углеводородный радикал («хвост») и полярную (гидрофильную) часть. Молекулу ПАВ принято изображать следующей схемой:
Прямая линия символизирует неполярную часть - углеводородный радикал («хвост»), а кружок – полярную группу. Чтобы вещество обладало способностью понижать поверхностное натяжение растворителя, необходимо, чтобы в составе молекулы имелись полярные группы: -ОН, -NH2, -COOH, -SO3 др. Поверхностно-активными по отношению к воде являются вещества менее полярные, чем вода (так, дипольный момент воды равен 1,84 Д, а у этанола – 1,70 Д). Такие вещества взаимодействуют с водой намного слабее, чем молекулы воды друг с другом. Поэтому, попадая на поверхность, они уменьшают поверхностное натяжение. Мерой способности растворённого вещества к понижению поверхностного натяжения раствора является величина производной поверхностного натяжения по концентрации Поверхностная активность веществ одного и того же гомологического ряда возрастает приблизительно в три раза при увеличении углеводородной цепи на одну метиленовую группу (- СН2 -). ПАВ, как и все вещества в зависимости от способности к электролитической диссоциации, делят на электролиты (ионогенные ПАВ) и неэлектролиты (неионогенные ПАВ). Ионогенные ПАВ подразделяют на катионные, анионные и амфотерные. 2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К этим веществам относятся сильные электролиты: соли, кислоты, щёлочи. Ионы этих веществ, образующиеся в результате электролитической диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды внутрь объёма раствора. Однако некоторые немногие оставшиеся на поверхности создают вблизи поверхности силовое поле, тем самым повышают поверхностное натяжение. 3. Имеются вещества, которые не меняют поверхностное натяжение растворителя. Эти вещества называют поверхностно-неактивными. Молекулы таких веществ в своём составе имеют большое число полярных функциональных групп (например, сахароза). Всё многообразие зависимостей поверхностного натяжения от концентрации может быть представлено кривыми трёх типов:

Рис. 1. Зависимость поверхностного натяжения водного раствора от концентрации ПАВ (1); ПИВ (2) и не влияющих на величину поверхностного натяжения веществ ПНВ (3).
Из графика видно, что для ПАВ Отметим, что понятия ПАВ и ПИВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением. АДСОРБЦИЯ НА ПОВЕРХНОСТИ РАСТВОРОВ. УРАВНЕНИЕ ГИББСА
Изменение концентрации растворённого вещества в поверхностном слое раствора (или вообще на границе раздела фаз) называется адсорбцией. Дж. Гиббс на основе второго закона термодинамики в 70-х гг. XIX в. вывел важное уравнение, связывающее величину адсорбции со способностью растворённого вещества изменять поверхностное натяжение раствора: Г = где Г – количество адсорбированного вещества, моль/м2; с – молярная концентрация растворённого вещества, моль/дм3, Т – температура, при которой происходит адсорбция, R – газовая постоянная, Уравнение Гиббса отражает следующую зависимость: чем сильнее уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше его поверхностная активность. Это свидетельствует о том, что знак «минус» указывает на обратную зависимость между величиной адсорбции Г и поверхностным натяжением σ. Если Адсорбция вещества – обратимый процесс, заканчивающийся установлением адсорбционного равновесия, при котором скорость адсорбции равна скорости обратного процесса – десорбции. Рассмотрим изотерму адсорбции Гиббса (Рис. 2):
Рис. 2. Изотерма адсорбции Гиббса. Из графика видно, что по мере увеличения концентрации вещества адсорбция возрастает вначале резко, а затем всё медленнее и медленнее, асимптотически приближаясь к некоторой величине предельной адсорбции Г∞. Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определённую площадь и при достижении определённой концентрации ПАВ в растворе (С∞) она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна (однослойна), дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое.
ОРИЕНТАЦИЯ МОЛЕКУЛ ПАВ В ПОВЕРХНОСТНОМ СЛОЕ В 1915 г Ленгмюр ввел понятие об ориентации молекул ПАВ в поверхностном слое.
[Ленгмюр Ирвинг (1881-1957), американский физик и физико-химик. Труды по электрическим разрядам в газах,термоэлектронной эмиссии, вакуумной технике и др. Исследовал поверхностные явления (адсорбция, мономолекурные слои и др.). Нобелевская премия (1932).]
Исходя из строения молекул ПАВ, Ленгмюр сформулировал принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа молекулы, обладающая большим сродством к полярной фазе, втягивается в воду, в то время как неполярный радикал выталкивается в неполярную фазу. Происходящее при этом уменьшение свободной поверхностной энергии ограничивает размеры поверхностного слоя толщиной в одну молекулу. Образуется мономолекулярный слой. При малых концентрациях ПАВ углеводородные радикалы «лежат» на поверхности полярной жидкости, а полярные группировки погружены в неё. Затем по мере роста концентрации ПАВ, они (неполярные радикалы) начинают подниматься. В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом Ленгмюра» из вертикально ориентированных молекул ПАВ. Значение поверхностного натяжения в этом случае приближается к значению, характерному для чистого ПАВ на границе с воздухом.
А) малые концентрации ПАВ Б) умеренные концентрации В) насыщенный адсорбционный слой
Рис. 3. Ориентация молекул ПАВ на поверхности водного раствора.
Из-за вертикальной ориентации ПАВ в поверхностном слое максимальная адсорбция (Г∞) не зависит от длины «хвоста» (длины углеродного радикала), а определяется только размерами поперечного сечения молекулы, которые в гомологическом ряду остаются неизменными. Экспериментально найденная величина Г∞ даёт возможность вычислить поперечный размер молекулы S0: S0 =
Представления об ориентации молекул ПАВ в насыщенном адсорбционном слое сыграли большую роль в развитии учения о структуре биологических мембран. Клеточные мембраны образованы главным образом молекулами двух типов: липидами и белками. Липиды не растворимы в воде, но растворимы в органических растворителях. Особенностью мембранных липидов является то, что на одном конце их молекулы есть полярные группы (например –СООН), обладающие гидрофильными свойствами, тогда как другой её конец представляет собой длинную углеводородную цепь с гидрофобными свойствами. Липиды биомембран расположены двумя слоями. Обычно говорят о двухслойной структуре. Каждый (моно) слой состоит из сложных липидов (и иногда холестерина), расположенных таким образом, что неполярные гидрофобные хвосты молекул находятся в тесном контакте друг с другом; в таком же контакте полярные гидрофильные элементы. Все взаимодействия имеют исключительно нековалентный характер. Два монослоя совмещаются, ориентируясь «хвост к хвосту», так, что образуется структура двойного слоя, имеющая неполярную внутреннюю часть и две полярные поверхности. Толщина липидного слоя примерно 3,5 – 4 нм. Молекулы белка могут располагаться вблизи внешней и внутренней поверхностей мембраны, а также проникать, частично или полностью, через всю её толщину. Обычно клеточные мембраны весьма прочны и обладают свойствами электрического изолятора. Биологические мембраны не являются жесткими структурами. Например, во многих случаях белки и липиды внутри мембран находятся в постоянном движении. АДСОРБЦИЯ НА НЕПОДВИЖНОЙ ГРАНИЦЕ РАЗДЕЛА ФАЗ (НА ПОВЕРХНОСТИ ТВЁРДОГО ВЕЩЕСТВА)
Под адсорбцией на неподвижной границе раздела фаз понимается накопление одного вещества на поверхности другого. Твёрдое вещество, на поверхности которого накапливается другое вещество, называется адсорбентом, а поглощаемое вещество – адсорбтивом. Уже адсорбированное вещество называется адсорбатом. В зависимости от природы сил, действующих между адсорбентом и адсорбатом различают физическую и химическую адсорбции. Физическая адсорбция обусловлена межмолекулярным взаимодействием за счёт сил Ван-дер-Ваальса (ориентационных, индукционных и дисперсионных) или водородной связью. Поэтому для этого вида адсорбции характерны: обратимость, неспецефичность, экзотермичность.
[Ван-дер-Ваальс Ян Дидерик (1837-1923), нидерландский физик. Профессор физики университета в Амстердаме. Сформулировал уравнение состояния реального газа, в равной степени применимое к жидкости и к газу и т.д. Внёс значительный вклад в термодинамическую теорию капиллярности. Нобелевская премия (1910)]. Химическая адсорбция осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической связи. Энергия возникающих при этом связей 40 – 400 кДж/моль. Хемсорбция практически необратима, специфична и локализована. Повышение температуры усиливает химическую адсорбцию. АДСОРБЦИЯ НА ТВЁРДЫХ ПОВЕРНОСТЯХ УДЕЛЬНАЯ АДСОРБЦИЯ
При адсорбции веществ на поверхности твёрдых адсорбентов изменяется химический состав поверхности адсорбента. Количественной характеристикой этого процесса является величина удельной адсорбции Г. Удельная адсорбция – это равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или массы адсорбента. В качестве адсорбентов обычно применяют мелкоизмельченные вещества или пористые тела, что обеспечивает большую площадь поверхности раздела фаз, которую определить практически невозможно. Поэтому удельная адсорбция для твердых адсорбентов преимущественно выражается в молях поглощенного вещества на единицу массы адсорбента: Г = где n –количество адсорбата, моль; m – масса адсорбента, г. Адсорбция газов и паров адсорбата на твердых адсорбентах – процесс, протекающий за счет сил Ван-дер-Ваальса и водородных связей. Количество поглощенного газа или пара на твёрдых поверхностях зависит от следующих факторов.
1. От свободной поверхностной энергии адсорбента. Она весьма велика у адсорбентов с аморфной структурой (активированный уголь) и у кристаллических веществ (оксиды алюминия, кремния). Адсорбент тем эффективнее, чем меньше измельчен.
2. От сродства адсорбтива к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные на неполярных. Чем больше адсорбент склонен к межмолекулярным взаимодействиям, тем интенсивнее идет адсорбция.
3. При физической адсорбции из смеси газов или паров лучше адсорбируется тот компонент, который легче сжимается, поскольку его молекулы более склонны к межмолекулярным взаимодействиям.
4. От концентрации адсорбата. Зависимость имеет сложный характер, так как с адсорбцией идет одновременно процесс десорбции. При равенстве скоростей этих процессов наступает равновесие.
ТЕОРИЯ МОНОМОЛЕКУЛЯРНОЙ АДСОРБЦИИ ЛЕНГМЮРА. УРАВНЕНИЕ ЛЕНГМЮРА
Изучая адсорбцию на твердых поверхностях Ленгмюр предложил теорию мономолекулярной адсорбции и уравнение адсорбции. Основные положения теории Ленгмюра следующие: v адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах, где имеются участки с наиболее нескомпенсированными силовыми полями; v каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что приводит к образованию мономолекулярного слоя поглощаемого вещества; v процесс адсорбции обратим и носит динамический характер, т.к. адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция такого же числа новых молекул. Исходя из этих положений, Ленгмюр предложил уравнение адсорбции: Г = Где Г∞ - значение предельной адсорбции; с – равновесная концентрация адсорбента в системе; К – константа адсорбционного равновесия. Зависимость адсорбции от концентрации ПАВ (изотерма адсорбции) имеет вид:
Рис. 4. Зависимость адсорбции от концентрации ПАВ
На кривой четко видны три участка: I - ый участок – это прямая линия, выходящая из начала координат. Действительно, при малых концентрациях, когда с → 0 и (1 + Кс) ≈1, уравнение принимает вид Г = Г∞·Кс, т.е. величина адсорбции прямо пропорциональна концентрации или давлению адсорбата. III – участок – соответствует прямой, параллельной оси абсцисс, что означает, что адсорбция достигла своего предельного значения. При этом Кс ›› 1 и (1 + Кс) ≈ Кс, тогда Г = Г∞ (произошло насыщение поверхности адсорбента молекулами адсорбата, так как сформировался мономолекулярный слой). II – ой участок соответствует криволинейной части графика и описывается полным уравнением Ленгмюра.
ОСНОВЫ ТЕОРИИ ПОЛИМОЛЕКУЛЯРНОЙ АДСОРБЦИИ Уравнение Ленгмюра даёт хорошие результаты при условии, что адсорбция вещества сопровождается образованием мономолекулярного слоя. Это происходит при хемосорбции и при физической адсорбции газов при небольших давлениях и температуре выше критической (отсутствует конденсация на поверхности адсорбента). Опыт показал, что, если адсорбция протекает с образованием полимолекулярного адсорбционного слоя, то изотерма отличается от ленгмюровской и имеет более сложный вид. Такие изотермы называют S-изотермы, так как адсорбция не останавливается на образовании монослоя. Возможность образования полимолекулярных адсорбционных слоёв рассматривается в теории Поляни. Эта теория допускает существование на поверхности твёрдых адсорбентах адсорбционных сил, действующих на расстоянии, значительно превышающих диаметр молекул адсорбата. Основные положения теории Поляни следующие:
1. Адсорбция создаётся чисто физическими силами. 2. На поверхности адсорбента нет активных центров, а адсорбционные силы действуют вблизи от поверхности адсорбента, образуя непрерывное силовое поле. 3. Силовое поле, обусловливающее адсорбцию, действует на расстояния, которые больше, чем размеры отдельных молекул адсорбата. Иначе говоря, у поверхности адсорбента существует так называемый адсорбционный объём, который заполняется при адсорбции молекулами адсорбата. 4. Притяжение молекул адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном объёме других молекул. Поэтому идёт полимолекулярная адсорбция. 5. Адсорбционные силы не зависят от температуры, поэтому с изменением температуры адсорбционный объём не изменяется.
Теория Поляни не дала математического выражения изотермы адсорбции. Однако представления Поляни легли в основу современной теории адсорбции, которую создали С.Брунауэр, П. Эммет и Е. Теллер. Поэтому сокращённо эту теорию называют теорией БЭТ. Теория постулирует, что при температуре ниже критической каждая молекула, адсорбированная в первом слое является центром для молекул, образующих второй слой, и т.д. Авторы этой теории вывели уравнение
где Р0 – упругость насыщенного пара, V- объём адсорбированного газа при данном давлении газа Р; VM – объём адсорбированного газа в монослое и с = Уравнение БЭТ получило широкое применение. Из величины VM может быть вычислена полная адсорбирующая поверхность адсорбента S, что имеет важное практическое значение, а из величины С вычисляется теплота адсорбции газа в монослое. В качестве примера значений площади S укажем, что адсорбирующая поверхность 1 г испытанного образца силикагеля составила 500 м2, а 1 г коллагена – 350 м2. Хорошие адсорбенты обладают весьма значительной удельной поверхностью, например, активированный уголь – до 1000 м2/г. Уравнение БЭТ применялось также для определения удельной поверхности различных аморфных и кристаллических полимеров. АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО – ЖИДКОСТЬ Существенным отличием адсорбции веществ из растворов является конкуренция между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Рассматривая этот вид адсорбции, остановимся на следующем:
1. При адсорбции из раствора важным фактором является величина удельной поверхности адсорбента и его сродство к поглощаемому веществу. Гидрофильные адсорбенты (силикагель, глины, пористые стекла) хорошо поглощают полярные вещества, а гидрофобные (сажа, активированный уголь) -–неполярные вещества. 2. Природа растворителя: Чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества. 3. Природа поглощаемого вещества: а) выполняется правило «подобное взаимодействует с подобным», т.е. должно быть сродство между адсорбентом и адсорбтивом; б) Выполняется правило Шилова: Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента. в) правило Ребиндера (правило уравнивания полярностей Ребиндера): На поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причём с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает Эффективней всего адсорбируются молекулы веществ, имеющих дифильное строение. В этом случае идёт эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз. Полярный фрагмент молекулы обращен всегда к полярной фазе – к воде, силикагелю, а неполярный фрагмент – к неполярной (гидрофобной) фазе – активированному углю, маслу. 4. Влияние концентрации растворенного вещества на процесс адсорбции при постоянной Т описывается уравнением Ленгмюра. 5. Повышение температуры снижает эффективность адсорбции. Это объясняется ослаблением взаимодействия между адсорбентом и адсорбатом. Молекулярная адсорбция из растворов на твердом адсорбенте широко используется в медицинской практике. Активированный уголь хорошо адсорбирует газы, алкалоиды, барбитураты, токсины из пищеварительной системы. Одна таблетка активированного угля массой 0,25 г имеет адсорбционную поверхность около 100 м2.
АДСОРБЦИЯ РАСТВОРЁННОГО В ЖИДКОСТИ ВЕЩЕСТВА НА ТВЁРДОМ АДСОРБЕНТЕ
Различают молекулярную и ионную адсорбцию. Молекулярная адсорбция – это адсорбция из растворов неэлектролитов (или очень слабых электролитов). При молекулярной адсорбции вещество адсорбируется на поверхности твёрдого тела в виде молекул.
Особенности молекулярной адсорбции: наряду с растворённым веществом адсорбируются молекулы растворителя. Поэтому для адсорбции растворённого вещества его молекулы должны вытеснять с поверхности молекулы растворителя. Экспериментально величину адсорбции «а» изучают измеряя молярную концентрацию раствора до контакта с адсорбентом (с0) и после наступления адсорбционного равновесия (сs):
а – количество адсорбированного вещества, приходящееся на 1 г адсорбента; m – масса адсорбента, г: V – объём раствора, из которого идёт адсорбция, л. На молекулярную адсорбцию влияют: ü равновесная концентрация растворённого вещества; ü природа растворителя; ü природа адсорбента; ü природа растворённого вещества; ü температура, время адсорбции.
Ионная адсорбция – это адсорбция из растворов сильных электролитов; в этом случае адсорбируется растворённое вещество на поверхности твёрдого адсорбента в виде ионов.
Ионная адсорбция – процесс более сложный, так как в растворе присутствуют уже частицы как минимум 3 видов: катионы, анионы растворённого вещества и молекулы растворителя. Особенности ионной адсорбции:
1. Адсорбируются заряженные частицы (ионы), а не молекулы. 2. Адсорбция происходит только на полярных адсорбентах, поэтому её часто называют полярной адсорбцией. 3. Адсорбция сопровождается образованием двойного электрического слоя (ДЭС). 4. Адсорбция является избирательной, т.е. на каждом данном адсорбенте катионы и анионы адсорбируются неодинаково. 5. В основе ионной адсорбции лежат химические силы, и она чаще всего кинетически необратима. 6. Для ионной адсорбции характерно явление обменной адсорбции. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ИОННУЮ АДСОРБЦИЮ
1. Химическая природа адсорбента Чем более полярным является адсорбент, тем лучше он адсорбирует ионы из водных растворов. На активных центрах, несущих положительный заряд, адсорбируются анионы, на отрицательных - катионы.
2. Химическая природа ионов
а) На адсорбцию ионов большое влияние оказывает величина радиуса иона. Чем больше кристаллический радиус иона при одинаковом заряде, тем лучше он адсорбируется, так как с увеличением кристаллического радиуса иона возрастает его поляризуемость, а следовательно, способность притягиваться к полярной поверхности – адсорбироваться на ней. Одновременно увеличение кристаллического радиуса приводит к уменьшению гидратации иона, а это облегчает адсорбцию. В соответствии с этим ионы можно расположить в ряды по возрастающей способности к адсорбции. Эти ряды называют лиотропными рядами или рядами Гофмейстера:
Li+ ‹ Na + ‹ K + ‹ Rb + ‹ Cs + Mg 2+ ‹ Са 2+ ‹ Sr 2+ ‹ Ва 2+
Адсорбционная способность возрастает
б) Чем больше заряд иона, тем сильнее ион притягивается противоположно заряженной поверхностью твердого тела, тем сильнее адсорбция: K + ‹‹ Са 2+ ‹‹ Al 3+
Особый интерес представляет адсорбция ионов поверхностью кристалла, в состав которого входят такие же ионы или родственные ионы. В этом случае адсорбцию можно рассматривать как кристаллизацию, т.е. достройку кристаллической решетки способными адсорбироваться на ней ионами. Это позволило Панету и Фаянсу сформулировать следующее правило:
На кристаллической поверхности адсорбента адсорбируются те ионы, которые способны достраивать кристаллическую решетку и дают труднорастворимое соединение с ионами, входящими в состав кристалла. Пример:
 nAgCl + K+ + Cl- → nAgCl nAgCl + K+ + Cl- → nAgCl
[Панет Фридрих Адольф (1887 – 1958), немецкий химик. Первым исследовал абсолютный возраст метеоритов, один из авторов правила Фаянса-Панета. Фаянс Казимир (1887-1975), американский физико-химик, иностранный член-корреспондент АН СССР с 1924 года, труды в области радиохимии. Установил вместе с Ф. Панетом праило Фаянса-Панета).] ИОНООБМЕННАЯ АДСОРБЦИЯ
Ионообменная адсорбция – это процесс, при котором твёрдый адсорбент обменивает свои ионы на ионы такого же знака заряда, находящиеся в растворе.
Для ионообменной адсорбции характерно следующее:
¨ эта адсорбция специфична, т.е. к обмену способны только определённые ионы, по своей природе этот процесс приближается к химическим явлениям; ¨ ионообменная адсорбция не всегда обратима; ¨ протекает медленнее, чем молекулярная адсорбция; ¨ при ионообменной адсорбции может меняться рН среды.
Вещества, проявляющие способность к ионному обмену при контакте с растворами электролитов, называются ионитами. Большинство ионитов – твёрдые, нерастворимые, ограниченно набухающие вещества. Иониты состоят из каркаса, несущего положительный или отрицательный заряд, и подвижных противоионов, которые компенсируют своими зарядами заряд каркаса и стехиометрически обмениваются на противоионы раствора электролита. По знаку заряда обменивающихся ионов иониты делят на катиониты, аниониты и амфолиты. По химической природе каркаса – на неорганические, органические и минерально-органические. Неорганические и органические иониты могут быть природными (целлюлоза, древесина, торф) и синтетическими (силикагель, Al2O3, наиболее важны ионообменные смолы). Минерально-органические состоят из органического полиэлектролита на минеральном носителе. Иониты применяются для очистки, разделения и концентрирования веществ из водных органических и газообразных сред. Например: очистка сточных вод, лекарственных веществ, сахара, выделение ценных металлов и т. д. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ (по теме «Поверхностная энергия. Адсорбция»)
1. Какова причина возникновения избыточной поверхностной энергии? 2. Что называется поверхностным натяжением? От чего зависит величина поверхностного натяжения? 3. В чём заключаются причины самопроизвольных поверхностных явлений? 4. Какие поверхностные явления связаны с уменьшением величины межфазной поверхности? 5. Что называется адсорбцией? Чем она обусловлена? 6. Чем можно объяснить, что деревянную палочку диаметром 1 см сломать легко, а стальной стержень такого же диаметра – практически невозможно? 7. Какие вещества называются поверхностно-активными, поверхностно-инактивными? 8. В чём состоят особенности строения молекул ПАВ и ПИВ и их адсорбции? 9. Как зависит поверхностное натяжение от концентрации ПАВ в растворе? 10. Уравнение Гиббса, его анализ. Ориентация молекул в поверхностном слое; структура липидного биослоя. 11. Чем отличается физическая адсорбция от хемосорбции? 12. Что называется поверхностной активностью? Как её можно определить графически и аналитически? 13. В чём заключается правило Дюкло-Траубе? 14. Как графически можно определить предельную адсорбцию? 15. В чём состоят особенности газов и паров на твёрдых поверхностях? 16. Какие участки есть на изотерме Ленгмюра? Какие математические уравнения характеризуют каждый участок? 17. Перечислите основные положения теории Ленгмюра. 18. Как с помощью теории Ленгмюра можно объяснить ступенчатую адсорбцию? 19. От каких факторов зависит адсорбция на пористых адсорбентах? 20. Какие свойства газов влияют на их адсорбцию. 21. Что является причиной адсорбции растворённых веществ на поверхности твёрдых тел? 22. Какая адсорбция является молекулярной, от каких факторов она зависит? 23. Как зависит молекулярная адсорбция от природы растворённого вещества, растворителя и адсорбента? 24. Перечислите особенности ионной адсорбции. Как она зависит от размеров и зарядов ионов? 25. Сформулируйте правило Панета –Фаянса. 26. В чём сущность ионообменной адсорбции? Какое состояние называется ионообменным равновесием? Какая величина его характеризует? 27. Какие поверхности называются гидрофильными, гидрофобными?
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ЗАДАНИЕ № 1 Определение зависимости поверхностного натяжения растворов от длины углеводородной цепи ПАВ сталагмометрическим методом
Цель работы. Изучить влияние длины углеводородной цепи и концентрации ПАВ на величину поверхностного натяжения растворов.
Сущность работы сводится к подсчёту числа капель исследуемых растворов ПАВ и воды, вытекающих из одного и того же объёма сталагмометра. Жидкость засасывается выше верхней метки, и когда её уровень опустится до верхней метки, начинают считать число капель, вытекающей жидкости, до тех пор, пока уровень жидкости достигнет нижней метки. Капля, вытекающей жидкости, отрывается от трубки сталагмометра под действием силы тяжести собственной массы. Поверхностное натяжение стремится противодействовать вытеканию капли, поскольку образование капли связано с увеличением поверхности жидкости. Чем больше поверхностное натяжение, тем больше должна быть масса капли, способной преодолеть поверхностное натяжение и оторваться.
Практическая часть
1. Определяют число капель воды, выливающейся из сталагмометра. 2. Затем подсчитывают число капель 0,1 М водных растворов следующих спиртов в указанном порядке: С2Н5ОН, С3Н7ОН, С4Н9ОН, С5Н11ОН. 3. Рассчитывают поверхностное натяжение этих спиртов по формуле σх = σводы ∙ nводы / nx. 4. Строят кривую зависимости σ от числа углеродных атомов в молекулах спиртов (n атомов углерода). 5. Делают вывод о зависимости поверхностного натяжения водных растворов спиртов от длины углеводородной цепи молекул спирта.
ЗАДАНИЕ № 2 Определение зависимости поверхностного натяжения раствора от концентрации ПАВ сталагмометрическим методом
Цель работы. Изучить зависимость величины поверхностного натяжения раствора от концентрации ПАВ
Работа выполняется аналогично действиям в работе № 1. 1. Как и в задании 1, вначале подсчитывают число капель воды. 2. Затем подсчитывают число капель водных растворов амилового спирта следующих концентраций: 0,01 М; 0,025 М; 0,05 М; 0,1 М; 0,2М. Подсчёт капель нужно начинать производить, начиная с растворов низшей концентрации. 3. Рассчитывают поверхностное натяжение водных растворов амилового спирта по формуле, приведённой в задании 1. 4. Графически представляют зависимость поверхностного натяжения водных растворов амилового спирта от его концентрации. 5. Делают вывод о зависимости σ от концентрации растворов амилового спирта.
ЗАДАНИЕ № 3 Изучение адсорбции вещества из раствора на твёрдом адсорбенте
Цель работы. Экспериментально определить величину адсорбции уксусной кислоты из раствора на активированном угле.
Сущность работы сводится к приведению растворов известной концентрации в контакт с адсорбентом. Затем через некоторое время после установления адсорбционного равновесия находят концентрацию равновесного раствора. Количество адсорбированного вещества из раствора вычисляют по разности между концентрацией раствора до и после адсорбции. Определяя эту разность для растворов различной концентрации и зная массу адсорбента, получают данные об удельной адсорбции вещества при разных значениях равновесных концентраций. По этим данным строят изотерму адсорбции. Изотерма описывается с помощью уравнения Лэнгмюра.
Ход работы
Начертите таблицу по форме, указанной ниже:
С помощью мерного цилиндра в четыре сухие пронумерованные колбы наливают по 25 мл раствора уксусной кислоты, концентрации указаны в таблице. Затем в каждую колбу вносят одновременно по 0,5 г предварительно измельчённого активированного угля. Содержимое колб перемешивают круговыми движениями в течение 10 минут. После этого растворы фильтруют через сухие складчатые фильтры в отдельные колбочки. Из каждого фильтрата с помощью пипетки отбирают по 10 мл и переносят в колбочки для титрования, добавляют по 2 капли индикатора фенолфталеина и титруют каждую пробу раствором гидроксида натрия (до устойчивой слабо-розовоой окраски). Результаты титрования записывают в таблицу. Далее рассчитывают равновесную концентрацию уксусной кислоты по формуле
Сравн (CH3COOH) =
где V(СН3СООН) – объём, взятый для титрования. Адсорбцию уксусной кислоты рассчитывают по формуле
где Сисх – концентрация раствора уксусной кислоты до адсорбции, моль/л; Сравн – концентрация раствора уксусной кислоты после адсорбции или равновесная концентрация, моль/л; Vисх – объём раствора кислоты, взятый для адсорбции (в нашем опыте – это 0,025 л); m – масса адсорбента (в нашем случае это 0,5 г). Чтобы построить изотерму адсорбции, по оси абсцисс откладывают равновесные концентрации Сравн, а по оси ординат – соответствующие им значения адсорбции Г. Исходя из полученных данных, делают вывод о том, как зависит величина адсорбции уксусной кислоты из раствора на угле от её равновесной концентрации. ЗАДАНИЕ 4 Адсорбция на активированном угле К воде прилить несколько капель чернил для авторучки. Полученный раствор пропустить 1 – 2 раза через колонку, заполненную активированным углем. Отметить, что при этом наблюдается. Повторить опыт с растворами окрашенных веществ, например с растворами лакмуса или фуксина.
ЗАДАНИЕ 5 Адсорбционные свойства силикагеля
К раствору сульфата меди (II) добавить раствор аммиака. При этом образуется комплексное соединение ярко синего цвета (написать реакцию образования комплекса). Затем в раствор всыпать 0,5 – 1 г измельчённого силикагеля и раствор взбалтывают. Бесцветный порошок силикагеля принимает тёмно-синюю окраску, а раствор бледнеет. Раствор слить с силикагеля, промыть водой (2 – 3 раза) и после этого добавить соляную кислоту. Темно-синяя окраска силикагеля исчезает, так как кислота разрушает медно-аммиачный комплекс и вымывает из силикагеля ионы меди. Образцы решения типовых задач Задача № 1 К 60 мл раствора уксусной кислоты с концентрацией раствора 0,1 моль/л добавили 2 г адсорбента и взболтали. После достижения равновесия пробу раствора объёмом 10 мл оттитровали раствором гидроксида натрия с концентрацией 0,05 моль/л. На титрование затрачено 15 мл титранта. Рассчитайте величину адсорбции уксусной кислоты.
Решение 1. Найдём равновесную концентрация раствора уксусной кислоты по результатам титрования:
Сравн(СН3СООН) =
Сравн(СН3СООН) =
2. Рассчитываем величину адсорбции уксусной кислоты по формуле:
Г(СН3СООН) =
Г(СН3СООН) = 7,5 ∙ 10-4 моль/г = 0,75 ммоль/ г
Задача № 2 Определите величину адсорбции кислоты С8Н17СООН на поверхности водного раствора при 10 0С, если массовая доля кислоты в растворе 0,005%. Поверхностное натяжение чистой воды и раствора при этой температуре равны соответственно 74,22 ∙ 10-3 и 57,0 ∙ 10-3 Дж/м2.
Решение 1. Для расчёта адсорбции Г на поверхности раствора воспользуемся уравнением Гиббса:
Г = -
В уравнении Гиббса величина С2 означает молярную концентрацию кислоты, С1 = 0 (чистая вода). 2. Считая, что плотность разбавленного раствора кислоты около 1 г/мл (т.е. такая же, как и воды), используя ω% кислоты, находим, что в 100 мл раствора содержится 0,005 г кислоты. Молярная масса кислоты равна 158 г/моль, поэтому молярная концентрация раствора будет:
СМ =
3. В уравнение Гиббса подставляем необходимые данные:
Г = -
Ответ: 7,3 ∙ 10-6 моль/м2
3адача № 3 Экспериментально установлено, что максимальная величина адсорбции ПАВ (М = 60 гмоль) некоторым адсорбентом составляет 5,0 ∙ 103
Поиск по сайту: |
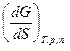
 ). Экспериментально показано, что этот коэффициент не очень сильно меняется при изменении объёма капель даже в 1000 раз. Для капель, сравнительно мало отличающихся по объёму, этот коэффициент можно считать одинаковым. Так как в момент отрыва F = Р (F- силы межмолекулярного взаимодействия данной конкретной жидкости) то, определив вес образующейся капли Р, можно вычислить поверхностное натяжение жидкости σ.
). Экспериментально показано, что этот коэффициент не очень сильно меняется при изменении объёма капель даже в 1000 раз. Для капель, сравнительно мало отличающихся по объёму, этот коэффициент можно считать одинаковым. Так как в момент отрыва F = Р (F- силы межмолекулярного взаимодействия данной конкретной жидкости) то, определив вес образующейся капли Р, можно вычислить поверхностное натяжение жидкости σ.

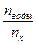

 , называемая поверхностной активностью. Единица измерения поверхностной активности названа в честь Дж. Гиббса: 1 гиббс = 10-6 Дж ∙ м / моль.
, называемая поверхностной активностью. Единица измерения поверхностной активности названа в честь Дж. Гиббса: 1 гиббс = 10-6 Дж ∙ м / моль.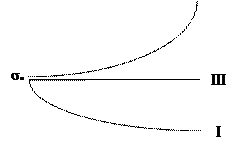

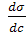 = 0. На графике σ0 – поверхностное натяжение воды. Отметим, что для ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение σ под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю.
= 0. На графике σ0 – поверхностное натяжение воды. Отметим, что для ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение σ под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю.
 – поверхностная активность.
– поверхностная активность.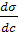 < 0, то Г > 0, т.е. адсорбция положительна (вещество накапливается на поверхности раздела фаз), это характерно для ПАВ. Если же
< 0, то Г > 0, т.е. адсорбция положительна (вещество накапливается на поверхности раздела фаз), это характерно для ПАВ. Если же 




























 (моль/г),
(моль/г),





 (∆ε – разность между теплотой адсорбции газа в первом слое и теплотой сжижения газа).
(∆ε – разность между теплотой адсорбции газа в первом слое и теплотой сжижения газа). моль/г,
моль/г, Cl ‾ ‹ Br ‾ ‹ NO3 ‾ ‹ I ‾ ‹ NCS ‾
Cl ‾ ‹ Br ‾ ‹ NO3 ‾ ‹ I ‾ ‹ NCS ‾ Усиление адсорбции
Усиление адсорбции

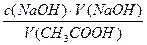
 (моль/г)
(моль/г)
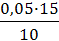 = 0,075 моль/л
= 0,075 моль/л =
= 
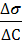 ∙
∙  = -
= - 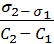 ∙
∙  =
= 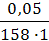 = 3,16 ∙ 10 -4 моль/л.
= 3,16 ∙ 10 -4 моль/л.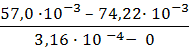 ∙
∙  = 7,3 ∙ 10-6 моль/м2
= 7,3 ∙ 10-6 моль/м2