|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Механизм диссоциации электролитов, которые состоят из полярных молекул
Теория электролитической Диссоциации. Ионные уравнения реакций. Теория электролитической диссоциации. Электролитами называются вещества, распадающиеся в растворах или расплавах на ионы и вследствие этого проводят электрический ток. К электролитам относят соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные связи. Неэлектролиты – кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи. Распад электролитов в растворе или расплаве на ионы называется электролитической диссоциацией. Основные положения теории электролитической диссоциации. (С.Аррениус) 1. Электролиты в воде диссоциируют на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). 2. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Положительные ионы называются катионы, отрицательные – анионы. 3. Диссоциация – процесс обратимый. Т.е. одновременно идут два противоположных процесса: распад молекул на ионы (диссоциация) и соединение ионов в молекулы (ассоциация). Диссоциация электролитов с ионной и полярной связью протекает различно.
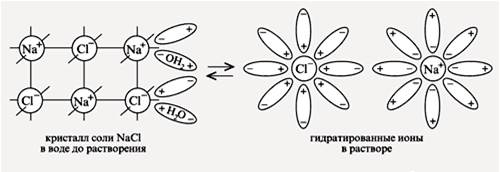
Механизм диссоциации электролитов с ионной связью. При растворении в воде ионных соединений, например хлорида натрия NaCl, дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов.
При этом положительные полюсы молекул воды притягиваются к хлорид-ионам (Cl-), отрицательные полюсы – к положительным ионам Na+. В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т.е. являются гидратированными ионами. Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи.
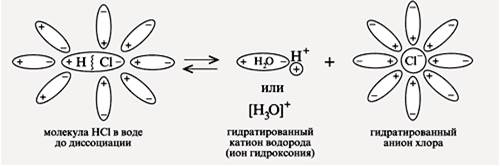
Механизм диссоциации электролитов, которые состоят из полярных молекул. При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Под влиянием этого взаимодействия изменяется характер связи в молекуле НСl: сначала связь становится более полярной, а затем переходит в ионную связь. В результате образуются гидратированные ионы.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов.
Степень диссоциации. В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остаётся в растворе в недиссоциированном виде.
Поиск по сайту: |