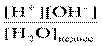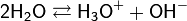|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Диссоциация воды. Водородный показатель рНСтр 1 из 2Следующая ⇒
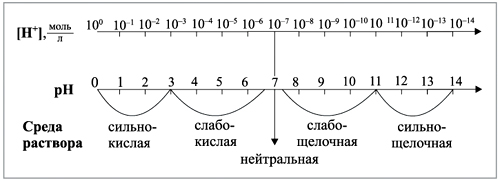
Н2 НDО + + ОН- Кд,с= Поскольку степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул можно принять равной молярной концентрации жидкой воды. Поэтому при Т=const [H+[OH×]-] = Kд,с[H2O] =const. Произведение концентраций ионов [H+] и [ОН-] называется ионным произведением воды и является постоянной величиной при неизменной температуре и при 298К составляет: [H+[ОН×]-] = K(H2O) = KВ = Kw = 10–14 . (5) Ионное произведение воды Кw увеличивается с ростом температуры, так как диссоциация воды –эндотермический процесс. (KW(100010×C) = 6-13) Для указания концентрации ионов водорода в растворе используют так называемый водородный показатель: pH = –lg[H+], (6) -а для обозначения концентрации гидроксид-ионов гидроксидный показатель: pOH = –lg[ОН-] . (7) При температуре 298 К рН + рОН = 14, (8) поэтому в чистой воде [H+] = [ОН-10×] = 1–7 моль/л, следовательно, рН = рОН = 7; в кислотной среде [H+] > [ОН-], следовательно, рН < 7, а рОН > 7; в щелочных растворах [H+] < [ОН-], поэтому рН > 7, а рОН < 7. В случае растворов сильных электролитов вместо концентрации пользуются активностью. Поэтому при необходимости более точных расчетов в таких растворах следует вычислять не рН, а ра(Н+): ра(Н+) = –lga(H+) = рН – lg g (Н+).
Вывод значения ионного произведения воды[править | править исходный текст] Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
где: · [H+] — концентрация ионов гидроксония (протонов); · [OH−] — концентрация гидроксид-ионов; · [H2O] — концентрация воды (в молекулярной форме) в воде; Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л. При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C). Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды. Чистая вода ведет себя как амфолит Водород – газ без цвета и запаха, не растворяется в воде, образует с воздухом взрывоопасные смеси. Существуют три разновидности водорода: протий, дейтерий и тритий, различающиеся по числу нейтронов. Получают водород при электролизе воды, в качестве побочных продуктов при переработке нефти. § Биологическая роль водорода Роль водорода в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна ~ 52%). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях практически весь водород на Земле находится в виде соединений. Лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объему). Содержание водорода в организме взрослого человека составляет около 10% (7 кг на 70 кг массы тела). Основная функция водорода – структурирование биологического пространства (вода и водородные связи) и формирование разнообразия органических (биологических) молекул. Водород способен реагировать с электронположительными и электронотрицительными атомами, активно взаимодействовать со многими элементами, проявляя при этом как окислительные, так и восстановительные свойства. В реакциях со щелочными и щелочноземельными металлами водород выступает в качестве окислителя, а по отношению к кислороду, сере, галогенам проявляет восстановительные свойства.
Поиск по сайту: |