 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Термодинаміка адсорбції
Загальні уявлення про адсорбцію 1. Загальні положення про адсорбцію 2. Кількісні характеристики адсорбції 3. Термодинаміка адсорбції 4. Класифікація адсорбційних процесів
1. Загальні положення про адсорбцію Процеси поглинання газів або розчинених речовин твердими речовинами або рідинами називаються сорбцією (Мак-Бен). Речовини, що поглинають, називаються сорбентами, речовини, що поглинаються – сорбтивами, поглинена речовина − сорбатом. Процес, зворотний сорбції, називають десорбцією. Сорбенти можуть бути твердими (активоване вугілля, силікагель), рідкими (вода, краплі емульсії), газовими − пухирьки піни. Існують два основних типи сорбційних процесів: абсорбція та адсорбція. Абсорбцією називається поглинання газів або рідини всім об’ємом сорбента − рідиною (рідко − твердою речовиною). Прикладом абсорбції є процеси поглинання СО2 та NH3 водою, H2 − пористою платиною). Адсорбцією називається самовільний процес концентрування на твердій або рідкій поверхні розділу фаз речовини з меншим поверхневим натягом, концентрація якої в поверхневому шарі збільшується в порівнянні з кількостю в об’ємі фази. Адсорбція зустрічається найчастіше, тому далі будуть розглядатися адсорбційні процеси. Більш щільна фаза (визначає форму поверхні) називається адсорбентом, речовина, молекули якої сорбуються – адсорбтивом,адсорбована речовина – адсорбатом. Кількісні характеристики адсорбції Для кількісної характеристики адсорбції викристовують величину надлишкової чи гіббсової адсорбції (Г). Гіббсова адсорбція −це різниця (надмір або недостача) кількості (у молях) адсорбуємої речовини nпов− nоб на одиниці площі поверхневого шару S в порівнянні з її кількістю в об’ємі фази. Г = Якщо виміряти площу поверхні розділу важко, використовується питома адсорбція a – кількість, об’єм або маса адсорбованої речовини (адсорбату) в одиниці маси адсорбенту m. aі = Гіббсова адсорбція та питома адсорбція за змістом не співпадають. Гіббсова адсорбція означає надлишок поверхневої концентрації в порівнянні з концентрацією в обۥємі, а абсолютна − саме концентрацію адсорбованої речовини.
Термодинаміка адсорбції Адсорбція – самовільний процес, який протікає при Р = const зі зниженням енергії Гіббса, а при V = const −зі зниженням енергії Гельмгольца. При переході речовини з газової чи рідкої фази на поверхню зменшується рухливість адсорбованих молекул, тому ентропія теж зменшується (DS < 0). Оскільки при адсорбції DG < 0, DS < 0, то DН < 0 (за основним рівнянням термодинаміки (DН = DG + TDS), тому адсорбція – процес завжди екзотермічний. Мірою інтенсивності адсорбційних сил, тобто сил взаємодії молекул адсорбата з поверхнею адсорбента та між собою є теплота адсорбції. Теплоту адсорбції обчислюють за рівнянням: Q = Приклад 1. 10 мл СО2 (н. у.) адсорбується активованим вугіллям при 303 К під тиском 79980 Па і при 273 К під тиском 23061Па. Визначити теплоту, що виділилася під час цього процесу. Розв'язання: 1. QМ − ? Q = 2. . Qпроц − ? n = V/VM = 0,01:22,4 = 4,5·10─4 моль. Qпроц = QМ ·n = 28,5 ·4,5·10─4 = 128,3·10─4 кДж. Відповідь: Qпроц = 128,3·10─4 кДж. Розрізняють інтегральну та диференційну теплоти адсорбції. Інтегральною теплотою адсорбції Q називається повна кількість теплоти, що виділяється при адсорбції n молей адсорбата на одиниці маси адсорбента (Дж/кг адсорбента). Інтегральна теплота адсорбції не пропорційна кількості адсорбованої речовини тому, що на початку процесу адсорбція відбувається на найбільш активних центрах з максимальним тепловим ефектом, а в кінці процесу – протікає на найменш активних центрах, при цьому виділяється незначна кількість тепла. Диференціальною теплотою адсорбції q називають додаткову кількість теплоти dQ, що виділилась при додатковій адсорбції одного моля адсорбата, (Дж/моль адсорбата), тобто
Диференціальна теплота залежить від кількості адсорбованої речовини. Вона зменшується при подальшому протіканні процесу внаслідок того, що молекули адсорбата в міру насичення найбільш активних центрів адсорбуються все менш активними ділянками.
Поиск по сайту: |
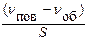 ,
, моль/кг , aі =
моль/кг , aі = 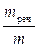 кг/кг.
кг/кг.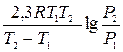 .
.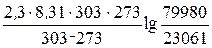 = 28,5 кДж/моль.
= 28,5 кДж/моль. .
.