|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Строение молекул. Происхождение молекулярных спектров
Рис.1.3. Энергетические переходы в атоме
При переходе системы из состояния с энергией Е2 в Е1, происходит уменьшение энергии на величину Е2 - Е1, которая, согласно закону сохранения энергии, выделится в виде излучения света. Частота электромагнитного излучения определяется отношением DЕ = Е2 - Е1. При переходе Е1 ® Е2 система поглощает свет с частотой n. Атом – дискретная частица вещества размером ~ 10-8 см, состоящая из положительно заряженного ядра радиусом ~ 10-12 см и движущихся вокруг него отрицательно заряженных электронов. Скорость электрона столь велика, что в атоме доминируют его волновые свойства. Длина волны движущегося электрона (~ 10-8см) соизмерима атомными размерами, поэтому электрон нельзя представить в виде дискретного объекта, как это делается в классической физике, например при движении электронов в газоразрядной трубке. Электрон как бы размазан по атому в виде волны, и можно говорить лишь о вероятности его пребывания в какой-то точке внутри атома или о распределении плотности отрицательного заряда вокруг ядра, которое может быть достаточно сложным. Области с максимальной плотностью заряда называют электронными орбиталями или энергетическими уровнями, поскольку каждая орбиталь характеризуется определенной энергией. Энергетическое состояние всего атома определяется в основном энергией электронных орбиталей. Каждый электрон и атом, а следовательно, энергетический уровень описывают набором четырех квантовых чисел: главного, побочного, магнитного и спинового. Главное квантовое число n характеризует удаленность электрона от ядра и принимает значения 1, 2, 3 … . Чем больше n, тем дальше от ядра находится электронная орбита ль. Побочное квантовое число l определяет форму орбитали и принимает значения 0, 1, 2, 3 …, которые обозначаются s, p, d, f … Движущийся электрон обладает моментом количества движения. При l = 0 момент количества движения равен нулю и электрический заряд размазан по сфере, при l = 1 орбиталь имеет форму гантели. Магнитное квантовое число m характеризует расположение орбитали в пространстве и принимает значения от – l до l. При l = 0 магнитное квантовое число равно нулю, при l = 1 оно принимает значения –1, 0, +1 и орбитали, имеющие форму гантели, располагаются вдоль осей прямоугольной системы координат. Спиновое квантовое число ms, равное –1/2 и +1/2, отражает собственный момент импульса электрона. По принципу Паули в атоме не может быть двух электронов с одинаковым набором квантовых чисел. В противном случае силы отталкивания “вытолкнули” бы один из них на другую орбиталь. Поэтому многоэлектронный атом имеет сложную структуру: электроны с одинаковыми главными квантовыми числами образуют электронные слои – оболочки (уровни), обозначаемые буквами K, L, M, … для n = 1, 2, 3, … соответственно, а электроны с одинаковыми побочными квантовыми числами – подоболочки (подуровни) в пределах одной оболочки. Энергия атомных орбиталей сильно различается. Так для возбуждения электрона с ближайшей к ядру орбитали (n = 1) требуется более 6·104 кДж/моль (регистрируемые фотоны имеют частоту рентгеновского излучения), а для возбуждения внешних электронов достаточно 150-600 кДж/моль (излучение УФ- и видимой областей). С увеличением главного квантового числа энергия возбуждения DЕ и частота излучения уменьшаются (рис.1.4).
Рис.1.4. Относительное расположение энергетических уровней различных квантовых состояний и изменение энергии при электронных переходах.
Наиболее вероятны переходы с первого возбужденного уровня на основной Е0; соответствующие им спектральные линии называют резонансными. Электрон может перейти в более высокое энергетическое состояние (Е2, Е3, … и т.д.). Возвращение его на уровень Е0 может проходить через ряд промежуточных ступеней. Внешние, легко возбудимые электроны называют оптическими, переходы с их участием дают оптический спектр. Энергия возбуждения внешних электронов разных элементов неодинакова. Например, для получения резонансной линии щелочных металлов (переход Е1 ® Е0) требуется сравнительно невысокая энергия (~ 2 эВ, длины волн лежат в видимой области), для неметаллов эта энергия существенно больше (~5 эВ, длины волн лежат в УФ- области). Чем больше внешних электронов, тем больше возможностей имеет атом для энергетических переходов, поэтому спектры металлов типа железа состоят из тысяч линий, а спектры щелочных элементов бедны ими. Не все оптические переходы равновесны. Совпадение энергии перехода электрона и энергии поглощаемого фотона – основное, но не единственное условие изменения энергетического состояния атома. Переходы, вероятность которых велика называют разрешенными, а вероятность которых мала – запрещенными. Вероятность энергетических изменений диктуется правилами отбора, основанными на квантово-механических представлениях. Запрещен переход более чем одного электрона, а также переход с изменением спина и изменением побочного квантового числа более чем на единицу (т.е. разрешены переходы с s- на p-орбиталь или с р- на d-орбиталь и т.п., но не с s- на d- или с p- на f-орбиталь. Испускание – самопроизвольный процес, т.к. атом всегда стремится перейти из нестабильного возбужденного состояния в более стабильное состояние с меньшей энергией. Напротив, поглощение – вынужденный процесс, увеличивающий энергию атома за счет поглощаемого фотона. Если сообщить атому высокую энергию (103-105 эВ), например, облучить вещество потоком быстрых электронов или рентгеновским излучением, то возможно возбуждение внутреннего электрона и даже удаление его с орбиталей K, L и т.д. В этом случае на освободившееся место может перейти электрон с более отдаленной орбитали (например, с L-орбитали на К-орбиталь, с М-орбитали на L-орбиталь, с М-орбитали на К-орбиталь). При этом испускается квант рентгеновского излучения. Все перечисленные переходы могут быть использованы в аналитических целях. Методы анализа, основанные на изменениях энергетического состояния атомов веществ входят в группу атомноспектроскопических методов, различающихся по способу получения и регистрации сигнала. Оптические методы используют энергетические переходы внешних (валентных) электронов, общим для них является необходимость предварительной атомизации вещества. Атомно- эмиссионная спектроскопия основана на испускании излучения атомами, возбужденными кинетической энергией плазмы, дугового или искрового разряда. Атомно-флуоресцентная спектроскопия использует испускание излучения атомами, возбужденными электромагнитным излучением от внешнего источника. Атомно-абсорбционная спектроскопия основана на поглощении атомами излучения от внешнего источника. Рентгеновские методы основаны на энергетических переходах внутренних электронов атомов. В зависимости от способа получения и регистрации сигнала различают рентгеноэмиссионную, рентгеноабсорбционную и рентгенофлуоресцентную спектроскопию. Разновидности этих методов – оже-спектроскопию, рентгеновский электро-зондовый анализ, электронную спектроскопию – используют в основном для исследования строения веществ. Рентгеновские методы не требуют атомизации вещества и позволяют исследовать твердые пробы без предварительной подготовки. Ядерные методы основаны на возбуждении ядер атомов.
Строение молекул. Происхождение молекулярных спектров Молекулы состоят из двух или более атомов, соединенных между собой в определенном порядке химическими связями, образующимися при взаимодействии внешних электронов. При этом атомы сближаются, но так, что их завершенные оболочки не соприкасаются. Энергетическое строение молекулы сложнее, чем у атома. На рисунке представлена схема энергетических уровней молекулы. В основе этой схемы лежит приближение, согласно которому полная энергия молекулы (Е) может быть представлена в виде суммы энергий ее электронного, колебательного и вращательного движения: Е = Еэл + Екол + Евр Энергия каждого из этих видов движения подчиняется своим законам квантования, определяющим взаимное расположение энергетических уровней. Каждый из этих видов движения возбуждается электромагнитным излучением соответствующей частоты: колебания электронов – частотой ~ 1014 ¸1017 Гц; колебания ядер – частотой ~ 1012 ¸1014 Гц; вращение молекулы как целого – частотой ~ 1012 Гц и ниже. Такое различие основано на различии скоростей движения. Так скорость движения электронов значительно больше скорости колебательного движения и соответствует энергии 1¸10 эВ; энергия колебаний – 0,1¸1 эВ; энергия вращения менее 0,1 эВ. Нужно отметить, что везде рассматривается энергия электронов внешних оболочек атомов. Именно эти электроны обусловливают физические свойства и строение молекул, а энергетические переходы проявляются в оптической области спектра. Переходы системы с одного энергетического уровня на другой сопровождаются либо увеличением, либо уменьшением энергии. Они подразделяются на радиационные и нерадиационные; первые происходят с поглощением или испусканием квантов электромагнитного излучения, а вторые обусловлены безизлучательными процессами. В общем случае энергия радиационного перехода определяется изменением электронной, колебательной и вращательной составляющих полной энергии молекулы: hnij = Ej – Ei = DEijэл + DEijкол + DEijвр = hnij Частоты переходов По величине поглощаемых и излучаемых квантов выделяют ультрафиолетовую (УФ), видимую и инфракрасную (ИК) области спектра. УФ-область охватывает интервал длин волн от 100нм до 400нм и подразделяется на далекую или вакуумную (100-200нм); среднюю (2200-300нм) и близкую (300-400нм). Видимая область 400-750нм. Наконец ИК-область от 0,75 до 300 мкм делится на близкую (0,75-2,5мкм), среднюю (2,5-15мкм) и далекую (15-300мкм). Такое разделение состветствует особенностям применяемых оптических материалов, источников и приемников излучения. Также как и атом, молекула может существовать только в определенных энергетических состояниях. Каждому электронному состоянию отвечают колебательные уровни, а каждому колебательному – вращательные (рис. ). Любой уровень помимо главного, побочного, магнитного и спинового, характеризуется колебательным и вращательным квантовыми числами. У молекул, так и у атомов наиболее возбудимыми являются внешние (оптические) электроны. Энергия их возбуждения примерно такая же, как и в атомах (150-600 кДж/моль), что соответствует излучению в видимой и ультрафиолетовой частях спектра. Переходы между колебательными уровнями в пределах одного электронного состояния отвечают энергиям 0,4-150 кДж/моль (излучение ИК-области), переходы между вращательными уровнями 0,01-0,4 кДж/моль (излучение далекой ИК- и микроволновой областей).
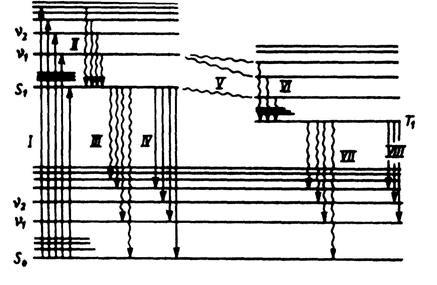
Рис.1.5.Энергетические переходы в молекуле.
Число энергетических состояний молекулы велико и энергии отдельных переходов бывают настолько близки, что различить их невозможно. Поэтому в молекулярных спектрах спектральные линии с близкими частотами сливаются в одну полосу поглощения. Возвращение молекулы из возбужденного состояния в основное протекает сложнее, чем у атома. Сначала за короткое время (~ 10-13 с) молекула переходит на основной уровень возбужденого состояния S1 (см. процесс II на рис.1.5). Избыточная энергия при этом выделяется в виде теплоты. Далее процесс может пойти по одному из трех путей: 1) безызлучательный переход с выделением теплоты при столкновении молекул с другими частицами (процесс III ); 2) переход на один из колебательных уровней невозбужденного состояния S0 с испусканием фотона (процесс IV, флуоресценция); 3) переход на триплетный возбужденный уровень Т1 (процесс V), с которого возможен переход в состояние S0 с выделением теплоты (процесс VII) или фотона (процесс VIII, фосфоресценция). Процессы флуоресценции и фосфоресценции объединяют под общим названием люминесценция. По происхождению аналитического сигнала выделяют несколько молекулярно-спектроскопических методов. Абсорбционная молекулярная спектроскопия основана на энергетических переходах валентных электронов, сигналы от которых проявляются в видимой и УФ-областях. Аналитические методы, построенные на поглощении молекулами видимого и УФ-излучений, называют спектрофотометрическими и фотометрическими (иногда методы, в которых используют поглощение видимого света, называют колориметрическими, от латинского color – цвет). Инфракрасная спектроскопия основана на колебательных переходах, сигналы от которых проявляются в ИК-области. ИК-спектроскопия – одно из самых эффективных средств исследования строения молекул и идентификации соединений. Комбинационное рассеяние света. Этот метод, изучающий колебательное движение молекул по рассеянию света в видимой области, дополняет инфракрасные спектры поглощения, позволяя полнее характеризовать колебательные движения в молекуле. Люминесцентная спектроскопия базируется на испускании излучения после возбуждения молекул светом. Если энергетический переход происходит без изменения спина электрона, метод называют флуоресцентной спектроскопией, если с изменением – фосфоресцентной спектроскопией. Магнитная резонансная спектроскопия основана на получении сигналов от молекул, помещенных в магнитное поле. Фотоакустическая спектроскопия создана на измерении теплоты, выделяемой при безизлучательных переходах. Рентгеновская спектроскопия основана на возбуждении внутренних электронов молекул. В таблице 1.1 приведены виды спектроскопии, используемые в аналитической химии.
Поиск по сайту: |

 между этими уровнями лежат преимущественно в оптической области шкалы электромагнитных волн (рис. ). Совокупность радиационных переходов с нижележащих энергетических уровней молекулы на вышележащие, в частности с основного (самый нижний) на возбужденные (все остальные), образует спектр поглощения, а совокупность переходов с вышележащих на нижележащие – спектр испускания.
между этими уровнями лежат преимущественно в оптической области шкалы электромагнитных волн (рис. ). Совокупность радиационных переходов с нижележащих энергетических уровней молекулы на вышележащие, в частности с основного (самый нижний) на возбужденные (все остальные), образует спектр поглощения, а совокупность переходов с вышележащих на нижележащие – спектр испускания.