 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Реакция нулевого порядка
Это реакции, скорость которых не зависит от концентрации реагирующих веществ. Основной закон химической кинетики для реакции нулевого порядка записывается:
Разделим переменные и проинтегрируем в
где i – константа интегрирования. Если τ = 0, то
С учетом этого решим уравнение относительно k:
Зная константу скорости реакции, можно рассчитать концентрацию реагирующих веществ в любой момент времени:
Для характеристики скорости реакции применяется понятие времени полупревращения или полураспада τ1/2. Это есть время, за которое прореагирует половина взятого количества вещества. С учетом того, что
Время полупревращения реакции нулевого порядка прямо пропорционально концентрации исходного вещества. Реакция 1 порядка: А ® В. Пусть объем реакционной смеси равен V. Пусть в начальный момент времени τ = 0 в реакционной смеси содержится а моль вещества А и 0 моль вещества В. В момент времени τ в реакционной смеси а – х моль вещества А и х моль вещества В. Уравнение скорости химической реакции 1 порядка имеет вид
Концентрация вещества А равна
тогда
Подставим в уравнение и разделим переменные:
Из последнего уравнения следует, что скорость реакции 1 порядка не зависит от объема реакционной смеси. Проинтегрировав, получим
где i – константа интегрирования. При τ = 0 – х = 0, тогда
С учетом этого решим уравнение относительно k:
Разделив числитель и знаменатель на V, получим
Решим уравнение относительно
Время полупревращения реакции 1 порядка равно
Как видно, время полупревращения реакции 1 порядка не зависит от концентрации исходного вещества и обратно пропорционально константе скорости реакции. Реакция 2 порядка: A + B ® C + D. Пусть в объеме реакционной смеси V в начальный момент времени Запишем уравнение для скорости реакции
Текущие концентрации реагирующих веществ:
Производная от
тогда
Скорость реакции 2 порядка обратно пропорциональна объему реакционной смеси. Преобразуем уравнение:
Проинтегрируем в неопределенных пределах
При τ = 0 – х = 0, тогда
Подставим значение константы интегрирования и решим уравнение относительно k:
Поделим на V числитель и знаменатель правой части уравнения, а дробь, стоящую под знаком логарифма на V2, получим
где Полученное уравнение неприменимо для случая, когда
После интегрирования получим
При τ = 0 – х = 0, тогда
Подставим и решим уравнение относительно k:
Поделим на V2:
Текущую концентрацию вещества А можно рассчитать по формуле:
Время полупревращения вещества для реакции 2 порядка при a = b рассчитывается по уравнению:
Поиск по сайту: |

 ,
, ,
, – начальная концентрация вещества А в момент времени
– начальная концентрация вещества А в момент времени 
 .
.
 получим
получим
 .
. ,
, .
. ,
, .
. ,
,
 .
. ,
, :
: .
. .
.
 .
. .
. (*);
(*);
 .
.

 ,
,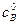 – исходная концентрация вещества В.
– исходная концентрация вещества В. . Рассмотрим этот случай. Если a = b, то уравнение (*) запишется в виде:
. Рассмотрим этот случай. Если a = b, то уравнение (*) запишется в виде:

 .
. .
. .
. .
. .
.