|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Теория мономолекулярных реакций
Как отмечалось в 1.1, в мономолекулярных реакциях одно вещество превращается со скоростью, пропорциональной концентрации реагента. Такие реакции довольно распространены как в органической химии, так и в процессах нефтепереработки: это всевозможные перегруппировки молекул, диссоциация, дегидрирование, изомеризация, крекинг и вообще элиминирование любых групп из молекул. Для таких реакций существует теоретическая проблема, как согласовать наблюдаемый первый порядок по реагенту с постулатами и теорией химической кинетики, рассматривающими соударения двух реагирующих частиц. Линдеман (1922) предложил кинетическую модель, разрешающую эти противоречия. Эта модель включает в себя три стадии: на первой происходит активация реагента А с любой частицей М, участвующей в обмене энергии, в том числе и с другой молекулой реагента. В результате первой стадии образуется частица А*, обладающая достаточной энергией для преодоления активационного барьера, Еа. Образовавшаяся частица А* может дезактивироваться с образованием А на второй стадии или с образованием продукта D:
Линдеман предположил, что дезактивация по стадии 2, не требующая разрыва связей, протекает существенно быстрее, чем на стадии 3, с образованием продукта с другими связями, т.е k2 >> k1 и k3. В этом случае применимо квазистационарное приближение d[A*]/dt = 0, откуда найдем
и получим следующее кинетическое уравнение для схемы R10:
Из анализа этого уравнения следует, что при kCM >> k3 будет наблюдаться первый порядок по реагенту, r = k1k3CA/k2. С другой стороны, при k2CM << k3, r = k1k3CACM, и если отсутствуют примеси (т.е. М = А), то с уменьшением давления, порядок по реагенту будет близок к первому. Модель Линдемана на качественном уровне объяснила указанные выше противоречия. Однако на количественном уровне эта модель оказалась несостоятельной: давления перехода от второго порядка и первому, по Линдеману, существенно отличались от экспериментальных значений. Поэтому эта модель была усовершенствована в рамках неравновесной кинетики, учитывающей различную вероятность передачи энергии на колебательные и вращательные степени свободы при соударении частиц, а также зависимость дезактивации возбужденной частицы от ее энергии, а не от Еа (т.е. 2й и 3й постулаты кинетики для возбужденных частиц не выполняются). Однако рассмотрение уточненной модели, развитой в работах Хиншельвуда, Райса, Маркуса и др., выходит за рамки рассматриваемого курса равновесной (в максвелл-больцмановском смысле) кинетики. До сих пор мы рассматривали обычный путь термической активации молекул реагентов при их соударении. Однако во многих процессах, инициируемых различными видами излучения (от УФ до g-квантов) или специальными добавками, принимают участие возбужденные частицы, радикалы, атомы и др. Эти частицы обладают избыточной энергией, обычно достаточной для преодоления энергетического барьера реакции. Кинетика таких процессов рассмотрена в следующем разделе. 4. Цепные и фотохимические реакции 4. 1 Понятия и определения Имеется класс специфических реакций, протекающих в газовой (а также в жидкой фазах) через образование высокоэнергетических возбужденных частиц, радикалов, атомов и др. Здесь термин высокоэнергетический означает, что энергия частиц (Е) больше энергии активации, Еа. Далее эти активные частицы быстро взаимодействуют с исходными реагентами, с образованием продуктов и регенерацией активных частиц. Таким образом, в результате зарождения малого числа активных частиц превращается большое число молекул реагентов. Такой циклический процесс называется цепным, причем повторяющаяся группа реакций называется цепью. Такие процессы впервые были обнаружены Боденштейном (1913), а их интерпретация предложена Нернстом (1916). В последующем было показано, что по цепному механизму протекают многие процессы, такие как окисление углеводородов и других субстратов, крекинг и пиролиз, полимеризация олефинов, галогенирование и т.п. В цепном процессе выделяют этапы: 1) Зарождение (инициирование) цепи с образованием активных частиц (АЧ). 2) Развитие (продолжение) цепи, характеризуемое длиной цепи, lц, которая представляет собой число молекул реагента, прореагировавших на одну активную частицу, образовавшуюся на этапе зарождения цепи. 3) Обрыв цепи в результате процессов дезактивации/гибели активных частиц, например, на стенке (при малых давлениях) или при тройных соударениях с молекулами реагентов или примесей. Здесь материал стенки или третья частица играют роль «приемника» избыточной энергии, выделяющейся при ассоциации атомов и/или радикалов. За счет передачи этой энергии возможна стабилизация образующихся молекул (Н2 или С12). Кроме указанных реакций, обрыв цепи может происходить за счет взаимодействия активных частиц с добавками (ингибиторами), при котором образуются относительно стабильные радикалы (например, типа стерически затрудненных фенолов или аминов). Проиллюстрируем эти этапы на примере реакции Н2 + С12= 2НС1: 1) 2а) 2б) 3а) 3б) где М – материал стенки. Основными признаками наличия цепного процесса являются: · существенное увеличение скорости развитого процесса (r) по сравнению с начальной скоростью (ri); отношение r/ri равно средней длине lц. · образование нескольких молекул продукта на 1 молекулу инициатора или на 1 квант инициирующего излучения, · зависимость скорости реакции от материала стенки реактора и отношения поверхности к объему реакционного пространства, · сильная зависимость скорости реакции от концентрации добавок ингибиторов. Наиболее трудным этапом цепного процесса обычно является инициирование. Этому этапу соответствует индукционный период наблюдаемой кинетической кривой. Цепной процесс может быть инициирован соответствующим излучением или веществами-инициаторами, например, из класса пероксидов, диазосоединений и т.п. По мере увеличения концентрации активных частиц (в рассмотренном примере радикалов H· и Cl·) скорость реакции существенно возрастает до стационарного значения (в случае неразветвленной цепи) или до выгорания/взрыва (в случае разветвленной цепи) реакционной смеси. На заключительном этапе реакции, когда процессы обрыва АЧ преобладают над инициированием цепи, скорость реакции убывает во времени (рис. 17).
Различают неразветвленные и разветвленные цепные реакции. Процесс называется неразветвленным, когда на этапе продолжения цепи превращение одной активной частицы приводит к образованию одной новой АЧ. Если при этом образуется больше одной новой активной частицы, такой цепной процесс называется разветвленным. Рассмотрим кинетику реакций с неразветвленными и разветвленными цепями. Обозначим концентрацию активных частиц «n». Очевидно, что в случае неразветвленной цепной реакции изменения концентрация АЧ изменяется только за счет протекания реакций 1 и 3. Тогда можно выразить скорость изменения концентрации активных частиц (n), определяющую скорость реакции, как: dn/dt = ri – ktn (4.1) или если преобладает обрыв цепи в объеме (при повышенных давлениях) dn/dt = ri – ktn2 (4.2) где ri – скорость инициирования. Обычно для протекания реакции обрыва не требуется активация (Еt ~ 0) и kt >> ki, поэтому достаточно быстро устанавливается стационарная концентрация активных частиц, определяемая из условия dn/dt = 0 в уравнении (4.1) или (4.2). На основе рассмотренной феноменологической картины можно описать в стационарном приближении кинетику неразветвленной цепной реакции. Проиллюстрируем это на примере цепной реакции разложения ацетальдегида с образованием метана и монооксида углерода в качестве основных продуктов (также образуется несколько процентов водорода и этана): СН3СНО à СН4 + СО (4.R1) для которой наблюдается полуторный порядок реакции по ацетальдегиду. На основании экспериментальных данных можно предложить следующую схему протекания реакции (11): (1) (2) (3) (4) Взаимодействием радикалов СН3· + СН3С·=О и СН3С·=О + СН3С·=О пренебрегаем ввиду отсутствия в продуктах ацетона и диацетила. Далее запишем условия стационарности для обоих радикалов, участвующих в продолжении цепи (радикал НС·=О обладает низкой активностью): d[CН3·]/dt = kiCA - k2CA[CН3·] + k3[СН3С·=О]- kt[СН3·]2 = 0 (4.3) d[СН3С·=О]/dt = k2CA[CН3·] - k3[СН3С·=О] = 0 (4.4) Объединяя (4.3) и (4.4), получим kiCA = kt[СН3·]2 , откуда [СН3·] = (kiCA/kt)0,5 (4.5) Скорость реакции определим по образованию метана (стадия 2) d[CН4]/dt = k2CA[CН3·] (4.6) или с учетом (4.5) окончательно получим теоретическое кинетическое уравнение d[CН4]/dt = k2(ki/kt)0,5CA1,5, (4.7) которое в совокупности со схемой правильно отражает наблюдаемые закономерности. Особенностью разветвленных цепных реакций является возможность быстрого самоускорения, т.е. нестационарного режима. В качестве примера разветвленной цепной реакции можно привести взаимодействие водорода с кислородом: 1) Н2 + О2 à 2OH· 2) OH· + Н2 àH2О + H· 3) H· + О2 àOH· + ·O· 4) ·O· + Н2 àOH· + H· Рассмотрим переход от стационарного к нестационарному режиму в случае линейного обрыва dn/dt = ri – gn и n = (ri/g)(1- exp(-gt)) (4.8) где g – фактор обрыва АЧ (например, на стенке g = kt) Увеличение концентрации (n) со временем будет замедляться и в стационарном режиме nст = (ri/g). При наличии разветвления (фактор b), т.е. образования АЧ в процессе продолжения цепи, вероятность гибели АЧ, очевидно, снизится, а стационарная концентрация АЧ и скорость процесса увеличится dn/dt = ri – (g - b)n и n = (ri/g).(exp(gt) - 1) (4.9) где g = b – g. Видно, что при g£ 0 режим будет стационарным, однако при g > 0 концентрация АЧ непрерывно возрастает и скорость процесса будет ускоряться, вплоть до воспламенения (взрыва). 4.3 Механизмы воспламенения (взрыва) Взрыв – это процесс быстрого выделения энергии в ограниченном пространстве с образованием ударной волны. Различают цепной и тепловой взрывы. Цепной взрыв (или воспламенение) происходит при протекании разветвленной цепной реакции. В этом случае наблюдается т.н. «полуостров воспламенения» с верхним и нижним пределами воспламенения, положение которых зависит от температуры, давления (концентрации), геометрии и материала реакционной зоны и наличия в ней примесей (рис. 19). Например, при НТД в смеси водорода с кислородом нижний предел соответствует около 6 об.% О2 и верхний предел – приблизительно 95 об.% О2.
Качественно наличие полуострова воспламенения объясняется следующим образом. При малых давлениях, ниже Р1-2, акты обрыва цепей преобладают над разветвлением, и воспламенение невозможно. В этой, по сути, диффузионной области наблюдается слабая зависимость предела от температуры (~T0,5); положение нижнего предела зависит от геометрии реакционной зоны, материала стенки и наличия примесей. С повышением давления Р≥Р1-2 (или увеличением диаметра сосуда, концентрации примесей) обрыв цепей на стенке затрудняется, и возможно воспламенение смеси. При дальнейшем увеличении давления выше Р2-3 уже преобладают акты обрыва цепей (в объеме) над разветвлением, и воспламенение снова невозможно. Поскольку обрыв цепей определяется скоростью тройных соударений, наблюдается сильная зависимость положения верхнего предела от температуры и концентрации примесей, причем геометрия реакционной зоны и материал стенки не влияют на положение предела. Наконец, при значительных давлениях (область 4) воспламенение снова возможно, однако оно имеет тепловую природу. Рассмотрим подробнее тепловые эффекты реакции в связи с их важностью при оценке устойчивости режима работы технологических аппаратов. Когда реакция протекает намного быстрее, чем скорость отвода (подвода) тепла в реакционную зону, в этой зоне наблюдаются неизотермические эффекты. В случае эндотермической реакции, система обладает устойчивостью к флуктуации температуры благодаря наличию отрицательной обратной связи. Например, если возрастает температура реакционной смеси, также возрастает и скорость реакции, для протекания которой требуется больше тепла, и реакционная смесь остывает (и наоборот). Таким образом, стационарное состояние в случае эндотермической реакции является устойчивым к любому термическому возмущению.
Поиск по сайту: |
 ;
;  (3.R1)
(3.R1)
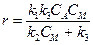 (3.23)
(3.23) (инициирование)
(инициирование) (продолжение цепи)
(продолжение цепи)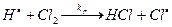 и т.д.
и т.д. (обрыв цепи на стенке 3а)
(обрыв цепи на стенке 3а) (и в объеме 3б))
(и в объеме 3б)) r
r
 2
2
 3
3

 (инициирование цепи, разрыв связи С-С)
(инициирование цепи, разрыв связи С-С) (продолжение цепи, отрыв атома Н от ацетальдегида)
(продолжение цепи, отрыв атома Н от ацетальдегида)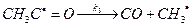 (продолжение цепи, разрыв связи С-С)
(продолжение цепи, разрыв связи С-С) (обрыв цепи)
(обрыв цепи)