 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Химическая кинетика и катализ
1. Раздел химии, изучающий скорости и механизмы химических реакций, называется... а) химическая термодинамика б) термохимия в) химическая кинетика г) калориметрия
2. Скорость химической реакции — это... а) время, за которое полностью расходуется одно из исходных веществ б) время, за которое заканчивается реакция в) изменение количества вещества реагентов (или продуктов реакции) в единицу времени в единице объема г) количество вещества продуктов реакции к моменту окончания реакции
3. В каких единицах выражается скорость химической реакции? а) моль∙л-1∙с-1 б) моль2∙с-1 в) моль2∙с г) безразмерная величина
4. От каких факторов не зависит скорость гомогенной химической реакции, протекающей в жидкой фазе? а) от природы реагирующих веществ б) от концентрации реагирующих веществ в) от температуры г) от объема реакционного сосуда
5. Зависимость скорости реакции общего типа аА + bВ → dD + еЕ от концентрации описывается основным постулатом химической кинетики — законом действующих масс. Его математическое выражение записывается... а) υ= k∙[A]∙[B] в) υ= k∙[A]a∙[B]b
б) υ= k∙[A]x∙[B]y г) υ= k∙
6. Константа скорости k в законе действующих масс υ = k∙[А]a∙[В]b – это... а) скорость реакции при единичных концентрациях реагирующих веществ б) безразмерный коэффициент пропорциональности между скоростью и концентрациями в) коэффициент в уравнении Вант-Гоффа г) изменение концентрации вещества к моменту окончания реакции
7. Общий порядок химической реакции — это... а) сумма показателей степеней в выражении скорости через концентрации реагирующих веществ б) число молекул, участвующих в реакции в) порядок приливания реагирующих веществ г) сумма коэффициентов в уравнении реакции
8. Элементарная реакция — это... а) реакция, которую нельзя «разбить» на более простые стадии б) реакция, протекающая с выделением теплоты в) реакция, протекающая в присутствии катализатора г) реакция, протекающая с поглощением теплоты
9. Большинство химических реакций состоит из нескольких элементарных реакций (называемых иногда элементарными стадиями). Число частиц, одновременно участвующих в элементарной реакции, называют... а) общим порядком реакции б) переходным комплексом реакции в) стехиометрией процесса г) молекулярностью реакции
10. Ни одна химическая реакция не протекает мгновенно. Во всех реакциях между реагентами и продуктами существует некое промежуточное образование — так называемое переходное состояние или переходный (активированный) комплекс. Переходное состояние — это... а) уже не реагенты, но еще не продукты б) продукт, полученный под воздействием излучения в) такое состояние системы, когда старые связи ещё не полностью разорвались, а новые ещё не вполне образовались г) реагент, обладающий самой низкой энтальпией образования
11. Какие из перечисленных величин не могут принимать дробные значения? а) скорость химической реакции б) порядок реакции в) молекулярность реакции г) константа скорости
12. Определите порядок реакции, если константа скорости имеет размерность л2/(моль2∙с). а) 0,5 (дробный) в) второй б) первый г) третий
13. Какова размерность константы скорости для реакции первого порядка! а) л2/(моль2с) в) л/(моль∙с) б) с-1 г) безразмерная величина
14. Во сколько раз увеличится скорость газофазной элементарной реакции А = 2В при увеличении давления в закрытом сосуде в 3 раза? а) не изменится в) увеличится в 3 раза б) уменьшится в 6 раз г) увеличится в 9 раз
15. Во сколько раз нужно увеличить давление, чтобы скорость образования NO2 по реакции 2NO + О2 = 2NO2 возросла в 1000 раз? а) в 22,4 раза б) скорость реакции не зависит от давления в) в 10 раз г) в 500 раз
16. За месяц до начала занятий в школе лаборант приготовил водный раствор пероксида водорода с концентрацией 0,3 моль/л и оставил колбу с раствором на полке, забыв герметично закрыть колбу. Первого сентября учитель химии готовил демонстрационный опыт и обнаружил, что концентрация Н2О2 в колбе уменьшилась вдвое. Какова оказалась средняя скорость реакции разложения пероксида водорода?
а) 5∙10-3 моль/(л∙сутки) в) 1,6 моль/(л∙мин) б) 16 моль/(л∙мин) г) 1,6 моль/(л∙сутки)
17. Для приближенной оценки измерения скорости широко используется эмпирическое правило Вант-Гоффа, согласно которому при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 2÷4 раза. Это правило было установлено для реакций при невысоких температурах и связано с понятием температурного коэффициента скорости реакции γ, определяемого соотношением: а) γ = (t + 10)2 ∕ t2 = 2÷4 в) γ = kt + 10 ∕ kt = 2÷4 б) γ = (t + 10) ∕ t = 2÷4 г) γ = (kt + 10)2 ∕ kt = 2÷4
18. Зная температурный коэффициент Вант-Гоффа, можно приближенно оценить изменение скорости реакции при увеличении температуры от Т1 до Т2 по формуле: а)
б)
а) в 4 раза в) в 10 раз б) в 16 раз г) в 2,5 раза
20. Скорость некой реакции увеличивается в 3,9 раза при повышении температуры реакционной смеси на 10 К. Во сколько раз увеличится скорость при .повышении температуры от 40 до 75°С? а) в 7,8 раза в) 15,6 раза б) в 117,1 раза г) 3,9 раза
21. Растворение образца алюминия в растворе гидроксида калия при 20°С заканчивается через 36 минут, а при 40°С такой же образец металла растворяется за 4 мин. За какое время данный образец алюминия растворится при 65°С? а) за 15,4 с б) за 1,5 минуты в) за 30 с г) практически мгновенно
22. Согласно Аррениусу, константа скорости зависит от температуры экспоненциально k=A∙exp-Eа/RT. Здесь Еа - энергия активации, R – газовая постоянная, Т – температура в Кельвинах, А – так называемая предэкспонента, ее размерность совпадает... а) с размерностью температуры б) она безразмерна в) с размерностью константы скорости г) с размерностью энергии активации
23. Энергия активации — это... а) энергия, необходимая для перехода веществ в состояние активированного комплекса б) энергия, которую необходимо затратить для измельчения исходных веществ в) энергия, которая выделяется в результате химической реакции г) разница между энергиями исходных веществ и продуктов реакции
24. На рис. 5.1 представлен график, иллюстрирующий соотношение между энергией активации и тепловым эффектом реакции А + В = АВ + Q. Исходя из графика, определите, чему равна энергия активации (кДж/моль) вышеуказанной реакции.
Ход реакции
Рис.5.1. Соотношение между энергией активации и изменением теплового эффекта реакции
а) 25 кДж/моль; в) 20 кДж/моль; б) 45 кДж/моль; г) нулю
25. При увеличении температуры от 0 до 13°С скорость некой реакции возросла в 2,97 раза. Чему равна энергия активации этой реакции? Еа=2,3∙R∙ а) 65,5 кДж/моль в) 8,31 кДж/моль б) нулю г) 54,6 кДж/моль
26. Пользуясь уравнением Аррениуса, оцените диапазон значений энергии активации, при которых будет справедливо правило Вант-Гоффа для комнатной температуры 298 К. а) 50 - 100 кДж/моль б) 10 - 20 кДж/моль в) при Е = 0 г) при любых значениях энергии активации
27. В каком из двух случаев константа скорости реакции увеличивается в большее число раз: при нагревании от 0°С до 10°С или при нагревании от 283 К до 293 К? Ответ обоснуйте с помощью уравнения Аррениуса. ln а) изменение константы в каждом случае одинаково б) во втором случае в) константа не изменяется в обоих случаях г) в первом случае
28. Энергия активации некой реакции в 3 раза больше, чем энергия активации другой реакции. При нагревании от Т1 до Т2 константа скорости второй реакции увеличилась в b раз. Во сколько раз увеличилась константа скорости первой реакции при нагревании от Т1 до T2? а) в b 3 раз в) в 3b раз б) в b раз г) в b1/3 раз
29. Какие вещества называются катализаторами? Катализаторы бывают положительными и отрицательными. а) образующие высокомолекулярные соединения б) изменяющие скорость химической реакции, но остающиеся неизменными после окончания реакции в) эффективно поглощающие радиоактивное излучение г) используемые для производства железобетона
30. Механизм действия катализатора заключается в том, что он изменяет «путь процесса» реагенты → продукты, причем новый путь характеризуется меньшей высотой энергетического барьера, т.е. меньшей энергией активации по сравнению с энергией активации некатализируемой реакции А + В = АВ + Q. Исходя из графика на рис. 5.2 определите, чему равна энергия активации (кДж/моль) вышеуказанной реакции в присутствии катализатора (пунктирная кривая).
Ход реакции Рис.5.2.Снижение энергии активации при каталитической реакции
а) 30 кДж/моль в) 5 кДж/моль б) 50 кДж/моль г) 15 кДж/моль
31. На рис. 5.3 изображена диаграмма потенциальной энергии реакции
А + В ↔ С + D . Кривая N представляет некатализируемую реакцию, кривая М - катализируемую. Какие физические величины обозначены через Р, Q и R? N
Рис. 5.3. а) Р - энергия активации некатализируемой реакции; Q - тепловой эффект катализируемой реакции; R - тепловой эффект некатализируемой реакции б) Р -энергия активации катализируемой реакции; Q - тепловой эффект катализируемой реакции; R - энергия активации некатализируемой реакции в) Р - тепловой эффект некатализируемой реакции; Q - энергия активации катализируемой реакции; R - энергия активации некатализируемой реакции г) Р - тепловой эффект реакции; Q - константа скорости катализируемой реакции, где R - константа скорости некатализируемой реакции.
32. Как называются биологические катализаторы? а) фуллерены в) ферромагнетики б) ферриты г) ферменты
33. Как влияет температура на скорость ферментативных реакций? а) скорость реакции возрастает с ростом температуры в любом интервале температур. б) скорость ферментативных реакций не зависит от температуры. в) ферменты обладают наибольшей активностью при температурах живого организма (~35-40°С). При температурах выше 50-60°С они, как правило, разрушаются и становятся неактивными — скорость реакции резко надает. г) при повышении температуры скорость ферментативной реакции всегда понижается.
34. Отрицательные катализаторы, замедляющие скорость химической реакции при повышении температуры, называются... а) инкубаторы в) инсульты б) интерферометры г) ингибиторы
35. Энергия активации некой реакции в отсутствие катализатора равна 80 кДж/моль, а в присутствии катализатора энергия активации понижается до значения 53 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора при 20°С? а) в 27 раз б) при комнатной температуре катализатор не ускоряет реакцию в) в 27 тысяч раз г) в 65 тысяч раз
36. Какая из реакций самая медленная? а) взрыв смеси водорода и фтора б) ржавление железа в) образование песка, в результате выветривания горных пород г) горение фосфора
37. Скорость химической реакции 2Н2 + O2 = 2H2O при увеличении концентрации водорода в 2 раза увеличивается в: а) 8 раз б) 2 раза в) 4 раза г) 16 раз
38. Для увеличения скорости реакции в 27 раз (температурный коэффициент равен 3), температуру следует повысить на: а) 20 оС б) 30оС в) 40оС г) 50оС
39. Реакция идет по уравнению А + 2В → С. Константа скорости реакции при данной температуре 0,5 л2/(моль2∙с), а начальные концентрации составляли для вещества А-0,2 моль/л, для вещества В-0,4 моль/л. Скорость этой реакции моль/(л∙с), после того, как прореагировало 0,2 моль/л вещества В, равна: а) 0,002 б) 0,004 в). 0,008 г) 0,010
40. Скорость реакции 2СO(г) + О2(г) → 2СО2(г) при повышении давления в 3 раза увеличится в: а) 3 раза б) 9 раз в) 27 раз г) 81 раз
Поиск по сайту: |
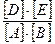

 в)
в) 
 г)
г) 

 ∙lg
∙lg 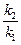
 или lg
или lg 

