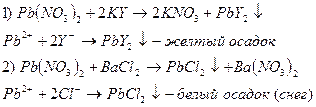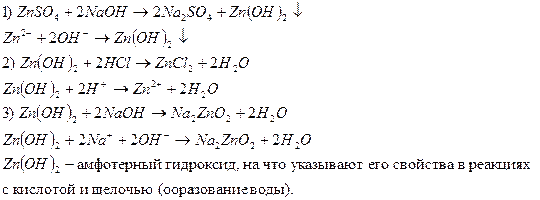|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Порядок выполнения работы. Лабораторная работа №4
Лабораторная работа №4
По дисциплине: ХИМИЯ (наименование учебной дисциплины согласно учебному плану) Тема: Исследование электролитической диссоциации и реакций в растворах электролитов .
Выполнил: студент гр. ВД-03 ______________ /Тлатов Э.В./ (подпись) (Ф.И.О.)
Проверил: ____________ /Девяткин П.Н./ (подпись) (Ф.И.О.)
Санкт-Петербург 2004год.
Цель работы: ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения.
Общие теоретические сведения Электролитическая диссоциация – процесс распада молекул электролитов на ионы под действием полярных молекул растворителя. Количественно способность электролита распадаться на ионы характеризуют степенью диссоциации:
где n – число продиссоциированных молей; n0 – исходное число молей электролита.
Процесс диссоциации обратимый, он приводит к равновесию между недиссоциированными молекулами и ионами и, следовательно, должен подчиняться закону действующих масс. Вещество AB при растворении в воде диссоциирует по уравнению:
При постоянной температуре отношение произведения концентраций конечных и исходных веществ постоянно и называется константой диссоциации:
где [A+], [B-], [AB] – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг.
По степени и величине константы диссоциации все электролиты принято условно делить на сильные (HNO3, H2SO4, HCl, HBr, HI, HClO4; гидроксиды щелочных металлов, бария, стронция; растворимые соли) и слабые (все остальные, а также комплексные ионы в растворе).
Порядок выполнения работы
Опыт 1. Образование малорастворимых оснований.
Опыт 2. Растворение малорастворимых оснований.
Опыт 3. Образование малорастворимых солей. A.
B.
Опыт 4. Изучение свойств амфотерных гидроксидов.
Опыт 5. Образование малодиссоциированных соединений.
Выводы: На основании эксперимента можно сделать ряд выводов. Разные соединения диссоциируют по-разному: одни диссоциируют полностью (HCl, H2SO4, BaCl и др.), а другие диссоциируют частично или вообще не диссоциируют (H2S, CO2, H20 и др.). В зависимости от степени диссоциации изменяются и свойства соединений: чем более диссоциируемо соединение, тем более оно активно в реакции с другими соединениями. Также мы ознакомились с реакциями в растворах электролитов и научились составлять их уравнения. А также установили, что электролитическая диссоциация – это процесс распада молекул электролитов на ионы под действием полярных молекул растворителя.
Поиск по сайту: |
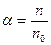 ,
,