 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
МОДУЛЬ 2. Физика объектного мира
МОДУЛЬ 2. Физика объектного мира ТЕМА 6. Химия. Химия – это наука об атомно-молекулярных взаимодействиях, в которых решающее значение имеет конфигурация и энергия атомов и молекул. Химические элементы Химические элементы таблицы Д. И. Менделеева до железа включительно синтезируются в недрах звёзд, которые изначально состояли из водорода с примесью гелия. Этих условий было достаточно, чтобы в звёздах синтезировался гелий из водорода и далее на этой основе (водород, гелий) синтезировались более тяжёлые элементы. Элементы тяжелее железа синтезируются при взрывах звёзд, по этой же причине вещество рассеивается в космосе, и служит материалом для образования вторичных звёзд и планет. Химические элементы образуются в недрах звезд при высоких температурах и давлениях. Сначала водородные звезды превращаются в гелиевые, гелиевые – в углеродные и т. д. В общем случае звезда – это достаточно энергичный и массивный объект, который в своей центральной части эволюционирует по элементарному составу к железу. Но, по мере того, как в центральной части звезды ядра легких элементов переходят в тяжелые ядра, создаются условия к скачкообразному затуханию реакций синтеза и исчезновению излучения из недр звезды. В этом случае, вследствие резкого уменьшения электромагнитного излучения, периферийные части звезды, не поддерживаемые мощным излучением, начинают падать к центру звезды, что в итоге создает (за счет энергии падения) новые высокие температуры и давления. Это приводит к тому, что начинается синтез еще более тяжелых ядер химических элементов с вынужденным поглощением энергии. Таким образом, создаются элементы тяжелее железа. В зависимости от массы и состава звезды, подобные звездные процессы могут происходить с выделением большой энергии (за счет высвобождения кинетической энергии вследствие притяжения), которая частью уходит на создание тяжелых химических элементов типа урана и далее, а, с другой стороны, при «благоприятных» обстоятельствах, может привести к мощному взрыву звезды, практически уничтожающему большую часть звезды. Таким образом, в звездах создаются все элементы таблицы Менделеева. Ядра легких элементов синтезируются с выделением энергии при высоких температурах и давлениях внутри звёзд. Высвобождающаяся энергия способствует повышению температуры и давления и процесс синтеза становится самоподдерживающимся, с одновременным мощным свечением звезды. В случае синтеза «сверхтяжелых» ядер из тяжелых ядер, необходима очень большая энергия инициации синтеза. Она уходит на то, чтобы сформировалось итоговое тяжелое ядро из более легких. При этом, внутренняя часть нового ядра «нагревается» настолько сильно, что оно больше походит на сильно разогретую каплю, нежели на твердую конструкцию. К такой горячей капле достаточно приложить извне сравнительно небольшое энергетическое воздействие, чтобы капля «перегрелась» и распалась на 2-3 очень быстрых компонента с выделением мощного гамма излучения и нейтронов, а также прочего излучения электромагнитного спектра (таким образом, например, идет процесс в атомных бомбах). При этом высвобождается та энергия, которая была «вбита» в тяжелые ядра при их синтезе во время взрывов звезд. Промежуточные ядра (между легкими и тяжелыми) имеют комбинированную структуру: слоеная «твердая» оболочка и разогретое жидкое «нутро». Легкие, средние и тяжелые ядра, окруженные электронами, образуют собственно химические элементы таблицы Менделеева. Химические соединения. Химические соединения не могут существовать в недрах звезд и на их поверхности, поскольку энергия связи химических соединений значительно меньше звездных энергий. Химические соединения могут образовываться только в недрах планет, на их поверхности и, в некоторых случаях, в космическом пространстве в газо-пылевых облаках и на малых космических телах, а также на остывших звездах. Химические соединения образуются за счет взаимодействия электронных оболочек атомов химических элементов при подводе к этим атомам энергии инициации связи извне. В зависимости от строения электронных оболочек различают ковалентную, ионную, металлическую и водородную связь химических элементов. Эти виды связей и лежат в основе химических соединений (= химических веществ). В отличие от ионных связей ковалентные связи определённым образом ориентированы в пространстве, когда атомы сближаются их атомные орбитали, имеющие электроны, взаимодействуют и возникают молекулярные орбитали. Форма ковалентных молекул определяется углами между связями, соединяющими атомы. Молекулы бывают линейные, плоские треугольные, тетраэдрические. Химические реакции. Образование химических связей идёт с выделением энергии, а разрыв химических связей идёт с поглощением энергии. В ходе химических процессов химические связи и образуются и разрушаются. Если преобладает разрушение, то процесс идёт с поглощением энергии, если преобладает образование, то процесс идёт с выделением энергии. В ходе химических реакций меняется концентрация веществ. Под скоростью химической реакции понимается изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объёме области химического процесса. В общем случае скорость химической реакции уменьшается по мере протекания химического процесса. Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Для реакции А + B = AB скорость химической реакции имеет вид
V = K∙(Ca ∙ Cb)где V – скорость реакции; Ca , и Cb - концентрации реагентов. При повышении температуры области химического процесса скорость большинства реакций увеличивается (за счёт большего числа соударения молекул). Скорость химической реакции зависит от концентрации веществ, от температуры концентрации, а так же от конфигурации молекул. Чем сложнее конфигурация, тем медленнее протекает химический процесс. В любой момент времени только часть соударяющихся молекул вступает в реакцию. Энергия активации химического процесса. При повышении температуры число столкновения молекул возрастает и увеличивается число благоприятных столкновений, что увеличивает скорость хим. реакции (соединения). Эта энергия называется энергией активации. Энергия активации необходима для преодоления сил отталкивания атомов (при соединении атомов). Энергетическая схема химического процесса имеет следующий вид
eк - кинетическая энергия выделяющаяся при образовании молекулы; для химического процесса выполняется положение eк = eсв = eраз где eраз – энергия разрушения молекулы. Все реакции, требующие большой энергии хорошо осуществляются при более низких энергиях, если используются катализаторы. Катализаторы: изменяют связи между атомами в молекулах и способствуют протеканию химических реакций. Катализаторы при этом не расходуются, хотя и могут загрязняться. Необратимые и обратимые реакции. Если реакционная зона изолирована, то реакция обратимая (протекающая в направлении соединения реагентов и разложения продуктов) Если реакционная зона не абсолютно изолирована и из реакционной зоны уходят энергия и вещества, то реакция - необратимая (реальная реакция частично обратима). Химическое равновесие. При частичной обратимости химических реакций имеется частичное химическое равновесие. Частичное химическое равновесие возникает из-за того, что выделившаяся энергия не выходит мгновенно из зоны химического процесса и успевает разрушить часть только-что синтезировавшегося продукта. Если меняются условия протекания химической реакции, то частичное химическое равновесие изменяется. Природные химические процессы – процессы с изменяющимся частичным химическим равновесием. Частичное химическое равновесие может существовать длительное время, если поддерживается искусственно (если вовремя подводятся реагенты и энергия и отводится выделившаяся энергия и появившийся продукт). Смещение химического равновесия может осуществляться искусственно. Смещение химического равновесия играет огромную роль в промышленном химическом производстве. Принцип Ле Шателье. Если на систему, находящейся в равновесии производится какое-либо внешнее воздействие (в виде изменения концентрации, температуры, давления), то оно благоприятствует той из двух противоположных реакций, которая ослабляет внешние воздействие. (В этом смысле устоявшаяся химическая реакция похожа на живое существо: если будет воздействие на реакцию, то зона химического процесса будет стремиться снять это воздействие за счёт частичного моментного изменения реакций с сохранением направления протекания основной реакции). Но, если воздействие извне будет длительным, то область химического процесса подчинится этому воздействию и основная реакция существенно изменится.
Примеры для реакции А+В=АВ: 1. Если увеличить количество реагентов А, В, то увеличится выход продукта АВ. 2. Если увеличить температуру зоны процесса, то реагентов А, В станет больше (тепло уходит на разрыв молекул АВ). 3. Если уменьшить температуру зоны процесса, то увеличится выход молекул АВ, т. к. при синтезе выделяется энергия, которая идёт на компенсацию уменьшения температуры зоны процесса. 4. Если увеличить давление в зоне процесса, то увеличится выход продукта АВ. Катализаторы не оказывают влияния на смещение химического равновесия, так как ускоряют и прямую и обратную реакцию. На смещение химического равновесия большое внимание оказывают специальные химические добавки, выводящие из активной зоны энергию и вещества. Вещества, увеличивающие действие катализаторов, называются промоторами. Вещества, замедляющие действие катализаторов, называются ингибиторами. МОДУЛЬ 2. Физика объектного мира ТЕМА 7. Кинетическая и структурная теория вещества.
Кинетическая и структурная теория вещества – это теория взаимодействия атомов и молекул в их больших скоплениях. Кинетическая теория основана на статистических методах исследования веществ.
ГАЗЫ. Основное уравнение кинетической теории газов имеет следующий вид: P∙V = (2/3)∙Wкгде P-Давление газа; V- Объем газа; Wк- суммарная кинетическая энергия частиц газа в объеме; Wк = ∑ (m∙U²)/2 где m-масса частицы; U-скорость частицы; Эту формулу можно написать иначе: P∙V = (1/3)∙М∙с²где М=n∙m Средняя квадратичная скорость частиц имеет следующий вид:
С = √(1/n)∙∑U²
Закон распределения молекул по скоростям Максвелла в результате взаимного столкновения молекул:
¦ ¦
Где n – число молекул; u – скорость молекул;
Графику соответствует формула: ∫f(u)∙du = 1где f(u) – функция скорости частиц газа; Которая показывает, что в газе всегда есть частицы с малыми скоростями (в том числе почти нулевыми) и частицы с большими скоростями (в том числе значительно превосходящими u = 1) Наибольшее число молекул имеет «среднюю» скорость около скорости u = 1. При увеличении температуры газа максимум кривой смещается в сторону больших скоростей (количество частиц не увеличивается но увеличивается их скорость) .
- наибольшая вероятная скорость: Uв ≈1.41√( kT)/m - средняя арифметическая скорость: Uа ≈1.60 √( kT)/m - средняя квадратичная скорость: Uс ≈1.73 √( kT)/m Где k – постоянная Больцмана; Т - температура.
Средняя кинетическая энергия молекул одноатомного идеального газа: Wк = (3/2) ∙ kT
Броуновское движение(беспорядочное движение частиц): r²=6∙D∙tгде r²- средний квадрат расстояния, на которой смещается частица за время t; D- Коэффициент диффузии частицы; D = kT ∙U
Если газ выпускать из сосуда через маленькое отверстие, то, выходя, он охлаждается, и может перейти в жидкую фазу.
ЖИДКОСТИ. 1. Жидкости- вещества достаточно большой плотности, без упругости формы и малой сжимаемости (мало пустот в объеме жидкости). 2. Жидкости, как правило, изотропны (одинаковы по направлениям). 3. В жидкостях наблюдается ближний порядок (жидкости в маленьких объемчиках напоминают кристаллики). 4. Молекулы жидкости совершают тепловые колебания около положения равновесия, близкие по частоте к колебаниям атомов в кристаллах. 5. Молекулы совершают перемещения в жидкости, но не непрерывно, а активированными скачками с преодолением связи с другими молекулами. 6. С ростом температуры жидкости скачков молекул становится больше, вязкость жидкости уменьшается, текучесть увеличивается. 7. Целый ряд факторов указывает на сходство жидкостей с твердыми телами. Жидкость- это тело из огромного числа беспорядочно расположенных субмикроскопических кристалликов жидкости. 8. На границах жидкости существует её поверхностное натяжение и пленка поверхностного натяжения. 9. Соприкасаясь с твердым телом, жидкость может его смачивать, растекаясь по телу, а может отталкиваться от него и образовывать шарик жидкости. 10. В узких трубочках (капиллярах) жидкость способна подниматься вверх, если есть смачиваемость материала стенок. 11. Жидкости испаряются с поверхности (в жидкости всегда есть молекулы с большой скоростью, которые пробивают плёнку поверхностного натяжения и уходят из жидкости). 12. Жидкость кипит, если есть испарение с поверхности жидкости и с поверхности пузырьков жидкости. Кипение – интенсивное испарение. Кипение может смениться на конденсацию пара. Это фазовые переходы 1-го рода. 13. Жидкости способны растворять в себе другие вещества. Если растворенное вещество диссоциирует на ионы и взаимодействует с растворителем, то жидкость становится электролитом, хорошо проводит электрический ток. 14. Для растворенных молекул не выполняется закон распределения по скоростям Максвелла. 15. Сверхтекучесть жидкости - это следствие отсутствия вязкости жидкости.
КРИСТАЛИЧЕСКИЕ ТВЕРДЫЕ ТЕЛА. 1. Это - тела, отличающиеся постоянством формы и объема. 2. Кристаллы - твердые тела, сохраняющие правильное периодическое расположение их частиц (дальний порядок, кристаллическая решетка). 3. Монокристаллы – это один большой кристалл. 4. Большинство твердых тел – это поликристаллы с мелкокристаллической структурой. 5. Кристаллы имеют симметрию. 6. Различаются скалярные, векторные и тензорные физические свойства кристаллов. Скалярные - плотность и теплоёмкость. Векторные - теплопроводность, электрическое сопротивление. Тензорные – упругость (свойство, которое существует более чем по 3 направлениям в кристалле). 7. Существуют следующие типы твердых тел: · Металлы (силы отталкивания и притяжения скомпенсированы), благодаря свободным электронам, обладают высокой тепло - и электропроводностью); · Ионные кристаллы (в узлах кристаллической решетки расположены положительные и отрицательные ионы); · Валентные кристаллы (полупроводники); · Молекулярные кристаллы (в узлах кристаллической решетки расположены молекулы, сцепленные силами Ван-дер-Ваальса); · Кристаллы с водородными связями (лед и т.п.). 8. Тепловые движения частиц в кристалле происходят в узлах кристаллической решетки. 9. С повышением температуры твердые тела расширяются (тепловое движение частиц друг около друга увеличивается, и в совокупности, пространство, занимаемое телом также увеличивается) Длина нагретого тела: L=L0 (1+αi * ∆t) αi –коэффициент удлинения; зависит от свойств материала ∆t – изменение температуры Объем тела при нагревании: V=V0 (1+αv * ∆t) αv - коэффициент объемного расширения ∆t – изменение температуры 10. фазовые превращения твердых тел · Плавление: при нагревании связи между частицами разрушаются, твердое тело «растекается»; температура плавления зависит от давления (с увеличением давления температура плавления увеличивается [давление увеличивается, если уменьшается объём тела; при этом увеличивается число соседних частиц, что мешает связанным частицам разойтись]). · Кристаллизация: При уменьшении температуры расплава, расплав кристаллизуется вокруг примесей. Если примесей нет, расплав может быть переохлажден без кристаллизации. · Сублимация: Испарение твердых тел при любой температуре
АМОРФНЫЕ ВЕЩЕСТВА 1. Это вещества не обладающие в конденсированном состоянии кристаллической решеткой, но обладающие упругостью (постоянством) формы (стекло, глицерин …). 2. Аморфные вещества при определенных давлениях и температурах из жидкого состояния переходят в твердое: стеклуются (обретают свойства твердых тел). При этом меняются объем, механические, электрические и др. свойства а.в. 3. В жидком состоянии при каждой температуре у а.в. имеется своя равновесная молекулярная структура. При смене температуры структура а.в. перестраивается в течение времени релаксации. При охлаждении а.в. перестройка структуры (релаксация) затягивается, отстает от охлаждения и при некоторой температуре (температуре стеклования) вообще прекращается. А.в. становится «стеклом». При этом переход жидкой фазы (имеющей в себе неоднородности) в «стекло» не связан с изменением степени упорядочения структуры а.в. При охлаждении аморфного вещества его свойства зависят (только) от температуры и скорости охлаждения (чем больше начальная температура а.в., чем больше скорость охлаждения, тем меньше перестраивается структура, тем неравновеснее структура стеклованного аморфного тела). Чем больше структура «стекла» отличается от равновесной (чем быстрее охлаждалось а.в.) тем аномальнее становится «стекло» в свойствах, тем аномальнее свойства а.в. могут быть при размягчении (при нагреве). 4. При нагревании аморфные тела размягчаются. Их свойства зависят при этом от скорости предшествующего охлаждения (при охлаждении фиксируется определенная структура «стекла»). Если скорость охлаждения была высока, а скорость нагрева еще выше, то размягчение «стекла» начинается при более высоких температурах, чем стеклование и это приводит к резкому увеличению объема нагреваемого стекла до момента его расплавления (при нагреве скорость релаксации увеличивается и расстояния между частицами а.в. быстро увеличиваются). 5. При выдерживании аморфного вещества («стекла») при достаточно высокой температуре его структура с течением времени приблизится к равновесной (релаксация). 6. При стекловании или размягчении коэффициент теплового расширения и теплоемкость а.в. резко меняются, что похоже на фазовый переход 2 – го рода, но не является им (не происходит выраженного изменения структуры, но остается неравновесность состояния).
ПОЛИМЕРЫ 1. Бывают линейные и трехмерные. Строго линейных полимеров очень мало. Н Н Н Н | | | | - С - С – С – С - ПРИМЕР линейного полимера (полиэтилен). | | | | Н Н Н Н
2. Линейные полимеры растворимы (истинные растворы) и могут быть в жидком состоянии (расплавы). 3. Трехмерные полимеры (основные цепи с боковыми цепями) не плавятся и не растворимы, могут только набухать в растворителе. 4. Кристалличность полимеров наступает, когда температура кристаллизации выше температуры стеклования (кристаллизация начинается раньше, чем стеклование в ходе охлаждения полимера). 5. Существует три типа кристаллических полимеров:
6. Высокая вязкость полимеров ведет к большому времени кристаллизации. 7. Механические свойства полимеров ценны тем, что они обладают высокой деформируемостью и чувствительностью к температуре.
Поиск по сайту: |
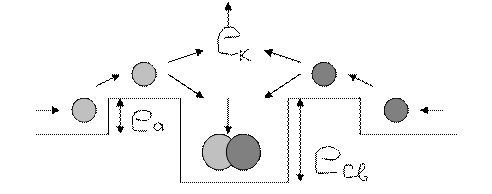
 Где eк = eсв ; eа – энергия активации; eсв – энергия связи атомов в молекулу;
Где eк = eсв ; eа – энергия активации; eсв – энергия связи атомов в молекулу; n
n
 • u
• u