 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Основное уравнение молекулярно-Кинетической теории газа (уравнение Клаузиуса 1857г.)Стр 1 из 3Следующая ⇒
ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ Молекулярная физика изучает круг явлений, объяснение которых может быть дано исходя из движения и взаимодействия молекул. Методом молекулярной физики является молекулярно-кинетическая теория, основные положения которой гласят: 1) вещества состоят из мельчайших частиц, атомов или молекул, которые находятся в непрерывном, хаотическом движении; 2) в любом, даже очень малом объеме, к которому еще можно применить выводы молекулярно-кинетической теории, число частиц очень велико; 3) размеры частиц малы по сравнению с расстояниями между ними; 4) соударения частиц между собой и со стенками сосуда являются абсолютно упругими; 5) при отсутствии внешних сил частицы распределяются по всему занятому объему равномерно; 6) по абсолютной величине скорости движения частиц могут изменяться от бесконечно малых до бесконечно больших. Первая задача, которую мы рассмотрим, состоит в определении величины давления газа на стенки сосуда.
Основное уравнение молекулярно-Кинетической теории газа (уравнение Клаузиуса 1857г.)
Выделим на стенке сосуда элементарную площадку ΔS (рис.1) и подсчитаем число соударений с ней за время Δt. Очевидно, оно равно числу молекул, которые за время Δt успеют долететь до элемента ΔS. Скорости молекул будут самыми различными как по величине, так и по направлению. Кроме того, они непрерывно меняются при каждом столкновении друг с другом. Однако, если при неизменных внешних условиях сумма их кинетических энергий - величина постоянная. Так что убывание скорости одной молекулы приводит к возрастанию скорости другой. Принимая во внимание огромное число таких процессов можно считать, что распределение скоростей по значениям постоянно.
Тогда условно можно считать, что вдоль любой из осей движется 1/3 молекул, причем половина (т.е. 1/6 от общего числа) - в одну сторону, а вторая половина - в противоположную. Применим эти рассуждения к прямому цилиндру, построенному на элементе ΔS как основании. Рассматривая движение в направлении нормали к ΔS как движение вдоль одной из осей координат (X, Y или Z), получим для числа частиц, имеющих скорость ui и достигших элемента стены ΔS за время Δt:
где ni - число молекул i-ого сорта в единице объема, т.е. таких, которые имеют скорость ui; ∆Ѕ∙υi∙∆t - объем той части цилиндра, в которой содержатся молекулы i-ого сорта, способные долететь до элемента ∆Ѕ за время ∆t. При соударении каждая такая молекула массой m изменяет свой импульс на величину
∆( mυi) = - mυi- mυi = -2 mυi (2).
Тогда, в соответствии с третьим законом Ньютона, стенка получает при единичном соударении импульс силы fi∙∆t = 2mυi , а суммарный импульс, переданный молекулами i-ого сорта элементу ∆Ѕ за время ∆t:
fi∙∆t = ∆ni ∙2mυi =
Умножим и разделим правую часть равенства на 2:
fi∙∆t = т.к. Полный импульс силы, переданный площадке ∆Ѕ за время ∆t всеми молекулами, будет представлять собой сумму выражений вида (4), записанных для частиц, двигающихся со скоростями υ1, υ2, … υi … υn :
f∆t =
Разделив правую и левую часть (5) на ∆Ѕ∆t, получим:
p = Это и есть основное уравнение МКТ, которое гласит: давление идеального газа равно 2/3 кинетической энергии поступательного движения частиц в единице объема. Рассмотрим другие формы представления основного уравнения МКТ. Введем понятие о средней кинетической энергии молекулы идеального газа как Здесь p = или с учетом (8):
Найдем взаимосвязь pVμ =
Сопоставляя (11) с уравнением состояния для моля идеального газа - pVμ = RT, имеем RT =
Здесь
Формула (12) позволяет сделать очень важный вывод: абсолютная температура идеального газа прямо пропорциональна средней энергии поступательного движения частиц. как оказывается, этот вывод справедлив не только для газов, но и для любых других агрегатных состояний вещества. Подставим в (9)
p =
Откуда n =
Для любого газа при одних и тех же значениях p и Т концентрация молекул одинакова. Например, при нормальных условиях n = 2,69∙1025 м-3 - число Лошмидта. Для смеси газов можно представить (13) в виде
p = nkT = kT но nikT = pi - это так называемое парциальное давление - давление, которое создавал бы газ i-ого сорта, если бы в сосуде был он один. T.o. давление смеси газов равно сумме парциальных давлений соответствующих компонентов Р = Р1 + Р2 + Р3… = Получим выражение для
Поиск по сайту: |
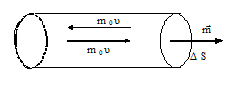 Воспользуемся моделью идеального газа: размеры его молекул столь малы, что их суммарным объемом можно пренебречь по сравнению с объемом сосуда; подавляющую часть времени каждая молекула движется свободно и лишь иногда испытывает упругие столкновения с другими молекулами и стенками сосуда. При ударе о стенку молекула передает ей некоторый импульс силы – FmΔtm , численно равный изменению количества движения молекулы – Δ(mυ). Каждый элемент поверхности стенки ΔS непрерывно подвергается "бомбардировке" большим количеством молекул, что и создает силовое воздействие, т.е. давление, со стороны молекул на стенку, которое направлено по нормали к ней.
Воспользуемся моделью идеального газа: размеры его молекул столь малы, что их суммарным объемом можно пренебречь по сравнению с объемом сосуда; подавляющую часть времени каждая молекула движется свободно и лишь иногда испытывает упругие столкновения с другими молекулами и стенками сосуда. При ударе о стенку молекула передает ей некоторый импульс силы – FmΔtm , численно равный изменению количества движения молекулы – Δ(mυ). Каждый элемент поверхности стенки ΔS непрерывно подвергается "бомбардировке" большим количеством молекул, что и создает силовое воздействие, т.е. давление, со стороны молекул на стенку, которое направлено по нормали к ней. Любое движение в пространстве можно рассматривать как движение вдоль трех взаимно перпендикулярных осей: OX, OY, OZ, независимо, как эта система сориентирована. В силу хаотичности вероятность движения молекул вдоль любого направления одинакова.
Любое движение в пространстве можно рассматривать как движение вдоль трех взаимно перпендикулярных осей: OX, OY, OZ, независимо, как эта система сориентирована. В силу хаотичности вероятность движения молекул вдоль любого направления одинакова. (1),
(1), ∙2mυi =
∙2mυi =  (3).
(3).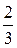 ni ∙
ni ∙  ∙∆Ѕ∙∆t =
∙∆Ѕ∙∆t =  (4),
(4), - кинетическая энергия поступательного движения одной частицы, движущейся скоростью υi.
- кинетическая энергия поступательного движения одной частицы, движущейся скоростью υi.
 (5).
(5). (6).
(6). - представляет собой суммарную кинетическую энергию молекул в единице объема, т.е. объемную плотность энергии поступательного движения. Обозначим
- представляет собой суммарную кинетическую энергию молекул в единице объема, т.е. объемную плотность энергии поступательного движения. Обозначим  =w. Теперь (6) примет вид:
=w. Теперь (6) примет вид: . Тогда
. Тогда  (8).
(8). - называется средней кинетической скоростью частиц (следует иметь ввиду, что
- называется средней кинетической скоростью частиц (следует иметь ввиду, что  ). Теперь w =
). Теперь w =  и (7) примет вид:
и (7) примет вид: (9),
(9), (10).
(10). с макропараметрами идеального газа. Умножим (9) на молярный объем Vμ :
с макропараметрами идеального газа. Умножим (9) на молярный объем Vμ : (11).
(11). , что дает:
, что дает: (12).
(12). - постоянная Больцмана, k = 1,38∙10-23 Дж/К.
- постоянная Больцмана, k = 1,38∙10-23 Дж/К. (13).
(13). .
. = n1kT + n2kT + n3kT + … nikT + … ,
= n1kT + n2kT + n3kT + … nikT + … , Рi (14) - закон Дальтона.
Рi (14) - закон Дальтона. через макропараметры идеального газа: Из (12)
через макропараметры идеального газа: Из (12)  , тогда
, тогда ;
;  (15).
(15).