 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Расчетная работа 2(РР-2)
Домашняя работа (ДР) В закрытую систему ввели газообразные вещества А и В ( Считается, что поведение этих газообразных веществ близко к идеальному, образующаяся в результате реакции смесь будет близка по свойствам к идеальному раствору. Теплоемкость каждого газа будет зависеть от температуры. Во время Укажите последовательность Ваших действий при проведении термодинамического расчета (расчетные формулы, смысл величин в них входящих, разные варианты результатов и возможные выводы из них) для ответа на вопросы: 1.Если предположить, что возможно протекание единственной (не изученной ранее) реакции 2А = В, то, в каком направлении (прямом или обратном) будет она протекать при данных условиях? 2. Куда будет смещаться химическое равновесие этой реакции при увеличении температуры ? при уменьшении давления? (ответ обоснуйте физико-химическими уравнениями) Расчетная работа 1 (РР-1) Задача 1. а) найти графически энергию активации вязкого течения толуола; б) изобразить графически температурную зависимость мольной изобарной теплоемкости гептана в интервале температур от 60 до 160 оС. Задача 2. Имеется газ N2О4 в количестве 250 г в состоянии I при температуре 298 К и давлении 1 атм. Его перевели в состояние II (температура 600 К и давление 3 атм). Найти мольные и полные изменения следующих функций при этом: а) объема; б) энтропии; в) энтальпии; г) внутренней энергии; д) энергии Гиббса. Задача 3. а) в интервале температур от 400 до 700 К построить графические зависимости стандартной мольной энтропии циклогексана от температуры; б) найти значение стандартной мольной изобарной теплоемкости при температуре 550 К двумя способами. Задача 4.В таблице приведеназависимость изобарной теплоемкости двухкомпонентного жидкого раствора вода (1 компонент) - ацетон (2 компонент) от массы кислоты m2 при постоянной массе воды m1=0,5 кг
(Т = 298 К, р = 1 атм):
Постройте график зависимости изобарной теплоемкости раствора С р от числа молей ацетона n2 и определите для обоих компонентов их парциальные мольные изобарные теплоемкости при мольной доле 2-го компонента N2 = 0,3. Расчетная работа 2(РР-2) Задача 1. При температуре 951 К рассчитайте значения стандартной мольной энтальпии, стандартной мольной энтропии, стандартной мольной энергии Гиббса реакции Задача 2. Определите степень термической диссоциации исходного вещества по реакции в газовой фазе N2O4 = 2 NO2 , если Т = 325 К, р = 1,5 атм
Задача 3. Степень диссоциации пятихлористого фосфора на треххлористый фосфор и хлор в газовой фазе при температуре 473 К и давлении 1 атм составляет 0,485 , а при температуре 453 К и том же давлении 0,344. При какой температуре степень диссоциации достигнет величины 0,745 ? Чему равна стандартная мольная теплота этой реакции?
Поиск по сайту: |
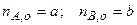 ). Давление и температура в системе поддерживаются постоянными ( р = 1 атм, Т = 740 К).
). Давление и температура в системе поддерживаются постоянными ( р = 1 атм, Т = 740 К). (система не достигла равновесия) парциальные давления газов в смеси имеют значения pA и pB..
(система не достигла равновесия) парциальные давления газов в смеси имеют значения pA и pB.. . Определите, возможно ли самопроизвольное протекание газовой реакции слева направо при этой температуре. В какую сторону будет смещаться равновесие данной реакции при изобарическом повышении температуры? Исходная смесь соответствует стехиометрическому составу, газы близки по свойствам к идеальным.
. Определите, возможно ли самопроизвольное протекание газовой реакции слева направо при этой температуре. В какую сторону будет смещаться равновесие данной реакции при изобарическом повышении температуры? Исходная смесь соответствует стехиометрическому составу, газы близки по свойствам к идеальным.