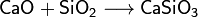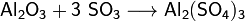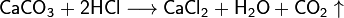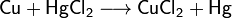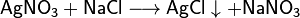|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Физические свойства и строение солей ⇐ ПредыдущаяСтр 2 из 2
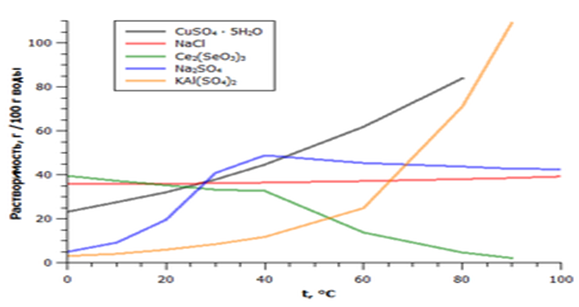
4)Зависимость растворимости некоторых солей от температуры Как правило, соли представляют собой кристаллические вещества с ионной кристаллической решёткой. Например, кристаллы галогенидов щелочных и щёлочноземельных металлов (NaCl, CsCl, CaF2) построены из анионов, расположенных по принципу плотнейшей шаровой упаковки, и катионов, занимающих пустоты в этой упаковке. Ионные кристаллы солей могут быть построены также из кислотных остатков, объединённых в бесконечные анионные фрагменты и трёхмерные каркасы с катионами в полостях (силикаты). Подобное строение соответствующим образом отражается на их физических свойствах: они имеют высокие температуры плавления, в твёрдом состоянии являются диэлектриками[19]. Известны также соли молекулярного (ковалентного) строения (например, хлорид алюминия AlCl3). У многих солей характер химических связей является промежуточным между ионным и ковалентным[8]. Особый интерес представляют ионные жидкости — соли с температурой плавления ниже 100 °С. Кроме аномальной температуры плавления ионные жидкости имеют практически нулевое давление насыщенного пара и высокую вязкость. Особые свойства этих солей объясняются низкой симметрией катиона, слабым взаимодействием между ионами и хорошим распределением заряда катиона[20]. Важным свойством солей является их растворимость в воде. По данному критерию выделяют растворимые, мало растворимые и нерастворимые соли.
Нахождение в природе Многие минералы — соли, образующие залежи (например, галит Методы получения Существуют различные методы получения солей:
Кристаллогидраты обычно получают при кристаллизации соли из водных растворов, однако известны также кристаллосольваты солей, выпадающие из неводных растворителей (например, CaBr2·3 C2H5OH)[8]. Химические свойства Химические свойства определяются свойствами катионов и анионов, входящих в их состав. Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, малодиссоциирующие вещества, например, вода):
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряду активности металлов:
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
7)Некоторые соли разлагаются при нагревании:
Поиск по сайту: |

 , сильвин
, сильвин  , флюорит
, флюорит  ).
).