 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Способы получения средних солейСтр 1 из 3Следующая ⇒
Соли Солями называются сложные вещества состоящие из катионов металлов или катионов аммония, или катионов алкиламмониев, или других сложных катионов, или комплексных катионов и анионов кислотных остатков, которые могут быть, как простыми, так и комплексными: Например: 1) NaCl, K2SO4, LiNO3, Ba3(PO4)2; 2) NH4Br, (NH4)2Cr2O7;
3) СH3 – NH3 I - йодид метиламмония ; (CH3 − NH2 − CH2−CH3)2SO4- сульфат метилэтиламмония
4) UO2+(NO3−)2 - нитрат уранила; 5) СuSO4 - сульфат меди(II); K2[PbCl6] - гексахлороплюмбат (IV) калия; NH4[BF4] - тетрафтороборат аммония; [Pt(NH3)4] [PtCl4] - тетрахлороплатинат II тетрамминплатины II - соль Магнуса,
Классификация солей Соли бывают: средними, кислыми, основными, двойными и комплексными. Средние соли – сложные вещества, молекулы которых состоят из катионов металлов или катионов аммония или алкиламмониев, или других сложных катионов и анионов кислотных остатков. Примечание 1: в составе этих солей не может быть ни протонов, ни гидроксид-ионов. Примечание 2: в их составе не может быть два разных катиона или два разных аниона. И катион, и анион могут быть комплексными. Примеры средних солей: NaCl, Ba(NO3)2, (NH4)2SO4, Na[BF4], [Ni(NH3)6]SO4 – сульфат гексаамминникеля,
Способы получения средних солей. Средние соли могут быть получены путём взаимодействия металлов, стоящих в ряду напряжения до водорода, с кислотами: Mg + H2SO4 → MgSO4 + H2↑ (газ) Или с кислыми солями: 3 Zn + 3 KH2PO4 → Zn3(PO4)2 + K3PO4 + 3 H2↑ Путём взаимодействия металлов, стоящих в ряду напряжений после водорода, с кислотами- окислителями (за счет восстановления аниона – NO3−): 3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO↑ + 4H2O При взаимодействии кислот с основными оксидами: CaO + H2C2O4 → CaC2O4 + H2O щавелевая к-та оксалат кальция при взаимодействии амфотерных оксидов с кислотами: Al2O3 + 6 HNO3 → 3 H2О + 2 Al(NO3)3 При взаимодействии кислот со щелочами: 2 H3PO4 + 3 Ba(OH)2 → Ba3(PO4)2↓ + 3 H2O При взаимодействии кислот с нерастворимыми в воде основаниями: Bi(OH)3 + 3 HNO3 → Bi(NO3)3 + 3 H2O При взаимодействии кислот с амфотерными гидроксидами: Cr(OH)3 + 3 HCl → CrCl3 + 3 H2O При взаимодействии кислот с гидросилсодержащими комплексами: 4 HNO3 + K2[Pb(OH)4] → 2 KNO3 + Pb(NO3)2 + 4 H2O При взаимодействии кислот с аммиаксодержащими комплексами: 4 H2SO4 + [Ni(NH3)6](OH)2 → NiSO4 + 3 (NH4)2SO4 + 2 H2O При взаимодействии кислот с аммиаком, первичными, вторичными, третичными аминами и четвертичными аммониевыми основаниями: HClO4 + NH3 → NH4ClO4 - перхлорат аммония
При взаимодействии кислот с солями более слабых, чем они кислот:
H2SO4 + K2SiO3 → H2SiO3↓ + K2SO4 При взаимодействии нелетучих кислот с солями летучих кислот:
Соли могут получаться также при взаимодействии кислотных оксидов со щелочами, SO2 + 2 NaOH → Na2SO3 + H2O нерастворимыми в воде основаниями, 3 SO3 + La(OH)3 → La2(SO4)3 + 3 H2O амфотерными гидроксидами: P4O10 + 6 Cu(OH)2 → 2 Cu3(PO4)2 + 6 H2O При взаимодействии кислотных оксидов с основными, кислотных оксидов с афмотерными и основных оксидов с амфотерными при сплавлении: SO3 + Na2O → Na2SO4 SO3 + ZnO → ZnSO4 K2O + Al2O3 Соли могут получаться также в реакциях ионного обмена между солями: Ba(NO3)2 + Al2(SO4)3 → BaSO4↓ + 2 Al(NO3)3 2 Na3PO4 + 3 ZnCl2 → Zn3(PO4)2↓ + 6 NaCl В окислительно-восстановительных реакциях между солями в нейтральной: 4 NaClО + K2S → 4 NaCl + K2SO4 кислой: 3 Na2SO4 + K2Сr2O7 + 4 H2SO4 → 3 Na2SO4 + Сr2(SO4)3 + K2SO4 + 4 H2O и щелочной средах: Na2S + 8 KMnO4 + 8 KOH → Na2SO4 + 8 K2MnO4 + 4 H2O Средние соли также могут быть получены путём обменных реакций других средних солей с кислотными оксидами: K2SiO3 (раствор) + CO2(газ) → K2CO3 + SiO2↓ (гель)
Средние соли могут получаться из других солей путём реакции замещения на металл, стоящий в ряду напряжений левее металла исходной соли: CuSO4 + Zn → ZnSO4 + Cu Mn(NO3)2 + Mg → Mg(NO3)2 + Mn Примечание: эти реакции протекают в водных растворах, поэтому брать в качестве вытесняющего металла металлы, стоящие в ряду напряжений левее магния нельзя, так как они реагируют с водой. Некоторые средние соли могут быть получены путём взаимодействия других солей с простыми веществами, например, кислородом или серой: 2 Na2SO3 + О2 → 2 Na2SO4 2 KNO2 + О2 → 2 KNO3 PbS + 2 О2 → PbSО4 KCN + S → KSCN Одни трудно растворимые соли могут быть получены из других трудно растворимых солей действием на них большого избытка насыщенного раствора хорошо растворимой соли, содержащей нужный анион или катион:
Некоторые средние соли могут быть получены из других солей путём их диспропорционирования при нагревании: 4 KClO3
Другие путём каталитического разложения солей так же при нагревании: 2 KClO3 Некоторые средние соли могут получаться из других средних солей в результате их термического разложения: . 4 K2Cr2O7 (оранжевый) (лимонно-жёлт.) (зелён.) ( фиолетов) (зелёный.) (бурый) Некоторые средние соли переходят в другие средние соли под действием кислот или щелочей:
K2Cr2O7 + 2 KOH → 2 K2CrO4 + H2O 2 K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O дихромат калия хромат калия Некоторые средние соли получаются при разложении комплексных солей: [Cu(NH3)4]SO4 K2[Ni(CN)4] Разложение красной кровяной соли: 6 K3[Fe(CN)6]
Поиск по сайту: |








 2 KAlO2
2 KAlO2
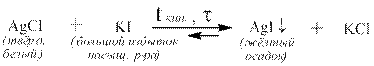

 KCl + 3 KClO4
KCl + 3 KClO4 2 KCl + 3 O2
2 KCl + 3 O2 4 K2CrO4 + 2 Cr2O3 + 3 O2↑ 2 KMnO4
4 K2CrO4 + 2 Cr2O3 + 3 O2↑ 2 KMnO4  18 KCN + 2 Fe3C + N2↑ + 8 N ≡ C − C ≡ N↑ (дициан - газ)
18 KCN + 2 Fe3C + N2↑ + 8 N ≡ C − C ≡ N↑ (дициан - газ)