 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Формулы для расчета газовых смесей
В табл. 1: mi – молекулярная масса i-го компонента; 8314 Дж/(кмоль×К) – значение универсальной газовой постоянной; Ri – газовая постоянная i-го компонента.
Для вычисления количества теплоты, полученного или отданного газом в процессе его энергетического взаимодействия с окружающей средой, введено понятие теплоемкости. Под удельной теплоемкостью понимают количество теплоты, которое необходимо сообщить телу, чтобы повысить температуру какой-либо его количественной единицы на 1 0С (К). В зависимости от выбранной количественной единицы, различают теплоемкости:
мольную mс, кДж/(кмоль×К); массовую с, кДж/(кг×К); объемную с/, кДж/(м3×К).
Эти теплоемкости связаны между собой следующими соотношениями:
с = mс/m ; с/ = mс/22,4 ; с/ = с×rн ,
где rн – плотность газа при нормальных условиях. 1 м3 газа имеет различную массу в зависимости от давления и температуры. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м3 при нормальных условиях (ρн = 101325 Па, Тн = 273 К). При этом объем 1 кмоля различных газов равен 22,4 м3/кмоль, а универсальная газовая постоянная mR = 8314 Дж/(кмоль×К). В зависимости от способа подвода теплоты к газу (р = const или V = const), различают изобарную ср и изохорную сv теплоемкости. Отношение этих величин носит название показателя адиабаты
k = mcp/mcv = cp/cv.
Теплоемкости ср и сv связаны также соотношением Майера
mсp - mcv = mR = 8,314, кДж/(кмоль×К).
Теплоемкость газов меняется с изменением температуры, причем эта зависимость имеет криволинейный характер. Значения истинных и средних теплоемкостей в интервале от 00 до t берутся непосредственно из таблиц, причем в необходимых случаях производится интерполяция. Количество теплоты, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1 до t2 , можно найти по формуле:
где cm1 и cm2 – соответственно средние теплоемкости в пределах 00 – t1 и 00 – t2 . Если в процессе участвуют М (кг) или Vн (м3) газа, то:
QV = M(cvm2 t2 – cvm1t1) = Vн(c/vm2 t2 – c/vm1 t1) , кДж;
QP = M(cpm2 t2 – cpm1 t1) = Vн(c/pm2 t2 – c/pm1 t1) , кДж.
Теплоемкость газовой смеси следует определять по формулам:
массовая - объемная - мольная -
Поиск по сайту: |


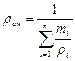
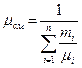









 ;
; ;
; .
.