 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Нітратна та ортофосфатна кислоти. Нітрати та ортофосфати
План: 1. Фізичні властивості нітратної та ортофосфатної кислот. 2. Одержання нітратної та ортофосфатної кислот. 3. Хімічні властивості нітратної та ортофосфатної кислот. 4. Загальні відомості про нітрати. 5. Загальні відомості про ортофосфати. 1.Фізичні властивості нітратної та ортофосфатної кислот. Фізичні властивості ортофосфатної (фосфатної) кислоти. За звичайних умов — тверда, безбарвна, кристалічна речовина. Температура плавлення +42,3 Фізичні властивості нітратної кислоти. Безводна (100%-на) кислота — безбарвна рідина, що сильно пахне, температура кипіння 2.Одержання нітратної та ортофосфатної кислот. Одержання фосфатної кислоти. 1) З її солей, що містяться у фосфатних мінералах (апатитах і фосфоритах), при дії сульфатної кислоти:
2) Гідратацією фосфор(V) оксиду:
Одержання нітратної кислоти. 1) Із сухих солей нітратної кислоти при дії на них концентрованої сульфатної кислоти: 2) Із нітроген оксидів:
3) Промисловий синтез нітратної кислоти:
3.Хімічні властивості нітратної та ортофосфатної кислот.Хімічні властивості фосфатної кислоти. Виявляє всі типові властивості кислот. Фосфатна кислота — триосновна, утворює два ряди кислих солей —дигідрофосфатиігідрофосфати. 1) Дисоціація:
2) Взаємодія з оксидами металів:
3) Взаємодія з основами:
4) Взаємодія із солями. Реакція з аргентум нітратом є якісною на йон випадає жовтуватий осад аргентум фосфату:
5) Взаємодія з металами, що стоять в електрохімічному ряді напруг до Гідрогену:
Хімічні властивості нітратної кислоти. Нітратна кислота — сильний окисник. 1) Дисоціація: 2) Взаємодія з оксидами металів:
3) Взаємодія з основами:
4) Взаємодія із солями:
5) Взаємодія з металами. При взаємодії з металами концентрованої і розведеної нітратної кислоти утворюється сіль (нітрат), нітроген оксиди, азот або амоніак і вода. Ортофосфатна кислоташироко використовується у виробництві мінеральних добрив. Вона не отруйна й використовується в харчовій промисловості для виготовлення сиропів, напоїв (кока-коли, пепсі-коли). Нітратна кислотавитрачається на виробництво нітратних добрив, вибухових речовин, ліків, барвників, пластмас, штучних волокон та інших матеріалів. Концентрована нітратна кислота застосовується в ракетній техніці як окисник ракетного палива. 4.Загальні відомості про нітрати.Солі нітратної кислоти —нітрати. Це тверді кристалічні речовини, добре розчинні у воді, токсичні. Натрій, Калій, Кальцій і амоній нітрати називають такожселітрами. Одержання нітратів. 1) Взаємодія нітратної кислоти з основами:
2) Взаємодія нітратної кислоти з основними оксидами:
3) Взаємодія нітратної кислоти з металами, амоніаком:
4) Взаємодія нітратної кислоти із солями:
Хімічні властивості нітратів. Нітрати мають хімічні властивості, які є типовими для солей (взаємодія з кислотами, солями, основами). Характерним є розклад при нагріванні. Продукти розкладу визначаються місцем металу в електрохімічному ряді напруг. Наприклад:
Якісною реакцією на нітрат-іон
Застосування нітратів. В основному нітрати застосовуються у виробництві добрив, вибухових речовин, нітратної кислоти, а також скла, ліків, для обробки та консервування харчових продуктів. Проблема вмісту нітратів у харчових продуктах. Нітрати лужних металів, крім того, використовують як компоненти ракетного палива та піротехнічних сумішей, для виробництва вибухових речовин, скла, ліків і для обробки та консервування харчових продуктів. Так, нітрат Натрію NaNO3, застосовують (у чітко визначеній нормі!) для готовлення ковбас, шинки, окосту, деяких сортів сиру і риби. Він відновлюється мікроорганізмами до нітриту натрію NaN02, який перешкоджає окисненню м'яса і зберігає рожевий колір м'ясних виробів, поліпшує смак сирів, облагороджує їхній запах. У домашніх умовах використання нітратів і нітритів неприпустиме, бо вживання навіть дещо перевищеної норми цих солей може призвести до порушення функції крові як переносника кисню й створити загрозу для життя. Адже нітрати спричинюють набряк легенів, кашель, блювоту і серцеву недостатність. Нітрити, зокрема NaN02, у шлунково-кишковому тракті утворюють високотоксичні сполуки, що вражають печінку і спричинюють розвиток злоякісних пухлин. На жаль, багато хто вже перебуває під впливом цих високотоксичних сполук. Вони хоч і у невеликих кількостях, але є в забрудненому повітрі та сигаретному диму. Не завадить згадати про нітрити та інші токсичні речовини, перш ніж закурити чергову сигарету. Отже, в сільському господарстві, у харчовій промисловості з нітратами треба поводитися грамотно: неухильно додержувати норм внесення їх у ґрунт, запобігати надлишку нітратів, тоді їх вміст у фруктах, овочах та інших продуктах не перевищуватиме гранично допустимої концентрації (5 мг/кг на добу). Зменшити кількість нітратів можна, якщо всі овочі, плоди, в тому числі цитрусові, перед вживанням ретельно помити гарячою водою, після чого яблука, огірки почистити, а з моркви вирізати серцевину. Зниженню шкідливого впливу на організм нітратів і нітритів сприяє вживання вітамінів, особливо А, Е, В9. 5.Загальні відомості про ортофосфати.Солі фосфатної кислоти —фосфати. Ортофосфатна кислота — триосновна кислота, тому вона утворює три ряди солей: середні —фосфати Одержання фосфатів. Взаємодія ортофосфатної кислоти: 1) з основами:
2) оксидами металів:
3) металами, що стоять в електрохімічному ряді напруг до Гідрогену:
4) солями:
Хімічні властивості фосфатів. Фосфати мають усі типові хімічні властивості солей. Характерними для них є переходи від дигідро- до гідрофосфатів і фосфатів:
Кислі солі, до складу яких входять атоми Гідрогену, утворюються при надлишку кислоти в реакційній суміші. Якісною реакцією на фосфат-йон
Застосування фосфатів. Фосфати в основному застосовуються як мінеральні добрива, а також для виробництва фосфатних кислот, фосфору. Мінеральні добрива.Речовини, що вносяться в ґрунт для підвищення врожайності, називаютьсядобривами. Нітратні добрива поділяються на дві групи: мінеральні (селітри Найважливіші фосфатні добрива: — подвійний суперфосфат — простий суперфосфат — преципітат — фосфоритне борошно Комбіновані добрива містять декілька необхідних рослині елементів, наприклад:
Поиск по сайту: |
 . У твердій і рідкій кислоті молекули поєднуються за рахунок водневих зв’язків. Цим зумовлена підвищена в’язкість концентрованих розчинів фосфатної кислоти. Вона добре розчинна у воді, її розчин — електроліт середньої сили.
. У твердій і рідкій кислоті молекули поєднуються за рахунок водневих зв’язків. Цим зумовлена підвищена в’язкість концентрованих розчинів фосфатної кислоти. Вона добре розчинна у воді, її розчин — електроліт середньої сили. . У разі зберігання на світлі поступово забарвлюється в бурий колір, внаслідок розкладання та утворення вищих нітроген оксидів, у тому числі й бурого газу
. У разі зберігання на світлі поступово забарвлюється в бурий колір, внаслідок розкладання та утворення вищих нітроген оксидів, у тому числі й бурого газу  . Добре змішується з водою в будь-яких співвідношеннях.
. Добре змішується з водою в будь-яких співвідношеннях.



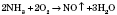 — каталітичне окиснення амоніаку, каталізатор — платина.
— каталітичне окиснення амоніаку, каталізатор — платина. — окиснення киснем повітря.
— окиснення киснем повітря. — поглинання
— поглинання 




 —
—




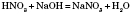
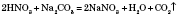








 є нагрівання розчину випробуваної солі з концентрованою сульфатною кислотою і міддю. Сульфатна кислота витісняє нітратну з її солі та реагує з міддю, нарешті спостерігається виділення бурого газу:
є нагрівання розчину випробуваної солі з концентрованою сульфатною кислотою і міддю. Сульфатна кислота витісняє нітратну з її солі та реагує з міддю, нарешті спостерігається виділення бурого газу:

 і два ряди кислих солей —гідрофосфати
і два ряди кислих солей —гідрофосфати  . Кислі солі розчиняються у воді краще, ніж середні.
. Кислі солі розчиняються у воді краще, ніж середні.




 :
: .
. ,
,  ,
,  ,
,  , рідкий амоніак) та органічні (гній, компост, бобові рослини).
, рідкий амоніак) та органічні (гній, компост, бобові рослини). ,
, ,
, ,
, .
. ,
,  — амофоси містять Нітроген і Фосфор. Суміш амофосів із калійною селітрою називається «амофосна» і містить також калій.
— амофоси містять Нітроген і Фосфор. Суміш амофосів із калійною селітрою називається «амофосна» і містить також калій.