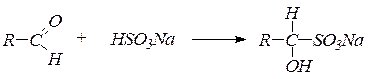|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Химические свойства альдегидов и кетонов ⇐ ПредыдущаяСтр 5 из 5
Химические свойства альдегидов и кетонов определяются наличием карбонильной группы. Двойная связь С=О в карбонильной группе имеет некоторое сходство с двойной связью в этиленовых углеводородах (сочетание s- и p-связей), но отличается сильной поляризацией вследствие различной электроотрицательности образующей ее атомов (С и О). Дипольный момент карбонильной группы – около 2,7D, поэтому углеродный атом карбонильной группы обладает электрофильными свойствами и атакуется нуклеофильными реагентами, в то время как двойная связь в алкенах атакуется электрофильными реагентами. Радикалы, способные увеличить положительный заряд на углеродном атоме, повышают реакционную способность карбонильных соединений. Поляризация связи С=О является основной причиной высокой реакционной способности карбонильных соединений. При этом отрицательно поляризованная часть молекулы атакующего связь С=О реагента присоединяется к электрофильному центру (атому С), в то время как ее положительная часть к кислородному атому. Альдегиды химически активнее, чем кетоны, что связано с меньшей компенсацией положительного заряда на атоме углерода за счет индукционного эффекта одного алкильного радикала против двух у кетонов. Наиболее реакционоспособен по этой причине формальдегид. Характерными реакциями для альдегидов и кетонов являются прежде всего реакции нуклеофильного присоединения по связи С=О. По такому механизму к альдегидам присоединяются такие реагенты, как синильная кислота, гидросульфит натрия, спирты, вода (нестойкие гидраты для большинства альдегидов и кетонов), реактив Гриньяра (магнийгалогеналкилы), водород. 1. Присоединение синильной кислоты с образованием a-оксинитрилов, омылением которых получают a-оксикислоты:
2. Присоединение гидросульфита натриядает кристаллические вещества, называемые бисульфитными производными альдегидов и кетонов:
Реакция с бисульфитом натрия используется для качественного определения альдегидов и кетонов, а также для их выделения и очистки. В реакцию с бисульфитом натрия вступают только метилкетоны. 3. Присоединение воды. В водных растворах карбонильные соединения существуют в равновесии с диолами – продуктами присоединения воды по связи С=О:
Гидраты незамещенных альдегидов и кетонов нестабильны, за исключением гидрата формальдегида СН2(ОН)2. 4. Присоединение спиртов:
полуацеталь
В присутствии следов минеральных кислот образуются ацетали:
ацеталь 5. Присоединение магнийгалогеналкилов,гидролиз которых приводит к получению первичных, вторичных и третичных спиртов соответственно: НСОН + RMgBr ® R-CH2–OMgBr R–CH2-OMgBr + H2O ® R–CH2-OH + Mg(OH)Br R COH + RMgBr ® R2–CH–OMgBr R2-CH-OMgBr + H2O ® R2-CH-OH + Mg(OH)Br R2C=O + RMgBr ® R3COMgBr R3COMgBr + H2O ® R3C-OH + Mg(OH)Br Некоторые реакции присоединения протекают с отщеплением молекул воды. К таковым относятся реакции взаимодействия альдегидов с аммиаком с образованием альдиминов (кетоны подобных соединений не образуют), с гидроксиламином с образованием альдоксимов и кетоксимов, с гидразином с образованием гидразонов. 6. Взаимодействие с аммиаком:
Альдимины легко полимеризуются в циклические альдегидаммиаки, используемые как ускорители вулканизации каучуков:
Взаимодействием формальдегида с аммиаком получают уротропин: 6 НСОН + 4NH3 ® (CH2)6N4 + 6H2O 7. Образование оксимов с гидроксиламином: R – CH = O + H2N-OH ¾® H2O + R-CH = NOH альдоксим R2C = O + H2N-OH ¾® R2C = N – OH + Н2О кетоксим
Эти реакции применяют для количественного определения карбонильных соединений, используя солянокислый гидроксиламин. 8. Взаимодействие с гидразином и его замещенными. В зависимости от условий гидразин образует гидразоны:
или азины (альдазины и кетазины):
9. Реакции полимеризации альдегидов в присутствии следов минеральных кислот. При этом формальдегид может превращаться в параформ: nСН2О ¾® (-CН2О-)n со степенью полимеризации n=8-10, полиформальдегид со степенью полимеризации n=1000, циклический продукт – триоксиметилен:
Полимеризация уксусного альдегида приводит к образованию паральдегида:
паральдегид
10. Реакции конденсации альдегидов, приводящие к образованию альдолей, называют альдольной конденсацией (а). Конденсация, сопровождающаяся отщеплением воды и образованием непредельного альдегида, называется кротоновой конденсацией (б). Альдольная конденсация кетонов протекает в более жестких условиях с образованием b-кетоноспиртов (в):
а) СН3СНО + НСН2СОН ® СН3СН(ОН)СН2СНО 3-оксибутаналь (альдоль)
кротоновый альдегид в) (СН3)2С=О+НСН2-СО-СН3®(СН3)2С(ОН)-СН2-СО-СН3®(СН3)2С=СН-СО-СН3
(4-окси-4-метилпентанон-2) (4-метилпентен-3-он-2)
Из соединений, участвующих в ключевой стадии при альдольной конденсации, одно должно быть донором пары электронов, а другое – акцептором. Альдегиды, не способные к альдольной конденсации, вступают в реакцию Канниццаро (реакция дисмутации альдегидов): 2 (СН3)2СНСНО + КОН ® (СН3)2СНСООК + (СН3)2СНСН2ОН 11. Сложноэфирная конденсация (по Тищенко)в присутствии алкоголятов алюминия приводит к получению из ацетальдегида этилацетата: СН3СНО + СН3СНО ® СН3СООС2Н5 12. Получение пентаэритрита(щелочной катализ): СН3СНО + 3СН2О ® С (СН2ОН)4 13. Замещение карбонильного кислорода хлором при действии РCI5 позволяет получить геминальные дигалогенпроизводные: R2C=О + РСI5 ® R2CCI2 + POCI3 14. Карбонильная группа оказывает активирующее действие на реакционную способность связанных с ней углеродных атомов (особенно a-атомов), вследствие чего для альдегидов и кетоновхарактерны реакции замещения в углеводородном радикале: СН3СН2СНО + CI2 ® CH3CHCICHO Реакции отличаются от реакций галогенирования алканов тем, что протекают в присутствии кислых или щелочных катализаторов. При пропускании хлора через ацетальдегид получается 2,2,2-трихлорацетальдегид (хлораль) –CI3-CH=O, который широко используется в органическом синтезе. 15. Галоформная реакция, индуцируемая основаниями, приводит к получению галоидпроизводных типа СНHaI3 и может служить качественной реакцией на метилкетоны .
Образующийся тригалогенкетон легко атакуется основанием, что приводит к расщеплению С-С связи:
Образование иодоформа (осадок в виде желтых кристаллов) является качественной реакцией на группу СН3СО-. 16. Реакции окисления. Альдегиды окисляются до карбоновых кислот даже такими слабыми окислителями, как аммиачный раствор оксида серебра (реактив Толленса). Эта качественная реакция на альдегиды известна под названием “реакции серебряного зеркала”: RCOH + 2[Ag(NH3)2]OH ® RCOONH4 + 2Ag + 3NH3 + H2O Альдегиды окисляются также феллинговой жидкостью (“реакция медного зеркала”). Кетоны окисляются труднее. Они более устойчивы к слабым окислителям и к кислороду воздуха. При действии сильных окислителей происходит разрыв углеродной цепи и образование смеси кислот. При окислении симметричных кетонов образуется не более двух кислот: [О] СН3-СН2-СО-СН2-СН3 ® СН3-СН2-СООН + СН3СООН Карбоновые кислоты Карбоновыми кислотаминазывают производные углеводородов, содержащие одну или несколько карбоксильных групп - СООН. Карбоновые кислоты классифицируют по числу карбоксильных групп (одноосновные и многоосновные), по количеству атомов углерода (низшие и высшие), в зависимости от строения углеводородного радикала (предельные, непредельные, ароматические, оксикислоты, фенолокислоты, альдегидо- и кетокислоты и другие группы). В соответствии с вышеуказанным различают следующие гомологические ряды карбоновых кислот.
Предельные двухосновные кислоты: НООС-СООН – щавелевая, НООС-СН2-СООН – малоновая, НООС-(СН2)2-СООН – янтарная, НООС-(СН2)3-СООН – глутаровая, НООС-(СН2)4-СООН – адипиновая, НООС-(СН2)5-СООН – пимелиновая, НООС-(СН2)6-СООН – пробковая, НООС-(СН2)7- СООН – азелаиновая, НООС-(СН2)8-СООН – себациновая. Непредельные двухосновные кислоты:НООС-СН=СН-СООН – малеиновая (цис-изомер) и фумаровая (транс-изомер). Ароматические карбоновые кислоты: одноосновные – С6Н5-СООН –бензойная; СН3-С6Н4-СООН – толуиловые кислоты (орто-, мета-, пара-), двухосновные:
фталевая изофталевая терефталевая Предельные жирно-ароматические кислоты:С6Н5-СН2-СООН – фенилуксусная. Непредельные жирно-ароматические кислоты: С6Н5-СН=СН-СООН – коричная Оксикарбоновые кислоты: одноосновные: НО-СООН – оксимуравьиная, угольная; НО-СН2-СООН – гликолевая; СН3СН(ОН)-СООН – молочная; двухосновные: НООС-СНОН-СООН – тартроновая, НООС-СН2-СНОН-СООН – яблочная, НООС-СНОН-СНОН-СООН – винная; НООС-СН2-С(ОН)(СООН)-СН2-СООН – лимонная; ароматические оксикислоты (фенолокислоты):
салициловая о-оксикоричная
Методы получения Карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная кислота – в крапиве, яблочная – в фруктах, сорбиновая – в ягодах рябины, брусники, изовалериановая – в валериановом корне), а также в виде сложных эфиров и жиров. Основным источником получения карбоновых кислот является все же органический синтез. 1. Окисление спиртов, альдегидов, кетонов, углеводородов (см. химические свойства указанных соединений). 2. Оксосинтез: главное направление

Процесс проводят при высокой температуре и давлении в присутствии карбонилов никеля или кобальта (Ni(CO)4, Co(CO)8). 3. Гидролиз нитрилов (R-C=N) в кислой или щелочной среде при нагревании: R-CN + 2H2O ® R-COOH + NH3 4. Гидролиз тригалогенпроизводных: R-CBr3 + 2H2O ® R-COOH + 3HBr 5. Магнийорганический синтез(лабораторные методы): R-Mg-Br + CO2 ® R-COOMgBr R-COOMgBr + HCI ® R-COOH + MgBrCI
Поиск по сайту: |