|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Системы для направленной доставки лекарственных веществ к заданному органу (ткани) – мишени ⇐ ПредыдущаяСтр 3 из 3
На протяжении многих десятилетий проводились (и не прекращаются до сих пор) поиски идеальных систем доставки лекарственных средств, что является вполне объяснимым и объективным фактором. Как известно, заболевания поражают прежде всего отдельные органы и ткани. Так, например, при инфаркте миокарда главные события происходят в мышце сердца, при воспалительном процессе – в конкретных органах-мишенях. Поэтому продолжительность лечения и его успешность напрямую зависят от реализации действия лекарственных препаратов непосредственно в очаге заболевания. Особенно это важно в тех случаях, когда в процессе лечения возникает необходимость применения весьма токсичных препаратов, эффективных в отношении самого заболевания, но при этом оказывающих токсическое действие на другие системы организма. Часто это заставляет отказываться от использования подобных веществ и прибегать к применению менее эффективных препаратов. Создать нужную концентрацию лекарственных веществ в пораженных болезнью местах, не затрагивая остальные, – задача непростая. Ведь медикаменты, каким бы способом их ни вводили, распределяются по всему организму более или менее равномерно. А для того, чтобы они попали в патологический очаг, необходим носитель, который бы доставил препараты к месту назначения. В связи с этим поиски таких идеальных носителей продолжаются и по сей день. В качестве примера можно привести новые системы доставки иммуномодуляторов, факторов роста костной ткани, интерферона, применяемых для лечения злокачественных новообразований, переломов костей и рака легкого соответственно. В настоящее время используются следующие технологические приемы для получения систем, обеспечивающих оптимальные условия транспорта белков к органам-мишеням: 1) заключение лекарственных и вспомогательных веществ в оболочку или гранулу для защиты от преждевременного всасывания; 2) инкапсулирование белков, вакцин и других средств в липосомы, где они располагаются между двумя фосфолипидными слоями системы; 3) связывание субстанции с моноклональными антителами, получаемыми методами генной инженерии; 4) использование интраназалъной системы доставки, когда белки вводят в кровяное русло через слизистую оболочку носа (например, инсулин); 5) введение в организм предшественников лекарственных веществ, способных превращаться в биологически активные субстанции под действием ферментов; 6) использование биодеградируемых систем доставки, состоящих из комплекса лекарственных и полимерных вспомогательных веществ, способных к биодеградации с заданной скоростью; 7) применение трансдермальных систем доставки (включая пластыри), действие которых основано на всасывании лекарственных веществ через кожу; 8) включение лекарственных веществ в природные и синтетические эритроциты; в этом случае лекарственные препараты достаточно долго находятся в кровотоке и эффективно доставляются к мишени. Терапевтические системы с направленной доставкой лекарственных веществ принято подразделять на три группы: 1) носители лекарственных веществ первого поколения (микрокапсулы, микросферы) предназначены для внутрисосудистого введения вблизи определенного органа или ткани; 2) носители лекарственных веществ второго поколения (нано-капсулы, липосомы) размером менее 1 мкм объединяются в одну группу под названием коллоидных носителей. Они распределяются преимущественно в селезенке и печени – тканях, богатых клетками ретикуло-эндотелиальной системы. Разработаны методы получения нано-капсул с фенобарбиталом, диазепамом, преднизолоном, инсулином, простагландинами; нано-сфер с цитостатиками, кортикостероидами; изучаются липосомы для доставки ферментов, хелатирующих и химиотерапевтических, противовоспалительных, противовирусных и белковой природы (инсулина) веществ; 3) носители лекарственных веществ третьего поколения (антитела, гликопротеиды) открывают новые возможности обеспечения высокого уровня избирательного действия и направленной их доставки. В отличии от макро-капсул (например, желатиновых) и микрокапсул (размером 10–500 мкм) нано-носители предназначены не только для перорального, но и для внутривенного (транспорт к органам-мишеням либо длительная циркуляция в кровяном русле), внутримышечного (депо ЛВ или постепенное поступление нано-носителей либо выделяемых ими ЛВ в кровоток). При проведении фармакотерапии главной целью доставки лекарственных средств является сохранение высокого уровня лекарственного препарата в крови. Что же представляют собой нано-носители? Они могут быть двух видов. Первый – собственно нано-частицы, представляющие монолитные, обычно сферические образования, которые содержат ЛВ по всей массе частицы или только на ее поверхности. Выделение ЛВ из нано-частицы происходит постепенно с контролируемой скоростью. К нано-частицам относятся также нано-кристаллы, состоящие только из ЛВ, подвергнутого измельчению до соответствующих размеров, что позволяет им растворяться со скоростью, превышающей скорость растворения частиц более крупных размеров. Существуют липидные нано-частицы (нано-эмульсии) – разновидность жировых эмульсий для подачи ЛВ. Второй вид нано-носителей – нано-капсулы. Это полые сферические контейнеры (толщина стенки ~10–30 нм), содержащие жидкую среду, в которой растворено ЛВ. Высвобождение ЛВ происходит за счет диффузии ЛВ через стенку нано-капсулы или в результате ее разрыва. Скорость высвобождения регулируется дизайном нано-капсул и способом их получения. Взаимодействие нано-носителей с клетками зависит от материала, из которого они изготовлены. Наиболее часто используют нано-кристаллы ЛВ без дополнительного материала; липиды для получения липидных нано-капсул, то есть липосом, и липидных нано-частиц; полимеризованные липиды (полимерные липосомы); термически или химически модифицированный сывороточный альбумин; химически модифицированные полисахариды; биодеструктирующиеся (распадающиеся в организме постепенно) полимеры. Липосомы (от греч. lipos – жир и sоma – тело) – это микроскопические сферические частицы, заполненные жидкостью, оболочка которых состоит из молекул тех же природных фосфолипидов, что и клеточные мембраны. Пальма первенства в выявлении идентичности строения оболочки липосом и клеточных мембран принадлежит мало кому известному в 70-е годы ХХ столетия английскому врачу-патологу Алеку Бэнгхему и соавторам. Именно они в 1965 г. заметили, что фосфолипидные сферулы, или липосомы, устроены "по образу и подобию" мембраны человеческих клеток. Уже тогда было известно, что клеточные оболочки выполняют много функций, поэтому липосомы вначале использовались как модельная система при изучении биологических мембран, а c 1971 г. эти чудо-пузырьки стали использоваться в медицинских целях как средство доставки лекарственных препаратов. Липосомы помогают дольше сохранять высокий уровень концентрации лекарственных препаратов в крови и в клетках, а также способствуют лучшему проникновению препаратов в те области, куда без липосом они попасть не могут. В настоящее время это, пожалуй, наиболее активно развивающееся направление практического использования этих нано-частиц.
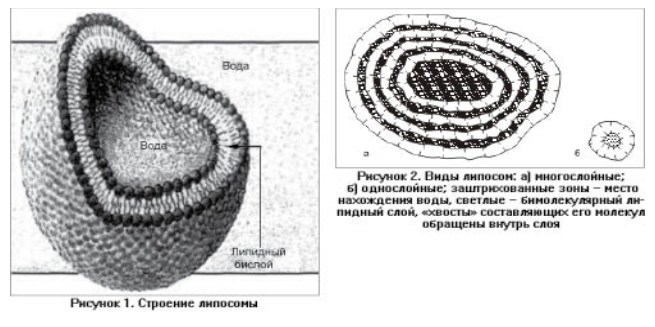
Липосомы в зависимости от размера частиц и числа образующих их липидных слоев (рис. 2) разделяют: 1)на малые моноламеллярные, образованные одиночным липидным бислоем (диаметр 20–50 нм); 2) крупные моноламеллярные, образованные также одиночным бислоем (диаметр 50–200 нм и выше); 3) многослойные (мультиламеллярные), насчитывающие до нескольких десятков и даже сотен липидных бислоев (диаметр до 5000–10 000 нм). В ходе изучения липосом выявлено, что пустующее пространство внутри липосомы может быть заполнено любыми веществами.Липосомы могут быть заполнены антибиотиками, гормонами, ферментами, иммуномодуляторами, цитостатиками, противовирусными и противогрибковыми препаратами, витаминами, вакцинами, веществами метаболического действия и даже генетическим материалом. Свойства липосом Липосомы обладают огромным количеством преимуществ по сравнению с другими лекарственными формами. Наиболее значимые из них: 1. Уникальная способность доставки лекарственных препаратов внутрь клеток (взаимодействия липосом с клетками). Формы взаимодействия могут быть самыми разными, наиболее простая: липосомы адсорбируются (прикрепляются) на поверхности клетки. Процесс на этом может закончиться, а может пойти дальше: при определенных условиях клетка может поглотить липосому (этот процесс "заглатывания" называется эндоцитоз), и тогда вместе с ней внутрь клетки попадают вещества, находящиеся внутри липосомы (внутриклеточная доставка). Наконец, они могут слиться с мембранами клеток и стать их частью. При этом свойства клеточных мембран могут изменяться: например, их вязкость и проницаемость, величина электрического заряда. Может также увеличиваться или уменьшаться количество каналов, проходящих через мембраны. Таким образом, благодаря липосомам появился новый способ направленного воздействия на клетку, который называется мембранной инженерией. 2. Биосовместимость: сродство с мембранами клеток по химическому составу. С точки зрения биологической совместимости липосомы идеальны как переносчики лекарственных препаратов, так как их мембрана состоит из природных фосфолипидов, составляющих от 20 до 80 % их массы. 3. Отсутствие аллергических реакций: липосомы, лишенные свойств антигена, надежно укрывают свой "груз" от контакта с иммунной системой и, соответственно, не вызывают антигенной стимуляции. 4. Защита лекарственного препарата от деградации в организме. Как уже отмечалось, липосомы выступают в качестве своеобразного контейнера, надежно защищая свое содержимое от повреждающего воздействия внешних факторов, в частности от разрушения в желудочно-кишечном тракте, что обеспечивает доставку препарата к месту назначения и продление времени его действия. 5. Изменение фармакокинетики препаратов и повышение их терапевтической эффективности. 6. Снижение общетоксического действия на организм: защита клеток от токсического действия лекарств, заключенных в липосомы. 7. Универсальность: "адресная" доставка препарата к органу-мишени, что достигается путем прикрепления к поверхности липосом специфических молекул (например, Ig), обеспечивающих "узнавание" клетки. 8. Биодоступность. Этот эффект липосом обеспечивается за счет создания водорастворимых форм ряда лекарственных веществ. 9. Способность к биодеградации. Липосомы сравнительно легко разрушаются в организме, высвобождая доставленные вещества. 10. Эффект пассивного нацеливания: направленная доставка и накапливание медикаментозных препаратов в очагах воспаления, ишемии, опухолях и других патологически измененных областях.
Применение липосом Как носители лекарств липосомы наиболее широкое применение получили в экспериментальной онкологии. Суть в том, что существует ряд препаратов, весьма эффективно разрушающих злокачественные клетки или тормозящих их рост. Однако применить их в терапевтических целях не всегда возможно из-за их большой токсичности или плохой растворимости в воде. С помощью липосом эти трудности можно преодолеть. Так, в одной лаборатории с помощью липосом вводили мышам, больным лейкемией, не растворяющиеся препараты и наблюдали замедление роста числа злокачественных клеток. Другие исследователи нагружали липосомы антрациклинами: эти вещества активны против широкого круга злокачественных опухолей, но весьма ядовиты для остальных тканей, особенно для сердечной мышцы, – и вредное воздействие этих соединений значительно снижалось, что, как следствие, позволяло существенно увеличивать их дозы. Липосомы можно использовать и для борьбы с инфекционными заболеваниями. Весьма показательными в этом плане могут служить экспериментальные данные по лечению лейшманиоза – заболевания, широко распространенного в южных странах, где различными его формами страдает около 100 миллионов человек. Болезнь поражает печень, селезенку, костный мозг. Обычный лейшманиоз лечат препаратами сурьмы, которые весьма токсичны. Но когда их ввели экспериментальным животным с помощью липосом, то они стали подавлять размножение возбудителей болезни в клетках печени в сотни раз эффективнее, чем обычно, а токсическое действие на сердце и почки заметно снизилось, что позволило увеличить дозу препарата. Сходные результаты были получены и при лечении похожих на лейшманиоз грибковых заболеваний – криптококкоза и гистоплазмоза. Ограничения Однако ситуация с терапевтическим применением липосом не так проста, как хотелось бы. Использование липосом для точной, целенаправленной доставки лекарственных веществ имеет определенные ограничения. Эффективность их использования как носителей лекарств во многом зависит еще и от того, сумеют ли они сохранить свою целостность после введения в организм. Оказалось, что липосомы недостаточно стабильны в крови. Время пребывания обычных липосом в кровотоке невелико (от нескольких минут до нескольких часов). Дело в том, что у них имеется весьма серьезный "враг" – сыворотка крови, и после попадания в организм большая часть липосом поглощается клетками ретикулоэндотелиальной системы (РЭС), состоящей в основном из макрофагов, способных поглощать из крови посторонние частицы и уничтожать (переваривать) их, что необходимо для поддержания постоянства внутренней среды. Кратковременность пребывания липосом в кровотоке напрямую связана с взаимодействием липосом с белками плазмы – опсонинами (в основном компонентами комплемента). Опсонины как бы метят их и делают мишенями для клеток РЭС . Поэтому липосомы, попадая в кровоток, как правило, становятся добычей макрофагов и не доходят до цели. Наибольшее скопление макрофагов находится в печени, селезенке, костном мозге, лимфатических узлах и кровотоке. Поэтому липосомные носители обычно сложно направить именно в те органы и ткани, где разворачивается патологический процесс. Однако нет ничего такого, что бы остановило ученых в поисках решения, казалось бы, нерешаемого вопроса. Уже сейчас найдены способы, позволяющие увеличить устойчивость липосом к действию липопротеинов. Например, повышению их устойчивости способствует введение в состав липосом холестерина. Есть и другие варианты изменения их состава, позволяющие успешно защищать липосомы от разрушения сывороткой крови. Как выяснилось, если эти везикулы соединены с антителами к белкам-адресатам, то большая часть липосом успевает прибыть к месту назначения раньше, чем произойдет их встреча с макрофагом. Еще более значимыми будут результаты в ситуации, когда вначале вводятся липосомы без "груза" (например, липин), а следом – липосомы с лекарством, тогда первые поглощаются макрофагами, а вторые без помех доходят до цели. Для преодоления захвата липосом мононуклеарами РЭС были разработаны также липосомы-невидимки. Выяснилось, что клетки, вылавливающие липосомы из крови, можно обмануть, сделав поверхность липосом гидрофильной. С этой целью в липидный слой липосом встраивают полиэтиленгликоль (ПЭГ), что приводит к повышению осмотического давления вокруг них и препятствует сближению нано-частиц с клеткой. Эти везикулы называются пегилированными липосомами, они невидимы для клеток РЭС и долгое время циркулируют в крови. Помимо этого, что еще более важно, такие липосомы постепенно накапливаются в тех местах, где кровеносные сосуды имеют дефекты, т.е. повреждены, обладают повышенной проницаемостью или вообще плохо развиты, что обычно характерно для опухолей и окружающих их тканей, а также инфекционных и воспалительных процессов. Необычные свойства полиэтиленгликольсодержащих липосом и их высокая терапевтическая эффективность так поразили исследователей, что эти липосомы получили образное название липосомы-невидимки (stealth liposomes) аналогично известному самолету-невидимке "стелс", который не удается обнаружить с помощью радарных устройств. Таким образом, постепенно складывается модель "идеальной" липосомы, как средства направленной доставки лекарственного вещества в клетку. Такая липосома содержит во внутреннем объеме лекарственное вещество, например, ДНК в случае генной терапии, на ее поверхности иммобилизованы гибкие цепи полимера для уменьшения поглощения клетками РЭС, молекулярный адрес, в мембрану инкорпорированы белки слияния. Кроме того, мембрана состоит не только из обычных фосфолипидов, образующих бислой (чаще фосфатидилхолина), но и липидов, способствующих слиянию с мембраной клетки (например, диолеоилфосфатидилэтаноламина). Конечно, не следует думать, что широкие клинические испытания липосом можно начать уже сегодня. Для этого следует решить еще ряд проблем. Одной из них является способ введения липосом. Так, вряд ли следует рекомендовать внутривенное, хотя и весьма эффективное, их введение, ибо существует некоторая опасность закупорки сосудов (эмболии). Меньше опасений вызывают внутримышечное и подкожное их введения, и особенно – через рот, так как из сказанного выше понятно, что в ряде случаев липосомы с заключенными в них веществами способны проходить через стенки желудочно-кишечного тракта. Такой способ введения липосом в организм, по-видимому, безвреден. Серьезную проблему представляет стерилизация липосом. Пока что наиболее приемлемым способом следует считать стерилизацию липосом с помощью таких фильтров, поры которых пропускают только молекулы липидов и задерживают микроорганизмы. Весьма существенны также сроки хранения липосом после их приготовления. Пока они невелики. Но, видимо, и эта проблема вскоре будет решена, так как недавно найден способ сушки предварительно замороженных липосом. Такие высушенные липосомы, содержащие лекарственные вещества, способны храниться достаточно долго: месяцы и годы. Для их использования достаточно прилить к ним тот объем воды, который был удален при сушке.
Заключение Носители лекарственных веществ третьего поколения (антитела, гликопротеиды) открывают новые возможности обеспечения высокого уровня избирательного действия и направленной их доставки. Антитела – белки глобулиновой фракции сыворотки крови человека и теплокровных животных, образующиеся в ответ на введение в организм различных антигенов (бактерий, вирусов, белковых токсинов и др.). Антитела используют в комплексе с противоопухолевыми и противовирусными средствами, они позволяют "узнать" антигены на поверхности злокачественных клеток или клеток, поврежденных вирусом. Гликопротеиды – белковые комплексы с углеводпептидной связью. Углеводная часть связана с функцией векторов протеидов. Рецепторы, взаимодействующие с гликопротеидами, локализуются в гипоцитах, лейкоцитах, щитовидной железе, фибробластах, макрофагах, а также ретикулоцитах. Для транспорта и локальной доставки лекарственных веществ к органу – мишени могут быть использованы магнитоуправляемые системы. Метод магнитоуправляемого транспорта основан на способности коллоидных частиц магнитного материала перемещаться и концентрироваться в необходимом участке организма под действием магнитного поля. Это позволяет избирательно концентрировать магнитные частицы с нанесением на их поверхность лекарственных веществ непосредственно в тканях пораженного органа. В магнитоуправляемых системах направленного действия сывороточный альбумин исполняет роль матрицы – носителя лекарственных средств и одновременно коллоидных частиц железа оксида, что и обуславливает их чувствительность к воздействию магнитного поля. Пероральное введение этой лекарственной формы может оказаться неэффективным из-за связывания альбумина матрицы в печени или селезенке. Поэтому наиболее рационально использовать такую лекарственную форму в виде внутривенных инъекций. Метод получения магнитных лекарственных форм заключается в денатурировании вокруг коллоидных частиц оксидов железа альбуминовой матрицы, содержащей лекарственное вещество. Выведение магнитных микрочастиц осуществляется главным образом почками. В настоящее время магнитные лекарственные формы проходят испытания на животных. Их предполагается использовать в клинической медицине для лечения онкологических заболеваний, эмболии легкого, тромбофлебита. Существуют и другие проблемы в фармацевтической технологии, решение которых может привести к созданию более совершенных лекарственных препаратов, а следовательно и к более высокой из терапевтической эффективности, например, создание возрастных лекарств, повышение микробной чистоты лекарств, создание более прогрессивной тары и таро укупорочных материалов, внедрение малоотходных и экологически чистых технологий, дальнейшее развитие биотехнологии и так далее, что, в свою очередь, шаг за шагом будет повышать качество и терапевтическую эффективность лекарств.
Список использованной литературы 1. Васильев А.Е. Системы доставки лекарственных веществ с контролируемым высвобождением. 2003 2. В. И. Швец, академик АМН России, Ю. М. Краснопольский, д. фарм. н. Липосомы в фармации. Продукты нанобиотехнологии// Журнал "Провизор" №3, 2008 3. Третьякова О.С., Заднипряный И.В. Крымский государственный медицинский университет им. С.И. Георгиевского, Нанотехнологии в практике кардиолога Часть I Липосомы как идеальные средства доставки лекарственных препаратов// Журнал "Здоровье ребенка" 3(18) 2009 4. Г. Кобринский, доктор медицинских наук, Липосомы в медицине//2014 5. Энциклопедический справочник. Современные лекарства. – М.: Русское энциклопедическое товарищество, 2005// М.: ОЛМА-ПРЕСС, 2005 6. Васильев А.Е., Краснюк И.И., Равикумар С., Тохмахчи В.Н. Трансдермальные терапевтические системы доставки лекарственных веществ (обзор)// Хим-Фарм. Ж. – 2001 7. Львова Л.В. Трансдермальные терапевтические системы. Провизор №17, 2004 8. Мизина П.Г., Быков В.А., Настина Ю.И., Фоменко Е.А. Введение лекарственных веществ через кожу – достижения и перспективы (обзор)//Вестник ВГУ. Серия: Химия, Биология, Фармация. 2004 9. Чуешов В.И. Промышленная технология лекарств. Т-2// Издательство МТК-книга, 2002 10. Трансдермальные терапевтические системы// Опубликовано в журнале: Качественная клиническая практика 1/2001 11. Кочеровец В.И., Бунятян Н.Д. Шилова И.Б Современные топические препараты клиндамицина и метронидазола (в начале) // Учебное пособие, АКТЕОН, 2012
Поиск по сайту: |