 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Розрахунки матеріальних потоків в технології металічного титану
МІНІСТЕРСТВО НАУКИ ТА ОСВІТИ УКРАЇНИ ДЕРЖАВНИЙ ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД «УКРАЇНСЬКИЙ ДЕРЖАВНИЙ ХІМІКО-ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ»
МЕТОДИЧНІ ВКАЗІВКИ
ДО ОРГАНІЗАЦІЇ ПРАКТИЧНИХ ЗАНЯТЬ ТА САМОСТІЙНОЇ РОБОТИ З ДИСЦИПЛІНИ «ХІМІЧНА ТЕХНОЛОГІЯ РІДКІСНИХ ТА РОЗСІЯНИХ ЕЛЕМЕНТІВ» ДЛЯ СТУДЕНТІВ III-IV КУРСІВ ДЕННОЇ ФОРМИ НАВЧАННЯ ФАКУЛЬТЕТУ ТЕХНОЛОГІЇ НЕОРГАНІЧНИХ РЕЧОВИН
Дніпропетровськ ДВНЗ УДХТУ 2012 Методичні вказівки до організації практичних занять та самостійної роботи з дисципліни «Хімічна технологія рідкісних та розсіяних елементів» для студентів ІІІ-IV курсів денної форми навчання факультету технології неорганічних речовин / Укл.: О.В. Кожура, О.О. Пасенко .- Дніпропетровськ: УДХТУ, 2010.-46с.
Укладачі: О.В. Кожура, к.х.н. О.О. Пасенко к.т.н.
Відповідальні за випуск О.А. Півоваров, д.т.н.
Навчальне видання
Методичні вказівки до організації практичних занять та самостійної роботи з дисципліни «Хімічна технологія рідкісних та розсіяних елементів» для студентів ІІІ-IV курсів денної форми навчання
Розрахунки матеріальних потоків в технології металічного титану Розміри апаратів і газоходів, виходу, витратні коефіцієнти вихідних і кінцевих продуктів хлорування визначають за даними розрахункового матеріального балансу. Для розрахунку матеріального балансу необхідно мати в своєму розпорядженні наступні вихідні дані: - склад вихідної сировини, анодного хлор-газу і нафтового коксу, ступінь хлорування компонентів вихідної сировини; - співвідношення СО:СО2 в газах, що відходять; - розподіл продуктів хлорування по апаратах технологічної схеми. За відсутності необхідних даних роблять ті або інші припущення. Методика розрахунку матеріального балансу наступна: 1. Складають таблиці з вихідними даними (склад шлаку, коксу, анодного хлор-газу; молекулярна маса кінцевих і вихідних продуктів; міра хлорування компонентів шлаку і ін.). 2. Визначають технологічні умови проведення процесу: продуктивність за годину, вихід продуктів, швидкість газового потоку, температурний режим хлорування і конденсації. 3. Обчислюють витрату хлору з врахуванням міри хлорування компонентів титанвміщуючої сировини. 4. Складають рівняння хімічних реакцій. 5. Обчислюють кількість кисню, що вноситься оксидами і анодним хлор-газом. 6. Обчислюють кількість вуглецю,що необхідна для скріплення кисню оксидів і анодного хлор газу. Кількість вихідних і кінцевих реагентів (хлоридів хлору, вуглецю) визначають, виходячи з хімічного складу хлорованої сировини, ступені хлорування оксидів і стехіометричних коефіцієнтів реакції, за формулою: де
m- стехіометричний коефіцієнт шуканого компонента;
Кількість непрохлорованного залишку обчислюють за різницею між кількістю оксидів, що прореагували в хлорат. Аналогічним чином знаходять кількість кисню. Кількість прореагованого вуглецю визначають зі співвідношення СО:СО2 в відведених газах. При розрахунку складу шихти умовно приймають, весь кисень окислів і анодного хлор-газу зв'язується до СО. У реальних же умовах в відведених газах завжди присутній СО2. Таким чином, вже при розрахунку шихти передбачається надлишок вуглецю. У загальному вигляді вихід непрохлорованого залишку може бути виражений формулою:
Стехіометричні рівняння процесу складають, виходячи з конкретних температурних умов процесу, типу хлорування всіх складових шихти (включаючи летючі коксу або брикетів), знаходять виходячи зі складу анодного хлор-газу, а також вихід усіх хлоридів (з урахуванням ступеня хлорування оксидів). Всі розрахунки матеріального балансу найзручніше вести спочатку 100 кг шлаку, а потім виходячи із заданої продуктивності визначити часовий матеріальний потік, основні видаткові коефіцієнти, витрата вихідних і вихід кінцевих продуктів хлорування на одну тонну чотирихлористого титану. Приклад. Для розрахунку прийнятий шлак, отриманий безфлюсовою плавкою. Склад шлаку, ступінь хлорування оксидів і їх молекулярна маса наведено в табл. 19. Склад анодного хлор-газу,% (объем.): 70,0 СI2; 23,43 N2 ;6,285 О2. Таблиця 19 Вихідні дані для розрахунку матеріального балансу
Співвідношення СО: СО2 в відведених газах прийнято рівним 8:1. Хлорування шлаку проводиться у шахтному хлорат добовою продуктивністю 100 т / добу. Основні реакції хлорування: Ti3O5 TiO2+2C+2Cl2=TiCl4+2CO, FeO+C+ Al 2O3+3C+3Cl2=2AlCl3+3CO, MgO+C+Cl2=MgCl2+CO, CaO+C+Cl2=CaCl2+CO, MnO+C+Cl2=MnCl2+CO, SiO2+2C+2Cl2=SiCl4+2CO, V2O3+3C+3Cl2=2VOCl3+3CO, Cr2O3+3C+3Cl2=2CrCl3+3CO, Cr2O3+3C+3Cl2=2CrCl2+3CO. а) Розрахунок кількості хлору ведемо за формулою:
Ti3O5 0,336 TiO2 FeO Al2O3 MgO CaO MnO SiO2 V2O3 Cr2O3
б) Розрахунок кількості кисню ведемо за формулою:
Ti3O5 0,336 TiO2 FeO Al2O3 MgO CaO MnO SiO2 V2O3 Cr2O3
До цієї кількості потрібно додати кисень, внесений з анодним хлоргазом. Його знаходять виходячи із загального хлору і складу анодного хлор газа за формулою:
де
Загальна кількість кисню буде складати: 35б9701+7,2492=43,2193 в)Кількість вуглецю можна підрахувати двома способами: 2СО+О2=2СО 2
г) При розрахунку кількості хлоридів прийнято наступне: Ti3O5 0,336 TiO2 FeO FeO Al2O3 MgO CaO MnO SiO2 V2O3 Cr2O3 Cr2O3
Ця кількість виходить з 100 кг шлаку. На практиці більш зручно розраховувати вихід хлоридів на 1т товарного тетрахлориду титану. Для цього визначають наступні дані: 1.Вихід з 100 кг шлаку з урахуванням втрат на переділах хлорування (η_ (хл) = 99%), конденсації (П_ (конд) = 2,0),очищення від ванадію (П_ (v) = 0,8). Зазвичай вони складають в суммі, 6-7%. Таким чином, витяг титану в товарний технічний тетрахлорид титану складає близько 94%; 2. Перерахунковий коефіцієнт К, який дорівнює частці від ділення 1000 кг на вихід товарного технічного тетрахлориду титану:
3.Витратні коефіцієнти на одну тонну технічного тетрахлориду титану:
4) Вихід непрохлорованого залишку на 1 т тетрахлориду титану знаходять, виходячи зі ступеня хлорування основних компонентів шлаку і ступеня використання вуглецю, останню величину знаходять із співвідношення CO: CO2 у газах. TiO2 FeO Al2O3 Ti3O5 5,11 MgO CaO MnO SiO2 V2O3 Cr2O3
Визначаємо кількість вуглецю у відхідних газах:
6С+3,5О2=5СО+СО2
У непрохлорований залишок йде вуглецю: 32,4145-28,4908=3,9237кг, або на 1т TiCl4:3,9237 Таким чином, на 1т технічного тетрахлориду титану залишається непрохлорованого залишку 13,3813+20,0501=33,4314кг. Розділивши кількість кожного компоненту на загальну кількість залишку, знаходять його розрахунковий склад, %:23,43 TiO2;0,62 FeO;0,37 Al2O3; 0,24 MgO;0,19 CaO;0,20 MnO;13,12 SiO2;0,04 V2O3;0,03 Cr2O3; 59,98 C. Склад і кількість газів, що відходять. Знаючи склад анодного хлор газа і його витрати, а також співвідношення СО: СО2 в відведених газах, знаходять вихід газів (м3 при нормальних умовах на 1 т тетрахлориду титану). Кількість азоту визначаємо за формулою:
де К-перерахунковий коефіцієнт з 100 кг шлаків на 1т TiCl4.
Сумарний об’єм газів:
Крім цього, в відведених газах міститься в результаті хлорування летючих 10-15% (об’єм.) повітря. Таким чином, загальна кількість газів складає:
з них хлороводню 450,0 ∙ 0,08 = 36,0 м3, повітря в тому числі: азоту 36,0 Знаючи об`єм кожного з компонентів і сумарний об`єм, знаходять розрахунковий склад газів, що відходять,% (об`ємн.)
вміст компоненту в газовій суміші.
Для хлоратора заданої добової продуктивності часовий матеріальний потік на одну тонну тетрахлориду титану знаходять, множенням годинної продуктивності на витратні коефіцієнти. Так, для хлоратора добовою продуктивністю 100 т часовий матеріальний потік складе: TiCl4 100/24=4,170 т/ч, шлак 0б511 кокс 0,165 хлор 0,910 тверді хлориди 0,146 відходять гази 450,0 в тому числі : СО 220,08 Основна маса низьколетючіх хлоридів кальцію, магнію, хрому, марганцю і двовалентного заліза осідає в 1-й (50-46%) і в 2-й (32-29%) пилевих камерах, а у зрошувальний конденсатор потрапляють 20-25%. Порівняно леткі хлориди уловлюються в основному в зрошувальних конденсаторах, або на рукавних фільтрах: хлористий алюміній і хлорне залізо, оксихлорсілани, гексахлорбензол 90%, тетрахлорид кремнію і окситрихлорид ванадію 50-60%. Останні чотири речовини добре розчиняються у тетрахлориді титану; хлорне залізо, хлорид алюмінію, а також хлористому вуглеці у вигляді твердої суспензії. Тверді хлориди 1-ї пилової камери: кг % FeCl2 FeCl3 AlCl3 MnCl2 CaCl2 MgCl2 CrCl3 CrCl2 непрохлорований залишок вторинний
SiO2
Тверді хлориди 2-ї пилової камери: кг % FeCl2 FeCl3 AlCl3 MnCl2 CaCl2 MgCl2 CrCl3 CrCl2 SiO2 непрохлорований залишок
Циркуляційна пульпа
кг % TiCl4 1000 SiCl4 VOCl3
Тверді хлориди кг %ψ FeCl2 FeCl3 AlCl3 MgCl2 CaCl2 MnCl2 CrCl3 0,776 CrCl2
Відношення ж: т в циркуляційній пульпі 1-го зрошувального конденсатора:
2-й зрошувальний конденсатор кг % TiCl4 1000 SiCl4 68,87 VOCl3 0,594
Хвостовий теплообмінник кг % TiCl4 SiCl4
Межа очищення тетрахлориду титану
кг % TiCl4 0,98(800+150+50)=980,00 96,00 SiCl4 20,64+6,89+3,45=30,98 3,04 VOCl3 1,20+0,18=1,38 0,14
Тверді хлориди кг % AlCl3 53,00 FeCl2 4,85 FeCl3 15,80 MgCl2 3,82 CaCl2 2,50 MnCl2 2,32 CrCl3 0,155
Знаходимо вміст твердого рахуючи
Витрату мідного порошку приймаємо з розрахунку 2,5 кг на кожний кілограм розчиненого у TiCl4 окситрихлорида ванадію. H2O+TiCl4=TiOCl2+2HCl
18 189,9 134,8 x=
Вихід оксихлорида титану х=
Ректифікація (прийняті втрати TiCl4 1%) TiCl4 980-13,5=966,5 кг 96,89%
SiCl4 30,98 3,11%
Вихід TiCl4 TiCl4 966,5-10,0=956,5.
Дистиляція (прийняті втрати TiCl4 0,5%) 956,5-5=951,5 кг TiCl4. Разом виходить в дистиляті 0,951 ∙ 0,980= 93,2%. Розрахунки матеріальних потоків на прикладі процесу одержання WO3
Розрахувати добову витрату матеріалів та коефіцієнти витрат (витрата на 1кг готової продукції) для виробництва вольфрамового ангідриду з розчину вольфрамату натрію. Вихідні дані: а)1. Продуктивність цеху – 3000 т/рік WO3. 2. Кількість робочих днів у році – 340. 3. Втрати по операціям: а) очищення від домішок – 1,5%; б) осадження вольфрамату кальцію – 0,8%; в) розкладення вольфрамату кальцію та промивання вольфрамової кислоти – 1,2%; г) сушка та прожарювання вольфрамової кислоти – 0,6%. 4. Склад розчину у г/л: 120,0 WO3; 12,0 Mo; 70,0 Na2CO3; 0,7 SiO2; 5,0 F. 5. Гідроліз кремнієвої кислоти проводять при залишковому вмісті Na2CO3 – 5,0 г/л. 6. Очищення розчину від фтору проводять до вмісту фтору у розчині 1,0 г/л. 7. Витрата хлористого магнію та хлористого кальцію – 110% від теоретично необхідної кількості. 8. Витрата сірчистого натрію – 130% від теоретично необхідної кількості, осадження трисульфіду молібдену проводять при кислотності розчину 1,0 г/л HCl. 9. Витрата HCl для розкладення вольфрамату кальцію – 180% від теоретично необхідної кількості.
Розв’язок Наводимо рівняння реакцій які відбуваються під час процесу Na2CO3 + 2HCl → 2NaCl + H2O + СO2 Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl MgCl2 + 2NaF → MgF2↓ + NaCl Na2MoO4 + 3Na2S + 8HCl → MoS3↓ + 8NaCl + 4H2O Na2S + 2HCl → H2S↑ + 2NaCl CaCl2 + Na2WO4 → 2NaCl + CaWO4 CaWO4 + 2HCl → CaCl2 + H2WO4 H2WO4 → WO3 + H2O
1. Розрахуємо об’єм вихідного розчину Na2WO4. Для цього враховуємо всі втрати при заданій продуктивності. Добова продуктивність: Pдоб(WO3) = 3000000/340 = 8823,5 кг/добу Необхідні надходження Na2WO4 за добу у перерахунку на WO3
2. Визначаємо об’єм розчину:
Визначаємо масу домішок, що надходять з розчином вольфрамату натрію m(Mo) = Vр-ну ∙ С(Mo) = 76,6м3/добу ∙ 12 кг/м3 = 919,2 кг/добу m(Na2CO3) = 76,6 м3/добу ∙ 70 кг/м3 = 5362 кг/добу m(SiO2) = 76,6 м3/добу ∙ 0,7 кг/м3 = 53,6 кг/добу m(F-) = 76,6 м3/добу ∙ 5 кг/м3 = 383 кг/добу
3.Cтадія очищення від домішок: 3.1. Нейтралізація та знекремлювання розчину. На гідроліз кремнієвої кислоти витрачається соляної кислоти: Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl m(HCl) = Нейтралізація надлишку соди : Na2CO3 + 2HCl → 2NaCl + H2CO3 m(Na2CO3) = (70-5)∙ 76,6 м3/добу = 4979 кг/добу m(HCl) = 3.2.Осадження F-: MgCl2 + 2NaF → MgF2 + NaCl m(F-) = (5-1)∙76,6 = 306,4 кг/добу m(MgCl2) = З урахуванням надлишку: m(MgCl2)= 346,5 ∙ 1,1 = 381,2 кг/добу
3.3.Розділення Mo і W: Надлишок соляної кислоти на розкладання надлишку соди: Na2CO3 + 2HCl → 2NaCl + H2О + CO2 m(Na2CO3) = 5 ∙ 76,6 = 383 кг/добу m(HCl) = Na2MoO4 + 3Na2S + 8HCl → MoS3↓ + 8NaCl + 4H2O m(HCl) = необхідний надлишок соляної кислоти m(HCl) = 1 ∙ 76,6 = 76,6 кг/добу m(Na2S) = З урахуванням надлишку: m(Na2S) = 2240,6 ∙ 1,3 = 2912,8 кг/добу Na2S + 2HCl → H2S↑ + 2NaCl m(Na2S) = 2912,8 -2240,6 =672,33 кг/добу m(HCl) =
3.4.Осадження CaWO4 : CaCl2 + Na2WO4 → 2NaCl + CaWO4 m(Na2WO4) = 9195 ∙ (1- 0,015)·M(Na2WO4)/M(WO3) = 11477,5 кг/добу m(CaCl2) = З урахуванням надлишку: m(CaCl2) = 4333,3 ∙ 1,1 = 4776,6 кг/добу З урахуванням втрат m(СaWO4) = = 3.5.Розкладання осаду: CaWO4 + 2HCl → CaCl2 + H2WO4 m(HCl) = З урахуванням надлишку: m(HCl) = 2827 ∙ 1,8 = 5088,6 кг/добу
CaWO4 + 2HCl → CaCl2 + H2WO4
m(H2WO4) = З урахуванням втрат m(H2WO4) = 9681,7 ∙ 0,988 = 9565,5 кг/добу
3.6.Одержання WO3: H2WO4 → WO3 + H2O↑ m(WO3) = З урахуванням втрат m(WO3) =8876,7 ∙ 0,994= 8823,45 кг/добу 4.Сумарна витрата HCl: m(HCl)=65,2+3428,9+2795,9 +76,6 +263,8+629,2+5088,6=12348,2 кг/добу
Поиск по сайту: |
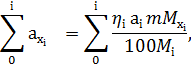

 -ступінь використання оксидів (вихода) ,%;
-ступінь використання оксидів (вихода) ,%;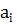 - зміст компонента у вихідному продукті, % (по масе);
- зміст компонента у вихідному продукті, % (по масе); –
– 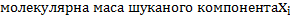 ;
; - молекулярна маса компонента.
- молекулярна маса компонента.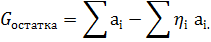

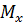
 2
2  3TiCl4
3TiCl4  5CO;
5CO;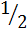 Cl2=FeCl2+CO,
Cl2=FeCl2+CO,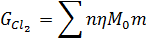
 6
6 
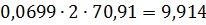
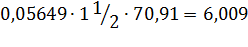
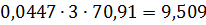


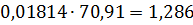
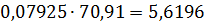

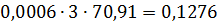
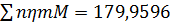 кг
кг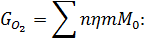
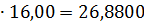

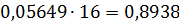
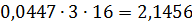
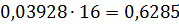

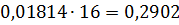

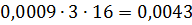
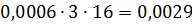
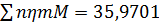 кг.
кг.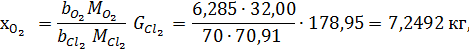
 ;
; ;
;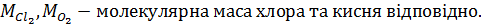

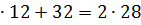
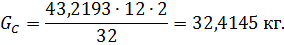
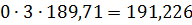
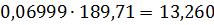

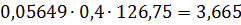


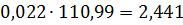

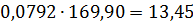
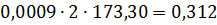
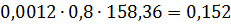
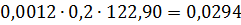

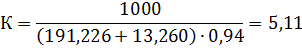
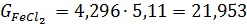
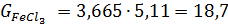
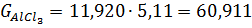
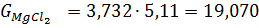

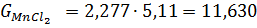
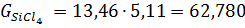
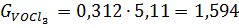


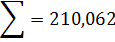

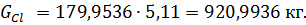
 кг.
кг.
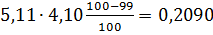
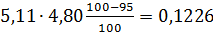

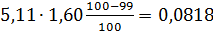



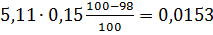
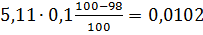
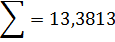
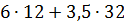
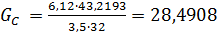 кг.
кг. кг.
кг. м3,
м3,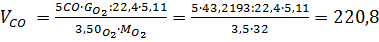 м3,
м3, м3.
м3.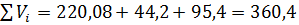 м.3
м.3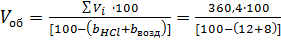 =450,0 м3.
=450,0 м3. м3 та кисню 36,
м3 та кисню 36, 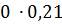 =7,6 м3.
=7,6 м3.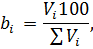

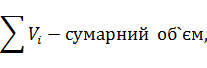
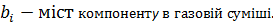
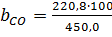 =49,0
=49,0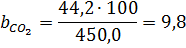
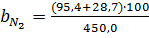 =27,5
=27,5 =1,7
=1,7
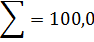
 т/ч,
т/ч,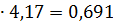 т/ч,
т/ч,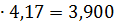 т/ч,
т/ч,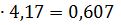 т/ч,
т/ч, т/ч,
т/ч, м3
м3 21,80
21,80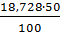 =9,360 1,90
=9,360 1,90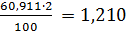 2,45
2,45 =5,820 11,60
=5,820 11,60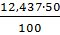 = 6,240 12,45
= 6,240 12,45 18,80
18,80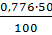 =0,390 0,80
=0,390 0,80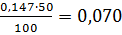 0,15
0,15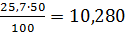 20,40
20,40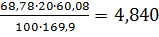 9,65
9,65 100,0
100,0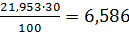 21,15
21,15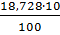 =1,873 5,70
=1,873 5,70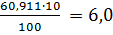 91 18,60
91 18,60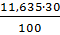 =3,490 10,65
=3,490 10,65 = 3,742 11,42
= 3,742 11,42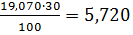 17,45
17,45 =0,233 0,71
=0,233 0,71 0,13
0,13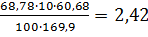 7,32
7,32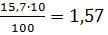 7,82
7,82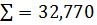 100
100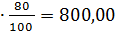 97,37
97,37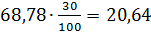 2,51
2,51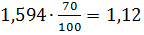 0,12
0,12 100
100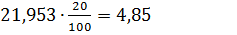 5,85
5,85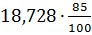 =15,80 19,20
=15,80 19,20 64,22
64,22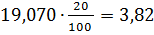 4,63
4,63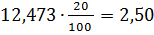 3,08
3,08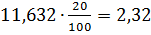 2,80
2,80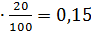 0,19
0,19 0,03
0,03 100
100 =
= 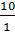
 95,50
95,50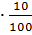 =6,89 4,36
=6,89 4,36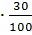 =0,18 0,14
=0,18 0,14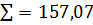 100
100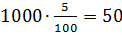 93,75
93,75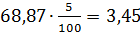 6,26
6,26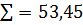 100
100 99,18
99,18 0,52
0,52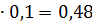 0,05
0,05 0,16
0,16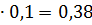 0,04
0,04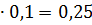 0,02
0,02 0,02
0,02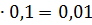 0,001
0,001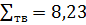 0,820
0,820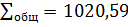 100
100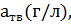
 т/м3:
т/м3: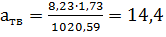 г/л.
г/л. кг, или 1,35%.
кг, или 1,35%. кг, или 0,096%.
кг, или 0,096%.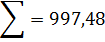


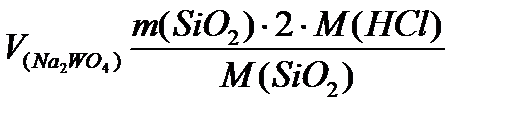 =
=  = 65,2 кг/добу
= 65,2 кг/добу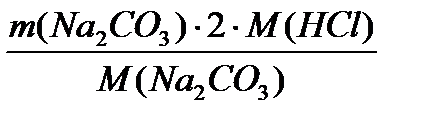 =
=  = 3428,9 кг/добу
= 3428,9 кг/добу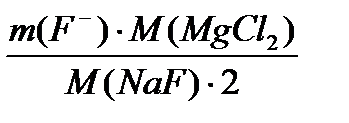 =
= 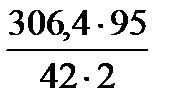 = 346,5 кг/добу
= 346,5 кг/добу
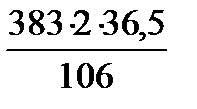 = 263,8 кг/добу
= 263,8 кг/добу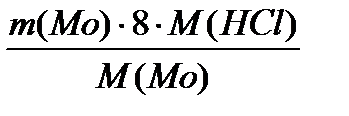 =
= 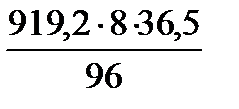 = 2795,9 кг/добу
= 2795,9 кг/добу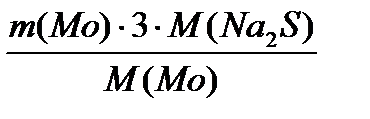 =
= 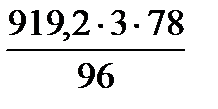 = 2240,6 кг/добу
= 2240,6 кг/добу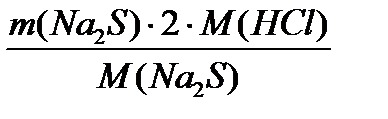 =
=  = 629,2 кг/добу
= 629,2 кг/добу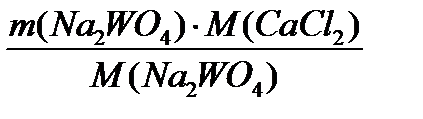 =
=  = 4333,3 кг/добу
= 4333,3 кг/добу *(1-0,008)=
*(1-0,008)=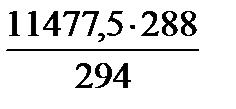 ·0,992 = 11153,3 кг/добу
·0,992 = 11153,3 кг/добу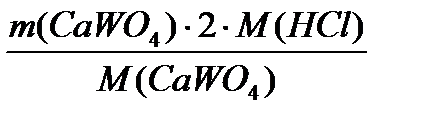 =
=  = 2827 кг/добу
= 2827 кг/добу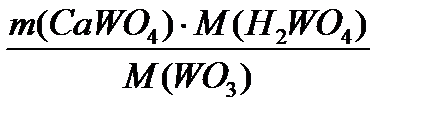 =
= 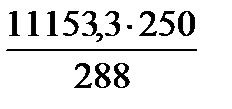 = 9681,7кг/добу
= 9681,7кг/добу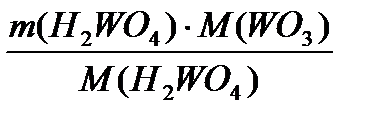 =
= 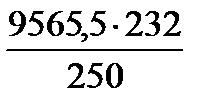 = 8876,7 кг/добу
= 8876,7 кг/добу