 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Абсорбция триоксида серы
Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту. При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3 из газовой фазы. Для полного извлечения SO3 необходимо, чтобы равновесное парциальное давление SO3 над растворителем было ничтожно малым, так как при этом будет велика движущая сила процесса абсорбции. Однако в качестве абсорбента нельзя использовать и такие растворы, над поверхностью которых велико равновесное парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3 будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты, диспергированных в инертной газовой среде – азоте, т. е. с образованием серно кислотного тумана: SO3 (Г) + H2O(Г) à H2SO4 (Г) à H2SO4 (ТУМАН); ∆Η < 0 Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу, при этом загрязняется окружающая среда и возрастают потери серной кислоты. Диаграмма фазового равновесия пар – жидкость для системы H2O – H2SO4 – SO3 показывает, что оптимальным абсорбентом является 98,3%-ная серная кислота (моногидрат), соответствующая азеотропному составу. Над этой кислотой практически нет ни паров воды, ни паров SO3. Протекающий при этом процесс можно условно описать уравнением реакции: SO3 + n H2SO4 + H2O à (n +1) H2SO4 Использование в качестве поглотителя менее конц. серной кислоты может привести к образованию сернокислотного тумана, а над 100%-ной серной кислотой или олеумом в паровой фазе довольно велико равновесное парциальное давление SO3, поэтому он будет абсорбироваться не полностью. В принципе при высоких температурах над 98,3%-ной кислотой может быть значительным парциальное давление паров самой кислоты, что также будет снижать степень абсорбции SO3. Ниже 100˚C равновесное давление паров H2SO4 очень мало и поэтому может быть достигнута практически 100%-ная степень абсорбции.
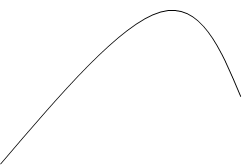
Степень абсорбции SO3 в моногидратном абсорбере при различных температурах: 1 – при 60˚С; 2 – при 80˚С; 3 – при 100˚С; 4 – при 120˚С.
абсорбции SO3, %
95 96 97 98 99 100
Концентрация H2SO4, %
Таким образом, для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 100˚C. Однако в процессе абсорбции SO3 происходит закрепление кислоты (повышение ее концентрации) и в силу экзотермичности реакции увеличивается температура. Для уменьшения тормозящего влияния этих явлений абсорбцию ведут так, чтобы концентрация H2SO4 при однократном прохождении абсорбера повышалась только на 1 – 1,5%, закрепившуюся серную кислоту разбавляют в сборнике до концентрации 98,3%, охлаждают в наружном холодильнике и вновь подают на абсорбцию, обеспечивая высокую кратность циркуляции.
Описание схемы Исходная сера поступает в плавитель, где плавясь нагревается до температуры 1200С и уже в виде жидкости поступает в печь циклонного типа 1 и нагревается до температуры 13000С, затем в котел-утилизатор 2, поступает сверху в пятислойный контактный аппарат 7 с температурой 4400С и концентрацией SO2 10%. В трех верхних слоях катализатора происходит окисление диоксида серы примерно на 60 % в каждом и адиабатическое повышение температуры. Охлаждением газа в теплообменниках между полками достигается ступенчатое приближение к оптимальной кривой. На выходе из третьего слоя достигается степень превращения SO2 в SO3 на 93 – 95 %, при этом адиабата приближается к равновесной кривой и скорость реакции сильно уменьшается Воздух осушается в сушильной башне 9, орошаемый 98%-ной кислотой. После подогрева в теплообменниках 8б и 8в в межтрубном пространстве направляется в печь 1. Газ после первого слоя теплообменника 8а по трубам снова возвращается в контактный аппарат. После 2-го слоя газ поступает в теплообменник 8г по трубам и снова возвращается в контактный аппарат 7. После 3-го слоя газ поступает на абсорбцию по трубам теплообменников 8д, 8б, 8в в первый моногидратный абсорбер 10. После абсорбции газ выходит сверху и через теплообменники 8д, 8б, 8в направляется на 4-й слой контактного аппарата 7, где содержащийся в газе диоксид серы (около 0,5 %) окисляется на 90 – 95 %. Перед 4-ым слоем вводится дополнительное количество воздуха. После 5-го слоя (где селективность процесса составляет 99,5 % и выше) газ используется для подогрева воды в экономайзере 3 и уже оттуда направляется во второй моногидратный абсорбер 11, где происходит окончательное поглощение и выдача 93% H2SO4.
Расчет материального баланса ХТС
Поиск по сайту: |






 100 1
100 1
 3 99 2
3 99 2 4
4 Степень 98
Степень 98