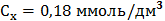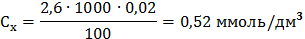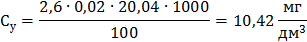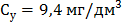|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Порядок виконання роботи. 2.1 Визначення сухого залишку ⇐ ПредыдущаяСтр 2 из 2
2.1 Визначення сухого залишку Метод визначення – гравіметричний. обладнання Ексикатор Колби конічні ємкістю 250 см3 Скляні лійки Стакани мірні ємкістю 250 см3 Фарфорові чашки Фільтри паперові щільні «синя стрічка» Циліндри мірні ємкістю 50, 100 см3 Водяна баня з дистильованою водою Сушильна шафа з терморегулятором Терези аналітичні типу ВЛР-200 Проведення аналізу Пробу води в кількості 50 – 250 см3 відбирають мірними циліндром і фільтрують через паперовий щільний фільтр «синя стрічка», розміщений у конічній колбі ємкістю 250 см3 на скляній воронці. Відфільтровану воду розміщують у фарфорову чашку, доведену до постійної маси. Чашку з водою ставлять на водяну баню і випарюють воду досуха, після чого чашку із залишком переносять у сушильну шафу і висушують при температурі 1800С протягом 1 години. Висушування залишку при температурі 1800С дозволяє видаляти з нього не тільки оклюдовану, але й кристалічну воду. Оскільки дніпрова вода містить переважно неорганічні солі, то висушування залишку при температурі 1800С дозволяє отримати результат, який наближається в більшій мірі до суми результатів окремих визначень катіонів і аніонів у пробі води. Після охолодження в ексикаторі чашку із залишком зважують на аналітичних терезах з точністю до четвертого знаку після коми. Висушування повторюють до досягнення постійної маси. Якщо результати зважування співпадають або різниця між ними не перевищує 0,0002 г, то можна вважати, що сталість маси чашки досягнуто. Вміст сухого залишку обчислюють за формулою:
де m1 – маса порожньої чашки, г; m2 – маса чашки із сухим залишком, г; V – об’єм проби води, яку взяли для аналізу, см3; 1000 – коефіцієнт для перерахунку г в мг; 1000 – коефіцієнт для перерахунку визначуваної величини на 1 дм3 води. Дані, отримані по зважуванні чашок, вносять в таблицю 2. Таблиця 2 – Результати зважування чашок для визначення сухого залишку
Для розрахунків беруть масу чашок третього зважування.
2.2 Визначення прожареного залишку Метод визначення – гравіметричний. Мета цього визначення – отримати наближене уявлення про вміст органічних і неорганічних речовин у пробі води: під час прожарювання органічні речовини видаляються, неорганічні залишаються. Однак деякі речовини є виключенням. обладнання Ексикатор Фарфорові чашки Муфельна піч Терези аналітичні типу ВЛР-200
Проведення аналізу Чашку із сухим залишком ставлять у муфельну піч, попередньо розігріту до 6000С, і прожарюють 20 хвилин. Потім дають вихолонути спочатку на повітрі, потім у ексикаторі. Після повного охолодження чашку із залишком зважують. Прожарювання повторюють до досягнення постійної маси. Вміст прожареного залишку обчислюють за формулою:
де m3 – маса чашки із прожареним залишком, г. Дані, отримані по зважуванню чашок, вносять в таблицю 3. Таблиця 3 – Результати зважування чашок для визначення Прожареного залишку
Для розрахунків беруть масу чашок третього зважування.
2.3 Визначення катіонів 2.3.1 Визначення іонів кальцію Метод визначення – комплексонометричний. Сутність методу засновано на утворенні стійких комплексних з’єднань (трилонатів) іонів Са2+ і Мg2+ у лужному середовищі шляхом титрування проби води у присутності індикатора (мурексиду). Якщо лужність середовища достатньо висока, то магній буде осаджуватися у вигляді Мg(ОН)2, а кальцій залишиться у розчині і його можна титрувати . За умов, що рН = 12, концентрація магнію у розчині не перевищує 10 – 15 мкг-екв/дм3. Додавання до 100 см3 аналізованої води 2 см3 2 н розчину натрій гідроксиду (NаОН) створює рН = 12,6, при якому залишкова концентрація магнію складе ~ 0,8 мкг-екв/дм3, що не заважає визначенню кальцію. Визначенню кальцію заважають деякі іони металів, наприклад, міді, заліза, мангану, свинцю, цинку, які утворюють забарвлені сполуки з мурексидом. Однак їхня концентрація в природних водах значно менша, ніж концентрація кальцію, тому у більшості випадків їх впливом можна нехтувати. При високих концентраціях для їх маскування до проби води додають триетаноламін. Іони магнію заважають визначенню при концентрації понад 3 мг/дм3, тому що гідроксид магнію адсорбує частину індикатора. Впливу магнію можна позбутися розбавленням проби дистильованою водою. обладнання Лійка скляна Колби конічні ємкістю 250 см3 Піпетки Мора ємкістю 25, 50, 100 см3 Піпетки ємкістю 2 см3 Циліндри мірні ємкістю 50, 100 см3 Бюретка ємкістю 25 см3 Розчини і реактиви Вода дистильована Натрій гідроксид (NаОН), розчин з концентрацією 2 моль/дм3 Трилон Б, розчин з молярною концентрацією еквівалента С ( Індикатор мурексид, суха суміш із NаСl
Приготування розчинів 1. Натрій гідроксид , розчин з концентрацією 2 моль/дм3 готується наступним чином: 80 г NаОН розчиняють в 1 дм3 дистильованої води без СО2. 2. Трилон Б, розчин з молярною концентрацією еквівалента С ( 3. Суху суміш мурексиду і натрію хлориду готують наступним чином: у фарфоровій ступці розтирають 0,2 г мурексиду та 100 г натрію хлориду.
Проведення аналізу В конічну колбу ємкістю 250 см3 відбирають піпеткою Мора 25 – 100 см3 води залежно від вмісту кальцію. Якщо кількість води складає менше 100 см3, то об’єм води доводять дистильованою водою до 100 см3. Додають у воду 2 см3 розчину NаОН ,для створення рН = 12 – 13, 0,1 – 0,15 г сухої суміші мурексиду і титрують робочим розчином Трилону Б з молярною концентрацією еквівалента С ( Йони кальцію визначають у двох паралельних пробах. Концентрацію іонів кальцію у ммоль/дм3 (Сx) та мг/дм3 (Су) обчислюють за формулами:
де V1 – об’єм робочого розчину Трилону Б (комплексну ІІІ), витрачений на титрування, см3; С – молярна концентрація еквівалента Трилону Б ( М – молярна маса еквівалента кальцію, г/моль, М ( 1000 (для формули 5) – коефіцієнт перерахунку моль в ммоль; 1000 (для формули 6) – коефіцієнт перерахунку г в мг. 2.3.2 Визначення іонів магнію Метод визначення – комплексонометричний. Метод засновано на титруванні йону Мg2+ Трилоном Б у присутності індикатора еріохрому чорного Т в тому ж розчині, в якому раніше визначали йон кальцію у присутності індикатора мурексиду. Перед титруванням забарвлення, що спричинив мурексид, руйнують кип’ятінням. обладнання Бюретка ємкістю 25 см3 Піпетки ємкістю 1, 2 см3 Електроплитка Розчини і реактиви Трилон Б (комплексон ІІІ), розчин з молярною концентрацією еквівалента С ( Амоній хлорид (амоній буферний розчин з рН = 10) Вода дистильована Індикатор еріохром чорний Т, суха суміш із NаСl Індикаторний папір конго Кислота хлористоводнева 1:2
Приготування розчинів 1. Амоній хлорид (амоній буферний розчин з рН = 10) готується наступним чином: 20 г амонію хлориду NН4Сl розчиняють у дистильованій воді, добавляють 100 см3 концентрованого аміаку і доводять об’єм суміші дистильованою водою до 1 дм3 у мірній колбі. 2. Індикатор еріохром чорний Т, суха суміш із NаСl готується так: 0,5 г індикатора еріохрому чорного Т розтирають у фарфоровій ступці з 50 г натрію хлориду. Суміш зберігають у склянці із темного скла з притертою пробкою протягом 10 – 12 місяців.
Проведення аналізу Проби води після визначення іонів кальцію кип’ятять протягом декількох хвилин до повного знебарвлення. Розчини після охолодження нейтралізують хлористоводневою кислотою по індикаторному паперу конго до зміни забарвлення із червоного (лужне середовище) у бузкове або синє (кисле середовище). У розчини додають 5 см3 амонію хлориду (аміачного буферного розчину з рН = 10) і 0,1 – 0,15 г сухої суміші еріохрому чорного Т. Після додавання індикатора розчини перемішують і титрують розчином Трилону Б з молярною концентрацією еквівалента 0,02 моль/дм3 (0,02 н) до переходу червоно-фіолетового (винно-червоного) кольору розчину у блакитний (синій) можливо із зеленуватим відтінком. Титрування проводять при інтенсивному перемішуванні у присутності «свідка», в якості якого можна використовувати перетитровану пробу. Вміст іонів магнію у ммоль/дм3 (Сx) та мг/дм3 (Су) обчислюють за формулами:
де V1 – об’єм Трилону Б (комплексну ІІІ), витрачений на титрування, см3; С – молярна концентрація еквіваленту Трилону Б ( М – молярна маса еквівалента магнію, г/моль, М( 1000 (для формули 7) – коефіцієнт перерахунку моль в ммоль; 1000 (для формули 8) – коефіцієнт перерахунку г в мг. 2.3.3 Визначення суми іонів натрію і калію Метод визначення – розрахунковий за балансом еквівалентів. Гідрогенкарбонати, хлориди та сульфати натрію, калію, магнію та кальцію, які складають сольові компоненти природних вод, практично повністю дисоційовані. Тому сума еквівалентів аніонів повинна дорівнювати сумі еквівалентів катіонів. При цьому враховують лише ті іони, концентрація яких перевищує 0,01 ммоль/дм3. Якщо концентрація таких іонів встановлена відповідними методами аналізу для всіх сольових компонентів, окрім йону натрію і калію, то за різницею ммоль/дм3 для всіх аніонів та суми катіонів Са2+ та Мg2+ можна визначити кількість ммоль/дм3 Nа+ та К+. Добуті дані мають наближений характер, тому що частина аніонів та катіонів залежно від рН та Еh води може бути зв’язана в інші розчинні сполуки. Проте частка їх незначна і в тому випадку, коли не потрібні точні відомості про вміст Nа+ та К+, використовують розрахунковий метод. Розрахунок проводиться за формулою:
де z – число еквівалентності. Якщо сума мілімолей аніонів виявляється меншою за суму мілімолей катіонів, тобто виходить від’ємний результат, то вважають, що іони Nа+ та К+ відсутні. Якщо розходження перевищує 3 % щодо суми всіх іонів при мінералізації води понад 300 мг/дм3 і вище 5 % при мінералізації менше 300 мг/дм3, то це свідчить про значні помилки у визначенні концентрацій головних іонів. У поверхневих водах суходолу кількість іонів калію в середньому складає 4 %, а іонів натрію – в середньому 17 %, тобто кількість іонів натрію більше, ніж іонів калію у 17/4 = 4,25 рази. Із розрахованої за формулою 9 суми ммолей іонів Nа+ та К+, визначають окремо кількість ммолей цих іонів з урахуванням того, що іонів натрію у воді більше у 4,25 рази, ніж іонів калію. Після чого вміст іонів натрію і калію у мг/дм3 (Су) обчислюють за формулами:
де
2.4 Визначення аніонів 2.4.1 Визначення гідротриоксокарбонат(V)–іонів (НСО-3) Метод визначення – титриметричний. Концентрацію іонів НСО
де q – загальна лужність води, ммоль/дм3; n – вільна лужність води, ммоль/дм3; М – молярна маса еквівалента НСО Визначення загальної лужності засновано на реакції утворення нейтральних солей при титруванні води хлористоводневою кислотою. Загальна лужність води обумовлена наявністю таких іонів: ОН-, СО32- та НСО Іони ОН- і СО32-, які титрують хлористоводневою кислотою в присутності індикатора фенолфталеїну до рН = 8,3, обумовлюють вільну лужність води (n). Під час титруванні води хлористоводневою кислотою в присутності фенолфталеїну проходять такі реакції: ОН- + Н+ = Н2О; СО32- + Н+ = НСО Іони НСО НСО Різниця q-n дорівнює вмісту гідротриоксокарбонат(V)-іонів, тому цю величину називають карбонатною або тимчасовою твердістю води. Якщо вільна лужність дорівнює нулю, загальна лужність обумовлена тільки бікарбонат-іонами. Для більшості природних вод НСО Якщо проба води має рН < 4,5 (при додаванні метилоранжу виникає оранжеве або червоне забарвлення), то її лужність дорівнює нулю. Вільна лужність визначається за формулою:
де С – молярна концентрація еквівалента робочого розчину НСl, моль/дм3 (н); V1 – об’єм робочого розчину кислоти, витраченої на титрування до встановлення рН = 8,3, см3; V – об’єм проби води, см3; 1000– коефіцієнт перерахунку моль у ммоль. Загальна лужність визначається за формулою:
де V2 – об’єм робочого розчину кислоти, витраченої на титрування до встановлення рН = 4,5, см3. обладнання Бюретка ємкістю 25 см3 Лійка скляна Конічні колби ємкістю 250 см3 Крапельниці для розчинів індикаторів Піпетки Мора ємкістю 100 см3 Розчини Кислота хлористоводнева , розчин з молярною концентрацією еквівалента С (НСl) = 0,1 моль/дм3 (0,1 н) Дистильована вода Метилоранж (індикатор), водний розчин з масовою часткою 0,1 % Фенолфталеїн (індикатор), спиртовий розчин з масовою часткою 1 %
Приготування розчинів 1. Приготування розчину хлористоводневої кислоти з молярною концентрацією еквівалента С (НСl) 0,1 моль/дм3 (0,1 н) Кислота готується розчиненням 8,23 см3 НСl із густиною ρНС1 = 1,00 г/см3 у дистильованій воді в мірній колбі ємкістю 1000 см3. Кислоту вливають у воду, весь час перемішуючи, і доводять об’єм дистильованою водою до мітки. Розчин знову перемішують. Оскільки хлористоводнева кислота із густиною ρНС1 = 1,00 г/см3 відповідає масовій концентрації 0,36 %, то необхідно концентровану кислоту розвести дистильованою водою. Для цього необхідно визначити концентрацію хлористоводневої кислоти, що робиться таким чином: у мірний циліндр ємкістю 100 см3 наливають 100 см3 концентрованої НСl і при 200С визначають її густину за допомогою ареометра. За правилом «хреста» визначають скільки треба взяти концентрованої хлористоводневої кислоти і дистильованої води, щоб отримати розчин НСl із масовою часткою 0,36 %.
2. Метилоранж, водний розчин з масовою часткою 0,1 % Розчин готується таким чином: 0,1 г метилоранжу розчиняють у 100 см3 дистильованої води. 3. Фенолфталеїн, спиртовий розчин з масовою часткою 1 % Розчин готують розчиненням 1 г фенолфталеїну в 100 см3 96 % етилового спирту. Проведення аналізу У дві конічні колби ємкістю 250 см3 піпеткою Мора наливають по 100 см3 дослідної води. В одну колбу до води додають 2-3 краплини фенолфталеїну і титрують 0,1 моль/дм3 (0,1 н) хлористоводневою кислотою до знебарвлення розчину (рН = 8,3). Таким чином визначають вільну лужність води (n). В другу колбу до води додають 2 краплини метилоранжу і титрують хлористоводневою кислотою з концентрацією 0,1 моль/дм3 (0,1 н) до переходу жовтого (оранжево-жовтого) кольору в червоний (рожевий) (рН = 4,5). Таким чином визначають загальну лужність води (q). Розрахунок вільної лужності проводиться за формулою (14), розрахунок загальної лужності – за формулою (15). Розрахунок гідротриоксокарбонат(V) - іонів проводиться за формулами (12) і (13). 2.4.2 Визначення хлорид-іонів Метод визначення – аргентометричний метод Мора. Титрометричне визначення хлоридів − аргентометричний методом Мора − ґрунтується на утворенні в нейтральному або слабколужному середовищі (рН = 7 – 10) малорозчинного осаду срібла хлориду (ДР = 1,78·10-10) за реакцією: Сl- + Аg+ Для встановлення кінця титрування як індикатор використовують дикалій хромат(VI), який з надлишком іонів срібла утворює червоний осад – срібла(I) хромат(VI) (ДР = 1,1·10-12) за реакцією: СrО42- + 2 Аg+ Титриметричне визначення хлорид-іонів у присутності хромат(VI)(2-) - іонів(СrО42-) використовується тому, що осад срібла хлориду менш розчинний, ніж осад срібла (I) хромат(VI) :
Тому при додаванні іонів Аg+ до розчину, в якому є іони Сl- та СrО42-, спочатку утворюється менш розчинний осад АgСl. Після його повного осадження, утворюється більш розчинний осад Аg2СrО4. Метод Мора застосовують для визначення хлоридів у воді при концентрації понад 2 мг/дм3. Без додаткового розбавлення можна титрувати проби води з концентрацією хлоридів до 400 мг/дм3. Залежно від концентрації хлоридів пробу титрують 0,1, 0,05 або 0,02 моль/дм3 робочими розчинами срібла нітрату(V). Визначенню хлоридів заважають сульфіти, сульфіди та тіосульфати, які можна розкласти пероксидом водню у лужному середовищі. Фосфат-іони заважають при концентрації понад 25 мг/дм3. Іони заліза при концентрації понад 10 мг/дм3 заважають точному встановленню точки еквівалентності. обладнання Бюретка ємкістю 25 см3 Лійка скляна Колби конічні ємкістю 250 см3 Піпетки Мора ємкістю 10, 100 см3 Піпетки ємкістю 1 см3 Циліндри мірні ємкістю 100 см3 Розчини Аргентум нітрат(V) (АgNО3), розчин з концентрацією 0,1 моль/дм3 (0,1 н) Натрій хлорид(NаСl), розчин з концентрацією 0,1 моль/дм3 (0,1 н) Калій хромат(VI) (К2СrО4), розчин з масовою часткою 5 % Натрій гідроксид, розчин з концентрацією 1 моль/дм3 Сульфатна кислота, розчин з концентрацією 0,5 моль/дм3 Фенолфталеїн (індикатор), спиртовий розчин з масовою часткою 1 % Вода дистильована
Приготування розчинів 1. Аргентум нітрат(V) (АgNО3), розчин з концентрацією 0,1 моль/дм3 (0,1 н) В мірній колбі ємкістю 1 дм3 розчиняють 17 г аргентум нітрату(V) у дистильованій воді і доводять до мітки тією ж дистильованою водою. 2. Натрій хлорид (NаСl), розчин з концентрацією 0,1 моль/дм3 (0,1 н) Натрій хлорид висушують при температурі 1050С у сушильній шафі до постійної маси. Беруть наважку 5,8443 г сухого натрій хлориду, який переводять у мірну колбу ємкістю 1 дм3, розчиняють у дистильованій воді і доводять до мітки дистильованою водою. 3. Калій хромат(VI) (К2СrО4), розчин з масовою часткою 5% 5 г К2СrО4 розчиняють у невеликому об’ємі дистильованої води і доводять об’єм розчину дистильованою водою до 100 см3.
Установлення поправкового коефіцієнту до розчину азотнокислого срібла В конічну колбу ємкістю 250 см3 вносять піпеткою Мора 10 см3 розчину натрій хлориду та 90 см3 дистильованої води, добавляють 1 см3 розчину калій хромату(VI) і титрують розчином аргентум нітрату(V) до переходу лимонно-жовтого забарвлення каламутного розчину в оранжево-жовте, яке не зникає протягом 15-20 секунд. Отриманий результат вважають орієнтовним. До відтитрованої проби додають 1-2 краплі розчину натрій хлориду до отримання жовтого забарвлення. Ця проба є контрольною під час повторного, більш точного визначення. Для цього відбирають нову порцію розчину натрій хлориду і титрують розчином аргентум нітрату(V) до отримання незначної різниці відтінків слабко-оранжевого у розчині, що титрується, і жовтого в контрольній пробі. Поправковий коефіцієнт (К) обчислюють за формулою:
де V – кількість срібло нітрату(V) , яка витрачена на титрування, см3. Проведення аналізу В конічну колбу ємкістю 250 см3 наливають піпеткою Мора 100 см3 природної води, або меншу кількість, доводячи її об’єм до 100 см3 дистильованою водою. Кислі або лужні проби нейтралізують натрій гідроксидом з концентрацією 1 моль/дм3 або сульфатною кислотою з концентрацією 0,5 моль/дм3 по фенолфталеїну так, щоб після нейтралізації розчин був безбарвним. Проби з рН = 7 – 10 не потребують попередньої підготовки. Додають 1 см3 розчину калій хромату(VI) з масовою часткою 5% і титрують розчином аргентум нітрату(V) (0,1 н) до зміни кольору від лимонно-жовтого до оранжевого. Паралельно проводять холостий дослід з таким же об’ємом дистиляту. Концентрацію хлорид-іонів у ммоль/дм3 (Сх) та мг/дм3 (Су) визначають за формулами:
де V1 та V0 – об’єми робочого розчину аргентум нітрату(V) , витрачені на титрування відповідно проби та холостого розчину, см3; С –концентрація робочого розчину АgNО3, моль/дм3; М – молярна маса еквівалента Сl-, г/моль, М (Сl-) = 35,45; V – об’єм проби води, см3; 1000 (для формули 17) – коефіцієнт перерахунку моль у ммоль; 1000 (для формули 18) – коефіцієнт перерахунку г у мг. 2.4.3 Визначення сульфат-іонів Метод визначення – турбідиметричний. Сутність методу полягає у вимірюванні інтенсивності світла, яке пройшло (уявне світлопоглинання) через рідке середовище, що містить завислі частки осаду, за допомогою фотоколориметра. Інтенсивність світла, яке пройшло, знаходиться в оберненій залежності від концентрації зависі і, отже, від концентрації речовини, яка утворила завись (осад) під дією відповідного реагенту (гліколевого реагенту). Інтенсивність помутніння розчину залежить від умов виконання реакції, присутності електролітів, колоїдів та інших факторів і, звісно, від концентрації речовини, що визначається. Сульфат-іони визначаються у вигляді ВаSО4 у хлористоводневокислому середовищі за допомогою гліколевого реагенту. Гліколь, уведений в реакційну суміш під час осадження барій сульфату(VI), стабілізує суспензію ВаSО4, що утворилася, і робить можливим турбідиметричне мікровизначення сульфат-іонів. Чутливість методу 2 мг/дм3 SО42-. обладнання Мірні колби ємкістю 50, 100 см3 Мірні циліндри ємкістю 10 см3 або мірні колориметричні пробірки з притертою пробкою і з відміткою на 10 см3 Піпетки ємкістю 1, 2, 5 см3 Баня водяна Електроплитка Колориметр фотоелектричний концентраційний типу КФК-2 Розчини Гліколевий реагент з ВаСl2 Гліколевий реагент без ВаСl2 Дистильована вода Основний стандартний розчин К2SО4, що містить 0,5 мг SО42- в 1 см3 Кислота хлористоводнева (НСl) 1:1
Приготування розчинів 1. Гліколевий реагент з ВаСl2 Гліколевий реагент – це розчин хлористого барію у суміші гліколя (етиленгліколь) і етанолу (етиловий спирт). Для приготування цього розчину змішують один об’єм 5%-ого водного розчину хлористого барію з трьома об’ємами гліколю і трьома об’ємами 96%-ого етанолу. Величину рН розчину регулюють соляною кислотою (1:1) в межах 2,5 – 2,8 і залишають розчин на 1-2 доби. Розчин стійкий протягом 3-6 місяців. 2. Основний стандартний розчин К2SО4, що містить 0,5 мг SО42- в 1 см3 0,9071 г К2SО4 розчиняють в мірній колбі ємкістю 1 дм3 в дистильованій воді і доводять об’єм розчину дистильованою водою до мітки. 1 см3 розчину містить 0,5 мг сульфат-іону (SО42-).
Побудова градуювального графіку для визначення сульфат-іонів у воді Для побудови градуювального графіку у ряд мірних колб ємкістю 50 см3 вносять 0,1; 0,2; 0,4; 0,6; 0,8; 1,0; 1,2; 1,4; 1,6; 1,8; 2,0 см3 основного стандартного розчину К2SО4, що містить 0,5 мг SО42- в 1 см3, і доводять об’єми до мітки дистильованою водою. Приготовлені розчини містять 1,0; 2,0; 4,0; 6,0; 8,0; 10; 12; 14; 16; 18; 20 мг/дм3 SО42-. Відміряють піпеткою по 5 см3 із кожного розчину в мірні циліндри ємкістю 10 см3 (або в мірні колориметричні пробірки з притертою пробкою і з відміткою на 10 см3). В кожний циліндр із зразковим розчином прибавляють 1-2 краплини НСl (1:1) і 5 см3 гліколевого реагенту з ВаСl2, ретельно перемішують, через 30 хвилин виміряють оптичну густину розчинів по відношенню до розчину порівняння, який готовлять на основі 5 см3 дистильованої води, 1-2 крапель НСl (1:1) і 5 см3 гліколевого реагенту без ВаСl2. Розчин порівняння також використовують після 30 хвилин експозиції. Оптичну густину розчинів виміряють на колориметрі фотоелектричному концентраційному типу КФК-2 при довжині хвилі λ = 364 нм в кюветі з робочою довжиною l = 20 мм при чутливості 2. За отриманими даними будують градуювальний графік в координатах: оптична густина розчинів (Д) – концентрація SО42-, мг/дм3. Градуювальний графік будують на міліметровому папері формату А 4.
Проведення аналізу До 5 см3 досліджуваної води, яку відібрали піпеткою ємкістю 5 см3, у мірний циліндр ємкістю 10 см3, додають 1-2 краплі хлористоводневої кислоти (1:1) і 5 см3 гліколевого реагенту з ВаСℓ2, ретельно перемішують. Після 30 хвилин експозиції виміряють оптичну густину розчину на КФК-2 при λ = 364 нм, l = 20 мм при чутливості 2 по відношенню до розчину порівняння, який готується на дистильованій воді із додаванням НСl (1:1) і гліколевого реагенту без ВаСl2. Вміст сульфат-іонів знаходять за градуювальним графіком. Оптимальні інтервали концентрацій для турбідиметричного визначення сульфат-іону знаходяться в межах 2 – 25 мг/дм3. При концентрації SО42- менше ніж 2 мг/дм3 необхідно попереднє концентрування проби води.
Вимоги до звіту 3.1 У звіті вказують назву лабораторної роботи та її номер; мету роботи; посуд, обладнання, реактиви і розчини, які використовуються в роботі. У звіті також викладають порядок виконання лабораторної роботи; проведення аналізу та визначення сухого і прожареного залишків, катіонів Са2+, Мg2+, К+, Nа+ та аніонів Сl-, SО42-, НСО3-. 3.2 При визначенні сульфат-іонів вказують також приготування гліколевого реагенту з ВаСl2, основного стандартного розчину К2SО4, що містить 0,5 мг SО42- в 1 см3; методику побудови градуювального графіку для визначення сульфат-іонів у воді. 3.3 Дані отримані експериментально і розрахункові дані зводять в табл. 4.
Таблиця 4 – Вміст сухого і прожареного залишку, катіонів Са2+, Мg2+, К+, Nа+ та аніонів Сl-, SО42-, НСО3- у дніпровій воді
3.4 У звіті проводять розрахунок ступеня мінералізації дніпрової води за формулою (1) з використанням даних табл. 4 і роблять висновки.
Розрахункова частина
Визначення вмісту сухого залишку
Вміст сухого залишку обчислюють за формулою:
де m1 – маса порожньої чашки, г; m2 – маса чашки із сухим залишком, г; V – об’єм проби води, яку взяли для аналізу, см3; 1000 – коефіцієнт для перерахунку г в мг; 1000 – коефіцієнт для перерахунку визначуваної величини на 1 дм3 води.
Визначення вмісту прожареного залишку Вміст прожареного залишку обчислюють за формулою:
де m3 – маса чашки із прожареним залишком, г.
Визначення вмісту аніонів
Визначення гідротриоксокарбонат (V)–іонів (НСО-3). Вільна лужність визначається за формулою:
де С – молярна концентрація еквівалента робочого розчину НСl, моль/дм3 (н); V1 – об’єм робочого розчину кислоти, витраченої на титрування до встановлення рН = 8,3, см3; V – об’єм проби води, см3; 1000– коефіцієнт перерахунку моль у ммоль. Для першої проби:
Для другої проби:
Для третьої проби:
Загальна лужність визначається за формулою:
де V2 – об’єм робочого розчину кислоти, витраченої на титрування до встановлення рН = 4,5, см3. Для першої проби:
Для другої проби:
Для третьої проби:
Концентрацію іонів НСО
де q – загальна лужність води, ммоль/дм3; n – вільна лужність води, ммоль/дм3; М – молярна маса еквівалента НСО Для першої проби:
Для другої проби:
Для третьої проби:
Середні значення концентрацій:
Визначення сульфат-іонів
Оптична густина розчинів: DBaCl=0,17; DK2SO4=0,18 Концентрація по графіку: С1=0,53 мг/дм3; С2=0,55 мг/дм3
Перерахунок на ммоль/дм3:
Вміст катіонівК+, Nа+ розраховую, застосувавши рівняння:
де z – число еквівалентності.
Кількість іонів натрію більше, ніж іонів калію у 4,25 рази. Приймаю K+ = x Тоді Na+=4,5x x+4,5x=0,152 x=0,028 мг/дм3 Тоді 4,5x=0,124 мг/дм3
Визначення хлорид-йонів
Поправковий коефіцієнт (К) обчислюють за формулою:
Концентрацію хлорид-іонів у ммоль/дм3 (Сх) та мг/дм3 (Су) визначають за формулами:
де V1 та V0 – об’єми робочого розчину аргентум нітрату(V) , витрачені на титрування відповідно проби та холостого розчину, см3; С –концентрація робочого розчину АgNО3, моль/дм3; М – молярна маса еквівалента Сl-, г/моль, М (Сl-) = 35,45; V – об’єм проби води, см3; 1000 (для формули 17) – коефіцієнт перерахунку моль у ммоль; 1000 (для формули 18) – коефіцієнт перерахунку г у мг.
Для першої проби:
Для другої проби:
Для третьої проби:
Середні значення концентрацій:
Визначеня катіонів магнію Вміст іонів магнію у ммоль/дм3 (Сx) та мг/дм3 (Су) обчислюють за формулами:
де V1 – об’єм Трилону Б (комплексну ІІІ), витрачений на титрування, см3; С – молярна концентрація еквіваленту Трилону Б ( М – молярна маса еквівалента магнію, г/моль, М( 1000 (для формули 7) – коефіцієнт перерахунку моль в ммоль; 1000 (для формули 8) – коефіцієнт перерахунку г в мг.
Для першої проби:
Для другої проби:
Для третьої проби:
Середні значення концентрацій:
Визначення йонів кальцію Концентрацію іонів кальцію у ммоль/дм3 (Сx) та мг/дм3 (Су) обчислюють за формулами:
де V1 – об’єм робочого розчину Трилону Б (комплексну ІІІ), витрачений на титрування, см3; С – молярна концентрація еквівалента Трилону Б ( М – молярна маса еквівалента кальцію, г/моль, М ( 1000 (для формули 5) – коефіцієнт перерахунку моль в ммоль; 1000 (для формули 6) – коефіцієнт перерахунку г в мг. Для першої проби:
Для другої проби:
Для третьої проби:
Середні значення концентрацій:
Висновок: в ході роботи ми визначили ступінь мінералізації дніпрової води. За загальною мінералізацією дніпрова вода відноситься до групи А, і I групи яка визначається співвідношенням НCO3->Ca2++Mg2+. Отже, досліджувана вода є прісною.
4 Контрольні запитання 1. Що представляє собою природна вода? 2. Які хімічні елементи зустрічаються у природних водах? 3. Для яких вод використовується класифікація неорганічних домішок С.О. Щукарєва й О.О. Альокіна, а для яких – класифікація В.О. Александрова? 4. На чому заснована класифікація С.О. Щукарєва? 5. В чому сутність класифікації О.О. Альокіна? 6. Як визначається загальна ступінь мінералізації води? 7. Як перевіряється правильність обчислювання ступеня мінералізації природної води? 8. Як визначається похибка аналізу χ при визначенні ступеня мінералізації води? 9. Як класифікується природна вода за вмістом в ній солей? 10. Із чого складається сухий залишок? 11. Як визначається вміст сухого залишку? 12. Чому висушують сухий залишок при температурі 1800С? 13. Як визначається вміст прожареного залишку та із чого він складається? 14. В чому полягає сутність методу визначення іонів кальцію? 15. Як визначають вміст іонів кальцію? 16. Які іони заважають визначенню кальцію і що в такому випадку робити? 17. Яким методом визначають вміст іонів магнію? 18. Як проводиться аналіз для визначення іонів магнію? 19. Поясніть, як визначаються іони натрію і калію розрахунковим методом за балансом еквівалентів? 20. За якою формулою визначається вміст гідротриоксокарбонат(V)-іонів у воді? 21. Що таке вільна лужність, загальна лужність? Наявністю яких аніонів вона характеризується? 22. Які реакції відбуваються при визначенні вільної і загальної лужності води? 23. Що можна вважати, коли вільна лужність буде дорівнювати нулю? 24. Як визначається вільна і загальна лужність води? 25. Яким методом визначаються хлорид-іони у воді? В чому полягає його сутність? 26. В якому випадку використовується метод Мора? 27. Які речовини заважають визначенню хлорид-іонів? 28. Як визначаються хлорид-іони у воді? 29. Як встановлюється поправковий коефіцієнт до розчину азотнокислого срібла? 30. Яким методом визначаються сульфат-іони у воді? Сутність цього методу? 31. Як готується гліколевий реагент з ВаСl2? 32. Скільки гліколевих реагентів використовується при визначенні SО42-? Назвіть їх. 33. З чого складається основний стандартний розчин К2SО4? Назвіть його концентрацію? 34. Як будується градуювальний графік для визначення сульфат-іонів у воді? 35. Як визначаються сульфат-іони у дніпровій воді? 36. Чому становить ступінь мінералізації дніпрової води?
Поиск по сайту: |
 (3)
(3) (4)
(4) Н2У 2-) 0,02 моль/дм3 (0,02 н)
Н2У 2-) 0,02 моль/дм3 (0,02 н) ) 0,02 моль/дм3 (0,02 н) до переходу забарвлення з рожевого (червоного) до фіолетового (синьо-фіолетового).
) 0,02 моль/дм3 (0,02 н) до переходу забарвлення з рожевого (червоного) до фіолетового (синьо-фіолетового).
 (5)
(5)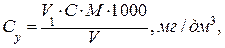 (6)
(6) Н2У 2-), моль/дм3 (н);
Н2У 2-), моль/дм3 (н); (7)
(7) (8)
(8) (9)
(9) – кількість відповідного іону х, ммоль/дм3;
– кількість відповідного іону х, ммоль/дм3; (10)
(10) (11)
(11)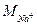 – молярна маса еквівалента натрію, мг/ммоль, М (Nа+) = 23;
– молярна маса еквівалента натрію, мг/ммоль, М (Nа+) = 23;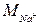 – молярна маса еквівалента калію, мг/ммоль, М (К+) = 39,1.
– молярна маса еквівалента калію, мг/ммоль, М (К+) = 39,1. у ммоль/дм3 (Сх) та мг/дм3 (Су) визначають за формулами:
у ммоль/дм3 (Сх) та мг/дм3 (Су) визначають за формулами: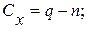 (12)
(12) (13)
(13) (14)
(14) (15)
(15) АgСl↓
АgСl↓ Аg2СrО4↓
Аg2СrО4↓
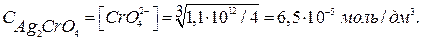
 (16)
(16) (17)
(17)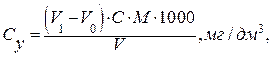 (18)
(18)



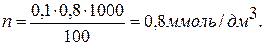

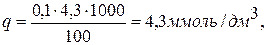

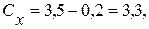




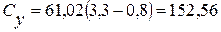

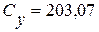
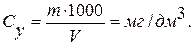

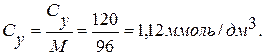
 – кількість відповідного іону х, ммоль/дм3;
– кількість відповідного іону х, ммоль/дм3;