 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Схема соотношения между фармакокинетическими и фармакодинамическими аспектами действия лекарственных веществ
При изучении действия лекарственных препаратов на здоровых добровольцах определяют минимальную терапевтическую и минимальную токсическую дозы. Минимальная терапевтическая доза (аналог ED1) определяется минимальным количеством лекарственного вещества, которое необходимо ввести для получения терапевтического эффекта. Минимальная токсическая доза (аналог ТD1) определяется минимальным количеством лекарственного вещества, при котором начинается развитие нежелательных, побочных или токсических явлений. Диапазон между минимальной токсической и терапевтической дозой называется терапевтическим диапазоном. Чем шире терапевтический диапазон, тем меньше вероятности возникновения осложнений при применении данного лекарственного вещества. Минимальная терапевтическая и минимальная токсическая доза лекарственного вещества во многом определяется путем введения лекарственного вещества в организм. Поэтому оптимизация фармакологической терапии может быть сведена к поддержанию концентрации лекарственного вещества в заданной ткани в пределах терапевтического диапазона. Это позволит достигнуть лечебного эффекта без развития побочного действия. В большинстве случаев выявить концентрацию лекарственного вещества в месте его действия (в точке приложения) не представляется возможным, чаще всего на практике определяют концентрацию в плазме крови, поскольку именно концентрация лекарственного вещества в плазме крови определяет его поступление в органы мишени и развитие побочных реакций. Можно определять концентрацию лекарственного вещества и в других биологических средах организма человека. Таким образом режим дозирования лекарственного вещества должен быть подобран так, чтобы концентрация лекарственного вещества в плазме крови была в пределах терапевтического диапазона. Закономерности изменения концентрации лекарственных веществ в организме изучает фармакокинетика. Теоретическая часть этой науки основана на математических методах анализа процессов изменения концентрации лекарственных веществ в организме. Клиническая фармакокинетика базируется на терапевтическом лекарственном мониторинге (therapeutic drug monitoring, ТЛМ) — определении концентрации лекарственных веществ в биологических тканях и жидкостях. Клиническая фармакокинетика основана на существовании взаимосвязи между доступной определению концентрацией лекарственного средства (например в плазме крови или цельной крови) и его эффектами (терапевтическими или побочными). Необходимость изменить дозу при тех или иных физиологических и патологических состояниях зачастую обусловлена изменением фармакокинетики препарата. К наиболее важным фармакокинетическим параметрам относятся клиренс, характеризующий объем крови, кот очищается от рекарства в ед. времени объем распределения — кажущийся объем, в котором содержится лекарственное вещество, период полувыведения (Ту) — параметр, характеризующий скорость выведения препарата из организма, и биодоступность — доля введенного препарата, поступившая в системный кровоток. менее значимые параметры — скорость всасывания и скорость распределения.
Процесс элиминации может быть охарактеризован величиной клиренса, константы скорости элиминации первого порядка и периодом полуэлиминации, которые являются величинами постоянными для каждого лекарственного средства. Константа скорости элиминации (kel, мин-1) – показывает, какая часть лекарственного средства элиминируется из организма в единицу времени. Значение kel обычно находят путем решения фармакокинетического уравнения, описывающего процесс элиминации лекарства из крови, поэтому kel называют модельным показателем кинетики. Непосредственного отношения к планированию режима дозирования kel не имеет, но ее значение используют для расчета других фармакокинетических параметров. Клиренс (Cl, мл/мин). Клиренс можно определить как объем крови, который очищается от лекарственного средства за единицу времени. Поскольку плазма (кровь) выступает как «видимая» часть объема распределения, то, иными словами, клиренс – фракция объема распределения, из которой лекарство выделяется в единицу времени. Если обозначить общее количество лекарства в организме черезАобщ, а количество, которое выделилось через Авыд, то тогда: Период полуэлиминации (t½, мин-1) – это время, необходимое для снижения концентрации лекарственного вещества в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов. Обычно период полуэлиминации определяют из соотношения:
Если клиренс постоянный, скорость элиминации прямо пропорциональна концентрации лекарственного средства. Клиренс отражает не количество элиминировавшегося препарата, а объем биологической жидкости (плазма крови или цельная кровь), полностью очищающийся от данного вещества за единицу времени.
С1поч + С1печ + С1пр = С1, (1.4) где С1поч — почечный клиренс, С1печ — печеночный клиренс, С1пр — клиренс для прочих органов (лекарственные средства могут метаболизироваться в других органах, выводятся с калом, потом, слюной).
Поиск по сайту: |
 .
.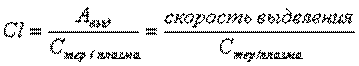 .
.
 и
и  .
. ,
,