|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Связывание (обезвреживание) аммиака
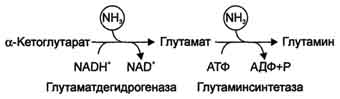
Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций. Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы:
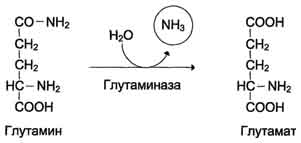
Глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор - ионы Mg2+. Глутаминсинтетаза - один из основных регуляторных ферментов обмена аминокислот и аллостерически ингибируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис. Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщикам:и глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки. В клетках кишечникапод действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина . Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные ~90% выводятся почками.
Рис. 9-10. Метаболизм азота глутамина в кишечнике. В почкахтакже происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается. В почках образуется и выводится около 0,5 г солей аммония в сутки. Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин - основной донор азота в организме.Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых · Рис. 9-11. Метаболизм амидного азота глутамина в почках. нуклеотидов, аспарагина, аминосахаров и других соединений (рис. 9-12).
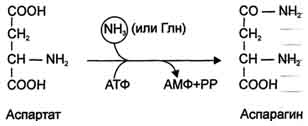
Рис. 9-12. Пути использования глутамина в организме. Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагинапод действием аспарагинсинтетазы.
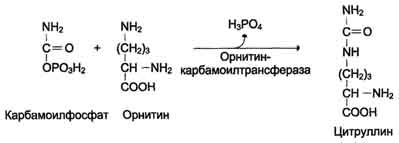
Существуют 2 изоформы этого фермента - глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина. Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины.В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфос-фатсинтетазы I. Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе гшримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины. В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутаратапод действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, так как активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой (см. схему ниже). Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы. Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления
глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата (рис. 9-13). Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо-аланиновый цикл,работа которого сопряжена с работой глюкозо-лактатного цикла . Оринитиновый цикл мочевинообразования. Химизм, место протекания процесса. Энергетический эффект процесса, его регуляция. Количественное определение мочевины сыворотки крови, клиническое значение. Мочевина - основной конечный продукт азотистого обмена,в составе которого из организма выделяется до 90% всего выводимого азота . Экскреция мочевины в норме составляет ∼25 г/сут. При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени, что было установлено ещё в опытах И.Д. Павлова. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина). В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название "орнитиновый цикл",или "цикл Кребса-Гензелейта"
Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения
Поиск по сайту: |