|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена
Многие ткани синтезируют в качестве резервной формы глюкозы гликоген. Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови и создают депо для её использования тканями по мере необходимости. Гликоген - разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы (рис. 7-21). Таким образом, в молекуле гликогена имеется только одна свободная аномерная ОН-группа и, следовательно, только один восстанавливающий (редуцирующий) конец. В клетках животных гликоген - основной резервный полисахарид. При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, её влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. Гликоген хранится в цитозоле клетки в форме гранул диаметром 10-40 нм. С гранулами связаны и некоторые ферменты, участвующие в метаболизме гликогена, что облегчает их взаимодействие с субстратом. Разветвлённая структура гликогена обусловливает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы. Гликоген депонируется главным образом в печени и скелетных мышцах. После приёма пищи, богатой углеводами, запас гликогена в печени может составлять примерно 5% от её массы. В мышцах запасается около 1% гликогена, однако масса мышечной ткани значительно больше и поэтому общее количество гликогена в мышцах в 2 раза больше, чем в печени. Гликоген может синтезироваться во многих клетках, например в нейронах, макрофагах, клетках жировой ткани, но содержание его в этих тканях незначительно. В организме может содержаться до 450 г гликогена. Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы - источника энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови. Как уже упоминалось ранее, в клетках мышц нет фермента глюкозо-6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки .
Рис. 7-23. Синтез гликогена. 1 - глюкокиназа или гексокиназа; 2 - фосфоглюкомутаза; 3 - УДФ-глюкрпирофосфорилаза; 4 - гликогенсинтаза (глюкозилтрансфераза); 5 - фермент "ветвления" (амило-1,4 → 1,6-глюкозилтрансфераза), светлые и заштрихованные кружки - глюкозные остатки, закрашенные кружки - глюкозные остатки в точке ветвления. Рис. 7-25. Распад гликогена. В рамке - фрагмент гликогена с точкой ветвления. Закрашенный кружок - глюкозный остаток, связанный α-1,6-гликозидной связью; светлые и заштрихованные кружки - глюкозные остатки в линейных участках и боковых ветвях, связанные α-1,4-гликозидной связью. 1 - Гликогенфосфорилаза; 2 - олигосахаридтрансфераза; 3 - α-1,6-глюкозидаза
Рис. 7-26. Синтез и распад гликогена. 1 - гексокиназа или глюкокиназа (печень); 2 - УДФ-глюкопирофосфорилаза; 3 - гликогенсинтаза; 4 - амило-1,4 → 1,6-глюкозилтрансфераза (фермент ветвления); 5 - гликогенфосфорилаза; 6 - "деветвящий" фермент; 7 - глюкозо-6-фосфатаза (печень); 8 - транспортные системы ГЛЮТ.
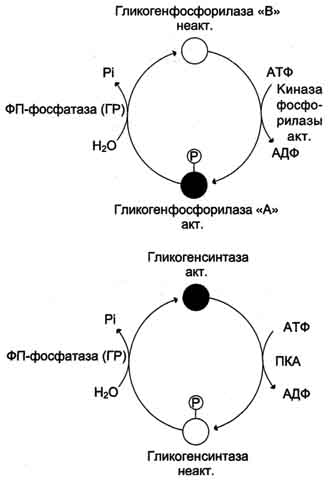
Рис. 7-27. Изменение активности гликогенфосфорилазы и гликогенсинтазы. Кружками обозначены молекулы фермента: активные - чёрные, неактивные - белые. ФП-фосфатаза (ГР) - фосфопротеинфосфатаза гранул гликогена.
Уровень глюкозы крови как гомеостатический параметр внутренней среды организма. Роль инсулина, глюкагона, адреналина, аденилатциклазной и инозитол-фосфатной систем в регуляции уровня глюкозы. Как уже отмечалось, первичный сигнал для синтеза инсулина и глюкагона - изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при смене абсорбтивного периода на постабсорбтивный изменяется их относительная концентрация, что является главным фактором, переключающим метаболизм гликогена в печени. Отношение концентрации инсулина в крови к концентрации глюкагона называют "инсулинглюкагоновый индекс".В постабсорбтивном периоде инсулинглюкагоновый индекс снижается, и решающее значение в регуляции концентрации глюкозы в крови приобретает концентрация глюкагона
Влияние инсулина на активность гликогенсинтазы и киназы фосфорилазы. ФП-фосфатаза (ГР) - фосфопроте-инфосфатаза гранул гликогена. ПК (pp90S6) - протеинкиназа, активируемая инсулином.
Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином. 1 - глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 - α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 - в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 - протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6-протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 - в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 - фосфодиэсте-раза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс ос-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
Регуляция синтеза и распада гликогена в печени адреналином и Са2+. ФИФ2- фосфатидилинозитолбисфосфат; ИФ3- инозитол-1,4,5-трифосфат; ДАГ - диацилглицерол; ЭР - эндоплазматический ретикулум; ФС - фосфодитилсерин. 1 - взаимодействие адреналина с α1-рецептором трансформирует сигнал через активацию G-белка на фосфолипазу С, переводя её в активное состояние; 2 - фосфолипаза С гидролизует ФИФ2 на ИФ3 и ДАГ; 3 - ИФ3 активирует мобилизацию Са2+ из ЭР; 4 - Са2+, ДАГ и фосфодитилсерин активируют протеинкиназу С. Протеинкиназа С фосфорилирует гликогенсинтазу, переводя её в неактивное состояние; 5 - комплекс 4Са2+-кальмодулин активирует киназу фосфорилазы и кальмодулин-зависимые протеинкиназы; 6 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу и тем самым её активирует; 7 - активные формы трёх ферментов (кальмодулинзависимая протеинкиназа, киназа фосфорилазы и протеинкиназа С) фосфорилируют гликогенсинтазу в различных центрах, переводя её в неактивное состояние.
Поиск по сайту: |