 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Метод выделения дезоксирибонуклеопротеина из ткани зобной железы или селезенки
Холестерин.
Основа – циклопентанпергидрофенантрен Биосинтез ХС в клетках печени, тонкого кишечника и кожи осуществляется из АцКоА, который освобождается в результате распада белков, липидов и углеводов. Эндогенный ХС синтезируется преимущественно в печени (85%), в небольшой степени в тонком кишечнике (10%) и коже (5%). Всего в организме взрослого здорового человека массой 70 кг за сутки образуется 2,8-3,5 г ХС. С пищей за сутки в организм поступает около 0,3 г ХС. Источником ХС для организма человека являются липиды пищи и эндогенный холестерин. Печень участвует в распределении ХС между клетками органов и тканей через транспортные ЛП крови. На экспорт ХС синтезируется только печенью и тонкой кишкой. Холестерин является обязательным компонентом клеток. Наиболее богата ХС плазматическая мембрана гепатоцитов, где на его долю приходится 30% всех мембранных липидов. В миелине уровень ХС составляет 20%. В свободном виде и в виде эфиров он содержится в ЛП крови, входит в состав жировых включений цитоплазмы. В организме человека ХС выполняет следующие функции:1. структурная – ХС является структурным компонентом биомембран клеток. Принимает участие в регуляции их проницаемости, регулирует активность ферментов, работу рецепторов и переносчиков биомембран;2. метаболическая – связана с тем, что ХС является предшественником стероидных гормонов (андрогены, эстрогены, минерало- и глюкокортикоиды), витамина D3 и желчных кислот. Процесс биосинтеза ХС сложный и многоступенчатый и включает 35 реакций. Детали синтеза ХС практического врача не интересуют, поскольку многочисленные попытки управлять этим процессом в терапевтических целях оказались безуспешными, но знать схему биосинтеза надо. Источником БС ХС является ацетил-КоА, который образуется в результате катаболизма белков, углеводов и липидов. В синтезе холестерина можно выделить три основные стадии: I – превращение активного ацетата в мевалоновую кислоту,II –образование сквалена из мевалоновой кислоты, III – циклизация сквалена в холестерин. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоАявляется образование ацетоацетил-КоА посредством обратимой тиолазной реакции: Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту: Освободившийся в результате распада клеток, ХС с помощью ЛПВП транспортируется в печень, где при участии цитохрома Р450 окисляется с образованием желчных кислот. примерно 80% окисленного ХС выводится с желчными кислотами через кишечник в виде капостеринов 16.Жирные кислоты. Жирные кислоты - это алифатические карбоновые кислоты число атомов в которых может достигать 22 24 Основная масса жирных кислот входящих в организм человека и животных имеет четное число атомов углерода что связано с особенностями их синтеза Дело в том, что синтез идет путем тотарного удлинения углеродной цепочки Жирные кислоты как правило имеют неразветвленную углеводородную цепь Ониподрюоеляются на насыщенные жирные кислоты - не имеющие в своей структуре двойных связей И ненасыщенные жирные кислоты имеющие в своей структуре двойные или даже тройные С - С связи (тройные встречаются крайне редко) Ненасыщенные жирные кислоты в свою очередь деются на а) моноеновыете содержащие одну двойную связь б) полиеновые, содержащие много двойных связей (диеновые, триеновые и др) Все природные ненасыщенные жирные кислоты имеют стереохимическую цис- конфигурацию так называемая цнс-ол-изомерия. Природные ненасыщенные жирные кислоты обычно имеют тривиальное название, например алеиновая, линоливая, линоленовая арахидоновая 17.Желчные кислоты. Строение. Биологическая роль. Парные желчные кислоты. Основную роль в переваривании пищи играют желчные кислоты, которые образуются в печени из холестерина. В основе всех желчных кислот лежит структура циклопентанпергидрофенантрена:
18.Липопротеины.Коэффициент атерогенности. Липопротеи́ны (липопротеиды) —класс сложных белков, простетическая группа которых представлена каким-либо липидом. Делятся на:- свободные липопротеины (ЛП) – хорошо растворимые в воде вещества, транспортные формы (доминируют белки);- структурные протеолипиды – хорошо растворимые в органических растворителях.К свободным ЛП относят транспортные ЛП крови. В составе этих частиц могут быть ВЖК, триацилглицерины, фосфолипиды, холестерин, холестериды и др. Наружная часть - p-полярные соединения (гидрофильные): белки, фосфолипиды, холестерин. В центре частицы локализованы холестериды, эфиры ВЖК, триацилглицириды, фосфолипиды [рис. этого]. Все их можно разделить по плотности и по электрофоретической подвижности: 1. хиломикроны (ХМ) – самые крупные и наименее плотные (r<1»0,95 кг/л) частицы. Состоят из 2% белка и 98% липидных компонентов (триглицериды). Образуются в кишечнике. Их количество резко возрастает после приема богатой липидами пищи; 2. ЛП очень низкой плотности (ЛПОНП) – по электрофоретической подвижности эта фракция предшествует b-ЛП (пре-b-ЛП). Их плотность =0,94 – 1,006 кг/л. Содержат повышенное количество белка. Образуются в печени, осуществляют транспорт триглицеридов из нее; 3. ЛП низкой плотности (ЛПНП) – по электрофоретической подвижности b-ЛП. Плотность от 1,006 до 1,06 кг/л; 4. ЛП высокой плотности (ЛПВП) – по электрофоретической подвижности a-ЛП. Плотность от 1,06 до 1,2 кг/л. Содержат примерно 60% белка. По составу липидов, ЛП низкой и высокой плотности богаты холестерином и фосфолипидами. Биологическая роль свободных ЛП сводится к транспортным функциям. За счет их гидрофильной оболочки происходит перенос различных веществ в клетки. Также они играют важную роль в диагностике патогенеза. ЛПНП и ЛПОНП относятся к атерогенным ЛП, т.к. они богаты холестерином и являются крупными частицами, поэтому они застревают в сосудах и вызывают разрастание соединительной ткани. ЛПВП – это антиатерогены, т.к. транспорт холестерина ими происходит из клеток в ткани. Структурные липопротеины. Они плохо растворяются в воде, но хорошо в других растворителях. Участвуют в построении биомембран. Содержат 65-85% белка, находящийся в центре частицы и окружен липидами - поэтому их называют протеолипиды. В составе структурных ЛП важную роль играют фосфолипиды. Биологическая роль структурных ЛП заключается в транспорте веществ через клеточные мембраны, передаче нервного импульса и выполнении ими ферментативной функции. Коэффициент атерогенности - один из немногих интегральных показателей, позволяющий оценить риск развития атеросклероза. Для оценки состояния липидного и липопротеинного (белково-жирового) обмена определяют величины: - общего холестерина, - триглицеридов, - холестерина, входящего в состав липопротеинов высокой плотности, - холестерина, входящего в состав липопротеинов очень низкой плотности, - холестерина, входящего в состав липопротеинов низкой плотности. Определение этих величин позволяет рассчитать коэффициент атерогениости: Атерогенность = общий холестерин - холестерин, входящий в состав липопротеинов высокой плотности / холестерин, входящий в состав липопротеинов очень низкой плотности,а также другие показатели. 19. Обмен триглицеридов в тканях. Триглицериды синтезируются в клетках практически всех органах и тканей в качестве резервных питательных веществ, однако необходимо подчеркнуть, что синтез интенсивный с наибольшей интенсивностью идет в клетках печени и клетках жировой ткани, Что необходимо для синтеза триглицеридов? Для синтеза необходимы ВЖК иглицерол.ВЖК поступают в клетки или иэ плазмы крови или же синтезируются на месте, т.е. в клетках непосредственно, нз ацетилКоА. Глицерол может поступать так же из плазмы крови, однако основным источником глицерина для синтеза триглицеридов и даже фосфолипидов в клетках служит промежуточный продукт распада углеводов - ВЖК участвуют в синтезе триглицеридов в виде своих активированных производных - ацил-КоА. Необходимый для синтеза фосфоглицерин образуется или путем восстановления фосфодиоксиацетона, или же за счет фосфорилирования свободного глицерола. -Эта реакция катализируется АТФ зависимой глицеролкиназой. После образования фосфоглицерина за счет двух последовательных реакции ацилирования образуется фосфотидная кислота, затем от нее отщепляется остаток фосфорной кислоты и образуется фосфотидная кислота. И наконец в ходе последней реакции ацилировання образуется триглкцерид Этот синтез мы с вами рассматривали в качестве ресинтеза триглицеридов в стенке кишечника. За счет дегидрогиназы фосфоглицерина происходит восстановление и образование фосфорилированного глицерина. Далее идет реакция ацилирования с участием ВЖК активированных с образованием фосфатидной кислоты. Восстановление фосфодиоксиацетона в фосфоглицерол наиболее интенсивно протекает в жировой ткани, в мышцах и печени. Фосфорилирование глицерола и последующие реакции наиболее интенсивно протекают в почках, в стенках кишечника и в печени (т е. в печени есть тот и другой путь образования фосфоглицерина). Синтез резервных триглицеридов идет в основном в период всасывания продуктов пищеварения и соответственно поступление их во внутреннюю среду организма. В постадсорбцеонном периоде происходит мобилизация резервных триглицеридов. Расщепление триглицеридов в клетках идет под действием ферментов липаза. По крайней мере в липоцитах жировой ткани при распаде триглицеридов работают три различных фермента. Вначале при участии триацилглицероллипаз ы происходит гидролиз одной сложной эфирной связи образуется диглицерид и высвобождается свободная жирная кислота. Затем под действием второго фермента так же происходит гидролиз второй сложной эфирной связи и высвобождается еще одна ВЖК остается моноглицерид. С участием последней липазы происходит расщепление моноглицерида на глицерол и ВЖК, фермент - моноацилглицероллипа за. Итак трилипазы.Наименьшую активностью из этих липаз имее тпервый фермент. Поэтому активностью именного этого фермента определяется скорость гидролиза триглицерида в целом. Данный фермент является регуляторным ферментом. Активность этого фермента изменяется под влиянием ряда гормонов, таких как норадреналин, адреналин, глюкагон. Фосфорилированная триглицероллипаза активна, дефосфорилированная -неактивна. 20. Ферменты. Химическаа природа ферментов. классификация и номенклатура ферментов.Ферменты - специализированные белки обладающие каталитической активностью, т.е. способны ускорять течение химической реакции в организме человека. Химическаа природа ферментов. Изучение ферментов показало, что они обладают св-ми белков. Какие св-ва характерны для ферментов? 1) они являются амфотерными 2)осаждаются сульфатом аммония т.е. высаливаются 3) инактивируются при нагревании под действием концентрированных кислот и щелочей 4) неспособны проходить через полупроницаемые мембраны. Абсолютным доказательством белковой природы ферментов - это синтез их из отдельных аминокислот. Сегодня синтезированы из отдельных аминокислот несколько ферментов. Первыми ферментами синтезированные рибонуклеазы (ферменты расщепляющие РНК) и пепсин (основной фермент желудочного сока). Причем синтезированный рибонуклеаза и пепсин ничем не отличались по свойствам по каталитической активности от выделенных из естественных тканей. По хим. составу ферменты как и белки могут быть двух видов - простые и сложные (протеины и протеиды). Несколько слов о протеинах. Они могут состоять из одной полипептидной цепи (рибонуклеаза содержащая 124 ам. ксл. отатка, пепсин, трипсин) В то же время ряд ферментов состоят из нескольких полипептидных цепей т.е. являются олигомернымн белками. Например альдолаза - фермент гликолиза, РНК-полимераза и др. К первой группе относятся обычно класс гидролиз, практически все гадролитические ферменты состоят только из аминокислот т.е. являются простыми белками. Кроме того, некоторые лиазы, а вот все остальные классы ферментов в основном явл. сложными белками т.е. для каталитической активности многих ферментов кроме белковой части необходим второй компонент получивший название кофактор. Есть каталитически активный фермент вместе с кофактором получил название холофермент. Это каталитически активный фермент состоящий из белковой и небелковой части кофактора. Белковая часть холофермента получила название апофермент. Характерной особенностью холофермента или сложных ферментов протеидов является, то, что ни белковая часть апофермента, ни кофактор в отдельности не обладают заметной каталитической активностью. Современная классификация и номенклатура ферментов. 1) тривиальная номенклатура 2) рабочая номенклатура З) систематическая номенклатура, т.е. обычно для названия одного и того же фермента очень часто используют несколько названий, поэтому в следствии все возрастающего числа вновь открываемых ферментов было принято международное соглашение о систематической номенклатуре ферментов. В соответствии с этой системой все ферменты в зависимости от типа катализируемой реакции, я еще раз подчеркиваю что в основу положен тип катализируемых реакций, делят на 6 больших классов. В каждом классе выделяют подкласс. В подклассе выделяют под подкласс, а уже там соответственно название конкретного фермента. Шифр фермента для того что бы было понятно о каком ферменте говорит китаец если его читает русский. Например 4 буквенное обозначение 1 -ая класс, 1 подкласс, 1 под подкласс и первый порядковый номер в этом под подклассе, т.е. шифр фермента всегда включает 4-ех цифровое обозначение.Какие же классы по международному соглашению 1961 г. выделяют? а). Оксидоредуктазы - ферменты катализирующие окислительно-восстан овите льные реакции в организме человека б). Трансферазы - ферменты катализирующие реакции с переносом групп между различными веществами. Например переносящие метильную группу - метилтрансферазы, аминогруппу переносящие - аминотрансферазы и т.д. в). Гидролазы - ферменты катализирующие реакции гидролиза (гидролиз - расщепление с присоединением воды Гидролитических ферментов достаточно много. С пищей мы получаем полимеры, для того чтобы они всасывались их нужно расщепить до мономеров. г). Лиазы -1. ферменты катализирующие присоединение групп по двойной связи (имеется ввиду по месту разрыва двойной связи). 2. Разрыв углерод - углеродной связи, водородными иегидролитическим путем. Например, фермент декарбоксилаза, отщепляющая карбоксильную группу от аминокислоты, как раз относится к лиазам. д). Изомеразы - ферменты катализируют реакции изомеризации. В основном это перенос групп внутри молекул с образованием изомерных форм. Например превращение глюкозы 1- фосфат в глюкозу 6 -фосфат, т.е перенос фосфорильного остатка от первого.е). Лигазы или синтетазы - ферменты которые катализируют образование связи С-С, C-S, C-N, С-О за счет реакции конденсации сопряженных с использованием АТФ, т.е это реакции эндоорганические,тре бующи е притокаэнергии. В настоящее время идентифицировано более 2000 различ. ферментов, причем 200 из них получены и используются достаточно хорошо в кристаллическом виде. В наше время ферменты используются не только в медицине, но и в пищевой и хим. промышленности, в народном хоз-ве, для получения особо чистых препаратов (лекарств). Ферменты - специализированные белки обладающие каталитической активностью, т.е. способны ускорять течение химической реакции в организме человека. Ферменты, будучи биокатализаторами, отличаются от обычных катализаторов. Каково значение ферментов в организме человека? Ферменты по праву считают рабочим аппаратом ген. Дело в том, что как реализуют этот фермент? Все зависит от того насколько активны у вас ферменты полученные. Не секрет что сидящие здесь имеют одни и те же ферменты, но ферменты работают у каждого индивидуально. У каждого из нас поддерживается 1. Определенная концентрация ферментов. 2. Поддерживается еще и за счет синтеза активность определенных ферментов, поэтому метаболизм наш в целом очень различается. Ферменты по праву считают функциональными единицами клеточного метаболизма, поскольку большинство реакций протекающих в наших клетках (ежесекундно в наших клетках протекает десятки тысяч разнообразных химических превращений) идут с участием ферментов, за редким исключением. Только в том случае если в ходе реакции образуется какое-то неустойчивое соединение его стабилизация происходит самопроизвольно т.е. не ферментативным путем. Поэтому изучение ферментов имеет огромное значение для понимания метаболизма, для понимания патологий которые могут развиться у человека. Ферменты осуществляют превращение таким образом огромного кол-ва вещ-в, причем в-в поступающих из внешней среды и в-в образующихся в ходе метаболизма, т.е. непосредственно внутри организма. Некоторые болезни человека особенно генетически обусловленные заболевания связаны с недостаточностью или полным отсутствием того или иного фермента. 21.Переваривание белков в желудочно-кишечном тракте. Переваривание белков представляет собой расщепление пищевых белков на составляющие его аминокислоты Расщепление белков в желудочно-кишечном тракте .идет при участи фериетов протеиназ катализир гидролитическое расщепление юс гвптидных связей Все протеиназы к-к тракта могут быть разделены на 2 группы В данном случае эффективность катализа неизмеримо меньше Специфичность действия протеиназ выглядит следующим образом. Пепсин катализ разрыва летпидных связей образованных аминогруппами фенилаланина и тирозина (ароматические аминокислоты) Трипсин - катализ разрыва пептндкых связей образованных карбоксильными группами лизина и аргинина (основные аминокислоты) Хемотрипсин - кмалнз разрыва пептидных связей образованных карбоксильными группами трех аминокислот ароматических фениалаланнана, тирозина и триптофана Карбоксипептидаза А -образованных С концевыми аминокислотами фенилаланнна, тирозина и триптофана Карбоксипептидаза —образованиях С концевыми лизином и аргинином. Аланинаминопептидаза — образованных N концевым аланином В целом протеяшш ж-к тракта в отношении своей специфичности обладают дополнительностью действия т е за счет совокупности их (згаяитического эффекта с большой скоростью идет гидролиз пеПгияиых связей к белковых молекулах. Более того отсутствие одной из протеннвз за исключением трипсина обычно не приводит к существенному нарушению переваривания белков. Переваривание белков в желудке. Переваривание белков начинается в желудке В желудочном соке присутствует несколько протеиназ пепсин, гастриксин и несколько сходных с пепсином протеиназ Одним из таких ферментов является пепсин В У детей юиетея еще одна эндопротеиназа ренин Главной протеиназой желудочного свка пуослих несомненно является пепсин. Клетки слизистой дна Желудка вырабатывают профермент пепсияоген. Его молекулярная масса составляет величину килодальтон Под действием соляной кислоты желудочного сока пепсиноген в результате ограниченного протно виа превращается в пепсин молекуляр масса кот равна 32,7 килодальтон. Оптимальной средой для действия пепсина является среда с рН 1- 2,5 Это значение создается в желудке соляной кислотой. Белки под действием пепсина расщепляются в желудке с образованием смеси пептидов различной длины с очень небольшой примесью свободных аминокислот, причем пепсин обеспечивает 95 % всей переваривающей способности желудочного сока Например действие гасгрикшиа ограничено поскольку оптимум рН для этого фермента составляет величину порядка 5 Важным компонентом желудочного сока является несомненно соляная кислота, которая кроме участия в переводе пепсиногена в пепсин создает оптимум рН для действия пепсина Это так называемое значение соляной кислоты 1 перевод пепсиногена в пепсин 2, создание оптимума рН для пепсина 3. денатурирует белки 4. бактерицидное действие. Переваривание белков в кишечнике. Смесь полипептидов из желудка в 12перстнук> кишку где под действием протеиназ поджелудочного и кишечного сока продолжается расщепление белков и пеетидов до отдельных аминокислот. рН составляет от 7,5-8,2 это слабощелочное значение рН поддерживается за счет бикарбонатов поступающих в кишечник с соком поджелудочной железы. В поджелудочной железе синтезируется протоэнзимы. трипсиноген, хемотрнпсиноген, прокарбоксипептидазы А и В, проэластаза проколлагеназа С соком поджелудочной железы эти проферменты поступают в просвет кищечнкка и в результате избирательного ограниченного протиолиза превращаются в активные ферменты Важнейшую роль в превращении проферментов в ферменты принадлежит 2-м протеиназам 1 Энтерокиназа кишечной стенки 2 Трипсин Как они работают? Энтерокиназа отщепляет от неактивного трипсиногена гексопептид (6 амк остатка).превращаяпр оферм ент в активный трипсин. В дальнейшем превращение трипсиногена в трипсин может идти параллельно, путем аутокатализа. Образовавшийся трипсин превращает все другие проферменты в активные Ферменты,Хемотрипсиноген А или В под действием трипсина превращается в одну из форм активного Действие протеиназ поджелудочной железы дополняется действием ферментов синтезируемых в стенках кишечника Кишечная стенка синтезирует про аминопептидазу и про-дипептидазу. Перевод в активную форму идет так же за счет трипсина. Механизм перевода единый отщепление различной длины путем ограниченного протиолиза и фо активного центра Под действием этого комплекса ферментов белки и пептиды расщепляются до отдельных аминокислот и в таком виде всасываются в стенку кишечника. Всасывание ди-, три-, тетрапептидов абсолютно невозможно 23.Обезвреживание аммиака в оргамизме. Орнитиновый цикл мочевинообразования.Аммиак токсичен (50 мг аммиака убивает кролика, при этом [NH3]=0,4-0,7 мг/л). Поэтому в тканях аммиак обезвреживается временными путями: 1) в основном – образованием амидов дикарбоновых кислот. Напр., ГЛУ + NH3 → ГЛН (над стрелочкой "глутаминсинтетаза", под стрелочкой – АТФ → АДФ + Фн). Аналогично АСП → АСН.
24. Декарбоксилирование.Биогенные амины. Процесс отщепления карбоксильной группы аминокислот в виде CO2 получил название декарбоксилирования. Несмотря на ограниченный круг аминокислот и их производных, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции — биогенные амины (т. н. «Трупные яды») — оказывают сильное фармакологическое действие на множество физиологических функций человека и животных. Необходимо отметить, что в условии клетки декарбоксилировакие является необратимым процессом Биогенные амины обладают высокой биологической активностью и несомненно после выполнения основных функций они должны быть инакгивированы Общим путем инактивации биогенных аминов является их окислительное дезаминирование с участием ферментов моноаминооксидаз или диаминооксидаз R-CH2-NH2 --> R-C(--O)-H + NH3 Биогенный амин, в данном случае моноамин, поэтому фермент моноаминооксидаза (оксидаза способна переносить отщепляемый водород непосредственно на кислород с образованием перекиси водорода), превращается в альдегид, который затем окисляется до жирной кислоты, а перекись водорода расщепятся католазой Некоторые биогенные амины, например гистамин. могут инактивироваться путем метилирования или ацетилирования. Образование этих биологически активных. Из аминокислоты гистидина под действием гистидиндекарбоксила зы образуется биогенный амин - гистамин -клеточный медиатор (медиатор воспаления, аллергии) Антигистаминные препараты используются крайне широко Гистамин обладает выраженным сосудорасширяющим действием, причем это эффект у единственного из биогенных аминов, кроме того 2 Он участвует в развитии воспалительных в том числе аллергических реакциях 3 Наконец он стимулирует выделение желудочного сока и в этом качестве он нашел применение в клиническо-лаборатор ной диагностике для установления причины нарушения секреции желудочного сока - шстаминовая проба Инактивация гистамина идет либо за счет его дезаминнрования либо путем образования N-метипгистидина, т е путем метилирования. Аминокислота триптофан служит предшественником еще одного очень важного амина - серотонин Вначале триптофан подвергается гидроксилированию с превращением в 5-окситриптофан, а уже затем под действием соответствующей декарбоксилазы происходит образование серотонина Серотонин является нейромедиатором стволовой части головного мозга 1 При нарушении его обмена развивается галлюциногенный синдром (галлюцинации устрашающего характера и зрительные и слуховые) 2 Сегодня считают, что нарушение обмена серотонина вносит весомый вклад в развитие шизофрении 3 Он является так же мощными сосудосуживающим средством Инактивация серотонина идет или путем его окислительного дезаминирования или же путем метилирования по аминогруппе, т е по сути инактивация идет как у гистомина 1 Серотонин играет важную роль в развитии аллергии 2 Серотонин является предшественником гормона эпифиза мелатонина Три биогенных амина (дофамин норадреналин и адреналин = котихоламины) образуются еще из одной циклической аминокислоты - тирозина. Тирозин гидроксилируется с превращением в ДОФА (диоксифениламнин), затем ДОФА декарбоксилируется и превращается в дофамин .Дофамин является промежуточным продуктом при синтезе норадреналина и адреналина, он обладает выраженным сосудосуживающим действием, самое важное то, что он является медиатором стволовой части головного мозга При нарушении его образования в мозговой ткани развивается тяжелое заболевание паркинсонизм Для лечения которого используют подсадку в головной мозг эмбриональных клеток способных синтезировать дофамин При гидроксилировании дофамина образуется норадреналин, который при последующем метилировании дает адреналин В реакции превращения дофамина в норадреналин участвует аскорбат (аскорбат участвует в синтезе гормонов) При переходе норадреналина в адреналин в качестве метилирующего агента используется активный Норадреналин и адреналин являются во-первых медиаторами симпатической нервной системы во-вторых гормонами мозгового вещества надпочечников Оба зтих биогенных амина обладают сосудосуживающим действием В качестве гормона адреналин является мощным стимулятором расщепления гликогена в мышцах Кроме того адреналин является мощным стимулятором липолиза в жировой гкани. В стрессовых ситуацияхлюдихудеют. Инактивирование названных биогенных аминов осуществляется в основном путем их дезаминирования с участием оноаминооксидаз или же путем метилирования. Кроме названных 2-х путей есть еще один путь инактивации этих аминов процессы глюкуроянрования происходящее в печени. Декарбоксилированию кроме ароматических аминокислот могут подвергаться аминокислоты жирного ряда, в частности глютомат. Образующееся при декарбоксилировании глутомата соединение является медиатором и носит название - у аминомаслянная кислота. Это соединение сегодня известно как тормозной медиатор коры головного мозга В ходе декарбоксилирования таких аминокислот как арнитин и лизин образуется диамины - путрисцин и кодаверин эти соединения используются при синтезе полиаминов, сперминов и спермидина, которые участвуют в регуляции процессов пролиферации клеток. 26. Гормоны. Общее понятие о гормонах. Номенклатура и классификация гормонов.Гормоны – вещества органической природы, вырабатывающиеся в специализированных клетках желез внутренней секреции, поступающие в кровь и оказывающие регулирующее влияние на обмен веществ и физиологические функции.Гормоны вызывают либо быструю (срочную) реакцию, либо медленную реакцию (стероидные гормоны), связанную с синтезом ферментов de novo. Любые нарушения синтеза или распада гормонов, вызванные разнообразными причинными факторами, включая заболевания эндокринных желез (состояние гипо- или гиперфункции), приводят к изменению нормального синтеза ферментов и, соответственно, к нарушению метаболизма.Специфические особенности биологического действия гормонов можно выразить тремя положениями:а) гормоны оказывают биологическое действие в ничтожно малых концентрациях от (10-9 до 10-12 г);б) действие гормонов в целостном организме определяется в известной степени контролирующим влиянием ЦНС;в) железы внутренней секреции и продуцируемые ими гормоны составляют единую систему, тесно связанную при помощи механизмов прямой и обратной связи.Несмотря на то, что химическая природа почти всех гормонов выяснена в деталях, до настоящего времени не разработаны общие принципы их номенклатуры. Принятая номенклатура указывает на источник происхождения гормона (например, инсулин от лат. insula – островок) лил отражает его функцию (например, пролактин). Все известные гормоны, по их химической природе, можно разделить на 5 групп:Сложные белки – гликопротеиды (фолликулостимулирующий, лютеинизирующий и тиреотропный гормоны);Простые белки (пролактин, инсулин и др.);Пептиды (АКТГ, глюкагон, кальцитонин, соматостатин и др.);Производные аминокислот (адреналин, норадреналин и др.);Стероидные соединения, гормоны коры надпочечников (кортикостероиды) и половые гормоны (андрогены и эстрогены). Механизм действия гормонов Молекулы гормонов белковой природы, гормонов пептидов и гормоны производных аминокислот за исключением полированных тиронинов гидрофильны, поэтому они без особых проблем переносятся током крови, но не могут проникать через мембраны клеток, поэтому рецепторы для таких гормонов локализуются в наружной клеточной мембране, причем гормон связывающий домен этих рецепторов расположен всегда на внешней стороне мембраны и может взаимодействовать с гормоном, находящимся в жидкости окружающей клетку. Поэтому требуется специальный механизм, обеспечивающий трансформацию внеклеточного регулягорного сигнала в сигнал внутриклеточный. Это связано с синтезом в клетке соединений выступающих в клетки "вторых вестников" (мессенджеры). Механизмы действия отдельных гормонов этой группы сильно различается, тем не менее формирование ответа клетками на воздействие регуляторного сигнала всегда начинается с образования гормон-рецепторного комплекса. Образование этого комплекса сопровождается в дальнейшем генерацией химического сигнала изменяющего метаболизм клетки Рецепторы этих биорегуляторов локализуются на внешней стороне наружной клеточной мембраны. Далее происходит активация О,-белка и этот белок взаимодействует с аденилатциклазой. Адекилатциклаза отщепляет отАТФпирофосфат и образуется цАМФ, который далее соединяется с ферментом с АМФ-зависимой протеинкиназой (А-киназа) и пререаодит фермент в активную форму. Неактивная форма представляет собой тетромер, состоящий из 2-х каталитических и 2-хрегуляторных субъединиц. При взаимодействии цАМФ происходит диссоциация комплекса на регуляторные субъединицы связанные с цАМФ и свободные каталитические субъединицы способные фосфорилировать различные внутриклеточные белки по остаткам серина или треонина. Это фосфорклировакие белков есть ни что иное как ковалентная модификация которая сопровождается изменением их фуккщшналъной активности, т.е. в клетке меняется каталитическая активность фермента, изменяется способность транспортных белков переносить свои лиганды через мембраны, а фосфорилированне белков участвующих в работе механизмов отвечающих за экспрессию генов приводит к изменению количества отдельных белков клетки. За счет этих изменений и формируется метаболический ответ клетки на воздействие гормонов. Возврат клетки в исходите состояние обусловлен работой нескольких механизмов: 1. Поскольку гормон-рецепторный комплекс формируется за счет слабых взаимодействий, то он легко диссоциирует, а сворбодный гормон быстро инактивируется 2. Gs-белок самобладаетспособнос тью гидролизовать ГТФ, поэтому уже через 10-15 секунд активированный Gs-белок послегодролизасвязан ного с ним ГТФ переходит в неактивное состояние, и теряет способность взаимодействовать с аденилатциклазой. 3. цАМФ в клетке быстро расщепляется ферментом ФДЭ - фосфодиэетераза. 4. В клетках имеется ферменты - фосфопротеинфосфатаз ы, которые обеспечивают дефосфорилирование белков, т.е. возврат функцианальной активности клеточных белков к исходному состоянию. По химической природе: 1 Гормоны белковой природы.а) гормоны простые белки (инсулин, соматотротш)б) гормоны сложные белки (тириогропный гормон СП'1"), гонадотропные гормоны -глюкопротеиды) 2 Полипептиды. (либирины и статики гипоталамуса, вазопресин, окснтоцин, гжогон (р-клетки Лангерганса), кортикотропин.)3. Производные аминокислот (адреналин, Кодированные тироникы, метатонии 4. Стероидной природы (кортизол, альдостерон, половые гормоны (эстрадиол, тестостерон, прогестерон)). 27.Гормоны щитовидной железы.Щитовидная железа вырабатывает трииодтиронин и тетрайодтиронин Регуляторныи эффект Т3 и Т4 базируется на контроле генной экспрессии Кодированные тиронины мало растворимы в воде и транспортируются к органам и тканям плазмы крови в комплот е с белками - это тироксинсвязывающий глобулин и тироксинвязывающии преальбуминСинтези выделение иодированных тиронинов стимулируетсятиреотропным гормоном переднейдоли гипофиза В свою очередь выделение тириотропного гормона контролируется гипоталамусом Во первыхза счет выделения тириолиберина стимулирующего выделение Во вторыхс помощью соматостатина ингибирующего выделение тириотропного гормона дифференцировки ведение тироксина экспериментальным животным сопровождается 2 увеличивает теплопродукцию 3 приводит к увеличения активности многих ферментных систем Показано что введение гормона приводит к повышению активности как минимум сотни ферментов. Этоувеличение активности большого числа ферментов отражает резковыраженное стимулирующее действие гормона на синтез белка во многих органах и тканях. Введение тириодных горомнов приводит к увеличению теплопродукции, но это увеличение теплообразования обусловлено не разобщением окисления фосфорилирования, а увеличением расхода АТФ в энергозависимых процессах. Пример: процессы синтеза белка а так же процессы связывание с поддержанием Гипофункция щитовидной железыпроявляется у людей выраженным замедлением метаболических процессов что проявляется например в снижении уровня основного обмена в снижении температуры тела Если гипотериозом страдают новорожденные то задержка умственного развития При гипофункции щитовидной железы у взрослых развивается микседема слизистый отек Характерен низкий уровень основного обмена брадикардия сонливость уровень глюкочы обычно увеличен уровень холистерола Гиперфункция щитовиднои железыгипертириоз базедова болезнь характеризуется люди легко возбудимы у них увеличена щитовидная железа повышена температура тела характерным симптомом является экзофтальмия пучеглазие 28.Гормоны коркового слоя надпочечников. Кортизол. Кора надпочечников выделяет три класса стероидных гормонов, в соответствии с их преобладающими эффектами Глюко- минералокортикоиды и андрогены В целом наблюдается перекрывание их биологической активности, поскольку все природные глкшжортикоиды проявляют и менералокортикоидный эффект и наоборот минералокортикоиды обладают слабовыраженным глюкокортикоидным эффектом Горомны коры надпочечников особенно пшжокортикоиды играют важную роль в адаптации к сильным стрессам В основе структуры всех стерондных гормонов лежит стераиовое ядро.Синтез идут из хролистерола, т еродоначальникомили исходным углеводородом для всех стероидных гормонов является холестерин Синтез кортизола идет в клетках в пучковой и сетчатой зоне коры надпочечников Холистерол поступает в клетки коры надпочечников из коры и только незначительная часть образуется в клетках путем его синтеза из ацетилКоА Первым этапом синтеза кортшола как и других кортикостероидов является укорочение боковой цепи хопистерола и отщепление 6-й углеродного фрагмента с образованием прегненолона- 17-а-гидроксилипаза 21-гидроксилипаза 11-годроксилип прегненолон -> Игодроксипрогестерон -> П-дезоксикортизол -> кортгоол В качестве окислителя в гидроксилазных реакциях используется кислород, косубстратом служит восстановленный НАД Стероидные гормоны практически не накапливаются в коре надпочечников и секреткруются в кровь по мере их синтеза Кортизол оказывает на метаболизм двойственный эффект 1 В клетках печени Это влияние носит явно анаболический характер 2 В периферических тканях преобладает катаболический эффект При ведении кортизола наблюдается увеличение скорости глкжоиеогенеза, что сопровождается выбросом глюкозы в кровь и нарастает содержание гликогена в печени Активация глюконеогенеза базируется на увеличении количества целого ряда ферментов, отвечающих как за дезаминирования аминокислот, так и за исгшьзование углеродных скелетов для синтеза глюкозы Одновременно в периферических тканях кортизол стимулирует выход аминокислот в кровь ив то же время тормозит поступление глюкозы из крови в клетки периферических тканей т е сберегает глюкозу Введение кортизола приводит к увеличению ВЖК плазме крови Частично это является результатом стимуляцией липолиза, причем избыточное количество кортизола стимулирует липолиз в жировой тканей конечностей с одновременной стимуляцией лгоюгенеза в жировой ткани туловища и лица. 29. Инсулин, глюкагон. Инсулин относится к гормонам белковой природы. Он синтезируется b-клетками поджелудочной железы. Инсулин является одним из важнейших анаболических гормонов. Связывание инсулина с клетками-мишенями приводит к процессам, которые увеличивают скорость синтеза белка, а также накопление в клетках гликогена и липидов, являющихся резервом пластического и энергетического материала. Инсулин, возможно за счет своего анаболического эффекта, стимулирует рост и размножение клеток. Молекула инсулина состоит из двух полипептидных цепей - А-цепи и В-цепи. В состав А-цепи входит 21 аминокислотный остаток, в состав В-цепи - 30. Эти цепи связаны между собой двумя дисульфидными мостиками: один между А7 и В7 ( номера аминокислот, считая с N-концов полипептидных цепей ), второй между А20 и В19. Третий дисульфидный мостик находится в цепи А, связывая А6 и А11. Главным физиологическим стимулом выделения инсулина из b-клеток в кровь является повышение содержания глюкозы в крови. Влияние инсулина на обмен углеводов можно охарактеризовать следующими эффектами:1.Инсулин увеличивает проницаемость клеточных мембран для глюкозы в так называемых инсулин-зависимых тканях. 2.Инсулин активирует окислительный распад глюкозы в клетках. 3.Инсулин ингибирует распад гликогена и активирует его син тез в гепатоцитах. 4.Инсулин стимулирует превращение глюкозы в резервные триглицериды. 5.Инсулин ингибирует глюконеогенез, снижая активность некоторых ферментов глюконеогенеза. Влияние инсулина на обмен липидов складывается из ингибирования липолиза в липоцитах за счет дефосфорилирования триацилглицероллипаз ы и стимуляции липогенеза. Инсулин оказывает анаболическое действие на обмен белков: он стимулирует поступление аминокислот в клетки, стимулирует транскрипцию многих генов и стимулирует, соответственно, синтез многих белков, как внутриклеточных, так и внеклеточных. ГЛЮКАГОН Глюкагон представляет собой гормон полипептидной природы, выделяемый a-клетками поджелудочной железы. Основной функцией этого гормона является поддержание энергетического гомеостаза организма за счет мобилизации эндогенных энергетических рессурсов, этим объясняется его суммарный катаболический эффект. В состав полипептидной цепи глюкагона входит 29 аминокислотных остатков, его молекулярная масса 4200, в его составе от сутствует цистеин. Глюкагон был синтезирован химическим путем, чем была окончательно подтверждена его химическая структура. Основным местом синтеза глюкагона являются a-клетки поджелудочной железы, однако довольно большие количества этого гормона образуются и в других органах желудочно-кишечного тракта. Синтезируется глюкагон на рибосомах a-клеток в виде более длин ного предшественника с молекулярной массой около 9000. В ходе процессинга происходит существенное укорочение полипептидной цепи,после чего глюкагон секретируется в кровь. В крови он находится в свободной форме, его концентрация в сыворотке крови составляет 20-100 нг/л. Период его полужизни равняется примерно 5 минутам. Основная часть глюкагона инактивируется в печени путем гидролитического отщепления 2 аминокислотных остатков с N-конца молекулы. Секреция глюкагона a-клетками поджелудочной железы тормозится высоким уровнем глюкозы в крови, а также соматостатином, выделяемым D-клетками поджелудочной железы. Возможно, что секреция глюкагона ингибируется также инсулином или ИФР-1. Стимулируется секреция понижением концентрации глюкозы в крови, однако механизм этого эффекта неясен. Кроме того, секрецию глюкагона стимулируют соматотропный гормон гипофиза, аргинин и Са2+. Механизм действия глюкагона достаточно хорошо изучен. Ре цепторы для гормона локализованы в наружной клеточной мембране. Образование гормонрецепторных комплексов сопровождается активацией аденилатциклазы и увеличением в клетках концентрации цАМФ, сопровождающимся активацией протеинкиназы и фосфорилированием белков с изменением функциональной активности последних. Под действием глюкагона в гепатоцитах ускоряется мобилизация гликогена с выходом глюкозы в кровь. Этот эффект гормона обусловлен активацией гликогенфосфорилазы и ингибированием гликогенсинтетазы в результате их фосфорилирования. Следует заметить, что глюкагон, в отличие от адреналина, не оказывает влияния на скорость гликогенолиза в мышцах. Глюкагон стимулирует липолиз в липоцитах, увеличивая тем самым поступление в кровь глицерола и высших жирных кислот. В печени гормон тормозит синтез жирных кислот и холестерола из ацетил-КоА, а накапливающийся ацетил-КоА используется для синтезаацетоновых тел. Таким образом, глюкагон стимулирует кетогенез. 30. Гормоны надпочечников. Гормоны мозгового вещества надпочечников. Их влияние на обмен углеводов в организме человека.Мозговое вещество относится к адреналовой системе и вырабатывает гормоны, относящиеся к производным аминокислот. В мозговом веществе вырабатываются адреналин, норадреналин, изопропиладреналин.Все три гормона напоминают по строению аминокислоту тирозин, от которого они отличаются наличием дополнительных ОН-групп в кольце и у β-углеродного атома боковой цепи и отсутствием карбоксильной группы. Предшественником гормонов мозгового вещества надпочечников является тирозин.Биосинтез катехоламинов (адреналин и норадреналин):Все три гормона оказывают мощное сосудосуживающее действие, вызывая повышение кровяного давления и в этом отношении действие их сходно с действием симпатической НС. Кроме того, они оказывают большое влияние на обмен углеводов в организме, в частности введение адреналина вызывает резкое повышение уровня сахара в крови, что обусловлено ускорением распада гликогена в печени и мышцах, т.е. процесса гликогенолиза, под действием фермента фосфорилазы.
31.Гормоны гипофиза. Гормоны гипоталамуса поступают в гипофиз через портальную систему сосудов. Гормоны передней доли гипофиза (аденогипофиза): 1. простые белки; 2. гликопротеины; 3. пептиды семейства проопиомеланокортина (ПОМК). Гормоны - простые белки:1. гормон роста (ГР); 2. пролактин (ПРЛ); 3. плацентарный пролактин (лактоген) (ПЛ) - хорионический соматомаммотропин (ХС). Эти гормоны стимулируют рост и лактацию. Содержат 190-195 аминокислот, они близки по строению и эффекту. Гормон роста содержит 191 АК. Строение на 85% аналогично строению холестерина (ХС) и на 35%- с пролактином (ПРЛ). Концентрация гормона роста выше, чем других гормонов. Секретируется эпизодически. Влияют стрессовые состояния, белковая пища, физические упражнения – при этом повышается секреция. Влияние на обмен веществ: а) повышает синтез белка: - повышает транспорт АК в клетки; - повышает синтез РНК и ДНК; - повышает интенсивность трансляции белков. Гормон роста действует через инсулинподобный фактор роста (ИФР-1,2). ИФР-1- это главный посредник в действии гормона роста. б) влияет на углеводный обмен - антагонист инсулина: - повышает содержание глюкозы в крови - гипергликемия; - снижает периферическую утилизацию; - повышает продукцию глюкозы в процессе глюконеогенеза. в) влияет на липидный обмен, стимулирует липолиз: - увеличивает скорость окисления ВЖК (в печени). г) влияет на минеральный обмен: - задерживает в организме кальций, магний, фосфор, стимулирует рост костной ткани. Гиперсекреция гормона роста у детей проявляется в виде гигантизма, у взрослых - акромегалия. Дефицит - гипосекреция - приводит к карликовости. Пролактин - белок, состоящий из 198 АК. Его секреция увеличивается при беременности и лактации. Участвует в инициации лактации и поддерживает ее уровень. Внутриклеточный медиатор для ПЛ не известен. Хорионический соматомаммолиберин (плацентарный лактоген) - не выполняет строго специфических функций, стимулирует лактацию и лютеотропную активность. Эффекты метаболизма такие же, как и у гормона роста. Гликопротеиновые гормоны гипофиза и плаценты: 1. тиреотропный гормон (ТТГ); 2. лютеинизирующий гормон (ЛГ); 3. фолликулостимулирующий гормон (ФСГ); 4. хорионический гонадотропин (ХГ или ВХГ или ХГЧ). Первые 3 гормона вырабатываются гипофизом, а ХГ – плацентой. Эти 4 гормона структурно близки, они действуют через цАМФ. ФСГ, ЛГ, ХГ - гонадотропины, т.е. они действуют на половые железы. ФСГ связывается с клетками-мишенями (у женщин - фолликулярные клетки яичников, у мужчин - клетки Сертоли семенников). Стимулирует рост фолликулов, подготавливает их к действию ЛГ. В мужском организме ФСГ индуцирует синтез андроген-связывающего белка, стимулирует рост семенников, семенных канальцев, сперматогенез. ЛГ (лютропин). Клетки-мишени - клетки желтого тела у женщины и клетки Лейдена у мужчин. ЛГ стимулирует образование прогестерона у женщин и тестостерона (из холестерина) у мужчин. У женщин стимулирует овуляцию. ХГЧ - хорионический гонадотропин человека - плацентарный гормон, синтезируется в плаценте и по строению близок к ЛГ. Его содержание возрастает в крови и в моче после имплантации (ранний признак беременности). ТТГ. Клетки-мишени - клетки щитовидной железы. Увеличивает синтез трийодтиронина (Т3) и тироксина (Т4). Стимулирует включение йода и гидролиз тиреоглобулина с образованием трийодтиронина и тироксина. ТТГ увеличивает синтез белка в ЩЖ, синтез нуклеиновых кислот, что приводит к увеличению числа и размеров тиреоидных клеток. Образование ТТГ зависит от уровня периферических гормонов - Т3 и Т4. Если их концентрация увеличивается, то синтез ТТГ снижается. Семейство проопиомеланокортина (ПОМК) ПОМК - это молекула-предшественник, состоит из 285 АК-остатков. Этот белок гидролизуется до пептидов, которые и имеют гормональный эффект. Выделяют 3 группы пептидов: 1. АКТГ (адренокортикотропный гормон) Из него могут образовываться a-МСГ (меланоцитстимулирующий гормон) и кортикотропиноподобный пептид; 2. b-липотропин - из него образуются a-липотропин, b-МСГ, b-эндорфины (из него - a-эндорфины, g-эндорфины); 3. N-концевой пептид, из него образуется g-МСГ. АКТГ - полипептид, состоит из 39 АК. Клетки-мишени - клетки коры надпочечников. Повышает синтез стероидов коры надпочечников за счет превращения холестерола в прегненалон. Его содержание значительно возрастает - это предшественник кортикостероидов. Повышает синтез белков и РНК в коре надпочечников. Внутриклеточный посредник - цАМФ. АКТГ стимулирует синтез аденилатциклазы в надпочечниках и жировой ткани, следовательно, интенсивность липолиза повышается. При избытке АКТГ - синдром Кушинга - повышается пигментация кожи, наблюдается отрицательный азотистый баланс, отрицательный баланс К и Р, но задерживается в организме натрий, что приводит к развитию отеков, повышению давления. Гиперсекреция АКТГ повышает уровень глюкозы в крови и может развиться стероидный диабет, повышается уровень свободных жирных кислот в крови, так как повышается липолиз - это характерно для стрессовых ситуаций. b-липотропин - стимулирует липолиз. b-эндорфины - в гипофизе они ацилированны и неактивны, а в ЦНС они свободны и проявляют активность. Они выполняют нейромедиаторную функцию и нейрорегуляторную. Эндорфины имеют те же рецепторы, что и морфины. Эндорфины регулируют чувство удовольствия (счастья). Применение различных опиатов приводит к увеличению числа рецепторов и возникает зависимость от внешних веществ (если количество рецепторов снижается). МСГ - стимулирует меланогенез, т.е. образование меланоцитов и меланина. Гормоны задней доли гипофиза (нейрогипофиза):- вазопрессин (антидиуретический гормон); - окситоцин. Синтезируются в гипоталамусе, а выделяются из задней доли гипофиза. Вазопрессин - по структуре пептид, состоящий из 9 АК. Эти гормоны влияют на сокращения гладкой мышечной ткани, но клетки-мишени различны. Для вазопрессина это клетки сосудов и дистальных извитых канальцев и извитых трубочек почек. В связи с этим вазопрессин повышает обратное всасывание воды (реабсорбцию) в почках, т.е. диурез снижается и повышается сокращение гладкомышечных клеток сосудов. Он действует через вторичный посредник - цАМФ. При нарушении секреции вазопрессина может развиться несахарный диабет (несахарное мочеизнурение - нарушается реабсорбция и объем воды повышается - полиурия, но в моче нет глюкозы). Окситоцин действует на гладкомышечную ткань матки и молочных желез. Посредник неизвестен. Используется для стимуляции родовой деятельности, оптимизирует секрецию молока. 32. Эйкозаноиды. Биологическая роль. Жирные кислоты в организме выполняют несколько функций. Прежде всего несомненно это энергетическая функция. Так же выполняют структурную функцию. Выполняют пластическую функцию Из ацетилКоА (продукт распада жирных кислот) в гепатоцитах синтезируются ацетоновые тела, холестерол А эйкозопентаеновые кислотыиспользуются для синтеза ряда биорегуляторовэто простогландины. тромбоксаны,Особенно необходимо подчеркнуть, что ряд полиненасьпценных жирных кислот относятся к незаменимым Важную роль в регуляции функционирования клеток различных органов и тканей играет производные эйкозопентаеноовых кислот, так называемые эйкозоноиды. К ним относятсяпростоноиды а) простогландины, 6) простоциклины, в)лейкотриены; г) трамбоксаны Первые три группы соединений (простогландины, простошклины, лейкотриены) объединяют так же в группу простоноиды Эйкозополиеновые кислоты - высшие жирные кислоты с 20 атомами углерода в цепи и имеющие в своей структуре несколько двойных связей Простогландины, которые делятся на простогландины а, в, с, d и т д относятся к виорегуляторам паракринной системы. При очень низких концентрациях они вызывают сокращение гладкой мускулатуры, 1 участвуют в развитии воспалительной реакции. 2 они принимают участие в регуляции процесса свертывания крови, и 3 регулируют метаболические пути на уровне клеток Иначе их называют местными гормонамиТромбоксаны образуются в тромбоцитах и после выхода в кровяное русло вызывают сужение кровеносных сосудов и агрегацию тромбоцитовПростоцик янни образуются в стенках кровеносных сосудов и являются сильными ингибиторами агрегации тромбоцитов Лейкотриеныпредставляют собой группу триенов с сопряженными двойными связями Они образуются в тромбоцитах, лейкоцитах и макрофагах в ответ на имуниологические и неимуннологические стимулы а) принимают участие в развитии анофелоксии, б) повышают проницаемость кровеносных сосудов, в) вызывают приток и активацию лейкоцитов. Биосинтез. Эйкозаноиды образуются почти во всех клетках организма. Биосинтез начинается с гидролиза фосфолипидов плазматической мембраны под действием фосфолипазы А2 [1]. Активность этого фермента строго контролируется гормонами и другими биорегуляторами, сопряженными с G-белками. Свободная арахидоновая кислота также является биологически активным соединением. Однако гораздо большее значение имеют ее метаболиты: простагландины, простациклины, тромбоксаны и лейкотриены, которые носят групповое название эйкозаноиды (от греч. eikosi — 20).К эйкозаноидам ведут два главных пути биосинтеза. Первый инициируется простагландин-синтазой,обладающей свойствами циклооксигеназы и пероксидазы [2], второй — липоксигеназой [3].Простагландин-синтаза [2] катализирует двухстадийную реакцию превращения арахидоновой кислоты в простагландин Н2. Последующие реакции, катализируемые различными ферментами, приводят к образованиюпростагландинов, простациклинов и тромбоксанов. Окисление полиеновых кислот при участии липоксигеназы приводит к образованию гидроперокси- игидроксипроизводных жирных кислот, из которых путем дегидратации и за счет различных реакций переноса образуются лейкотриены.Биологическая активность эйкозаноидов. Эйкозаноиды обладают чрезвычайно разносторонней физиологической активностью. Они служат вторичными мессенджерами гидрофильных гормонов, контролируют сокращение гладко мышечной ткани (кровеносных сосудов, бронхов, матки), принимают участие в высвобождении продуктов внутриклеточного синтеза (гормонов, HCl, мукоидов), оказывают влияние на метаболизм костной ткани, периферическую нервную систему, иммунную систему, передвижение и агрегацию клеток (лейкоцитов и тромбоцитов), являются эффективными лигандами болевых рецепторов. Эйкозаноиды действуют как локальные биорегуляторы путем связывания с мембранными рецепторами в непосредственной близости от места их синтеза как на синтезирующие их клетки (аутокринное действие), так и на соседние клетки (паракринное действие). В некоторых случаях их действие опосредовано цАМФ и цГМФ. 35.КЛЕТОЧНЫЕ МЕМБРАНЫ.К клеточным мембранам относятся плазмолемма, кариолвмма, мембраны митохондрий, эндоплазматической сети, аппарата Гольджи, лизосом, перок-сисом. Общей чертой всех мембран клетки является то, что они представляют собой тонкие (6—10 нм) пласты липопротеидной природы (липиды в комплексе с белками) (рис. 5). Основными химическими компонентами клеточных мембран являются липиды (40 %) и белки (60 %); кроме того, во многих мембранах обнаружены углеводы (5—10 %).К липидам относится большая группа органических веществ, обладающих плохой растворимостью в воде (гидрофобность) и хорошей растворимостью в органических растворителях и жирах (липофильность). Состав ли-пидов в разных мембранах неодинаков. Например, плазматическая мембрана в отличие от мембран эндоплазматической сети и митохондрий обогащена холестерином. Характерными представителями липидов, встречающихся в клеточных мембранах, являются фосфолипиды (глицерофосфатиды), сфингомиелины и из стероидных липидов — холестерин.Особенностью липидов является разделение их молекул на две функционально различные части: гидрофобные неполярные, не несущие зарядов («хвосты»), состоящие из жирных кислот, и гидрофильные, заряженные полярные «головки». Это определяет способность липидов самопроизвольно образовывать двухслойные (билипидные) мембранные структуры толщиной 5—7 нм.Мембраны различаются и набором белковых молекул. Многие мембранные белки состоят из двух частей — участков, богатых полярными (несущими заряд) аминокислотами, и участков, обогащенных неполярными аминокислотами: глицином, аланином, валином, лейцином. Такие белки в липидных слоях мембран располагаются так, что их неполярные участки как бы погружены в «жирную» часть мембраны, где находятся гидрофобные участки липидов. Полярная (гидрофильная) же часть этих белков взаимодействует с головками липидов и обращена в сторону водной фазы. Эти белки как бы пронизывают мембрану, их называют интегральными белка ми мембран. Кроме интегральных белков, существуют белки, частично встроенные в мембрану, — полуинтегральные и примембранные, не встроенные в билипидный слой. По биологической роли белки мембран можно разделить на белки-ферменты, белки-переносчики, рецепторные и структурные белки.Углеводы мембран входят в их состав не в свободном состоянии, они связаны с молекулами липидов или белков. Такие вещества называются соответственно гликолипидами и гликопротеидами. Количество их в мембранах обычно невелико.Как бы ни было велико различие между мембранами по количеству и составу их липидов, белков и углеводов, мембраны обладают рядом общих свойств, определяемых их основной структурой. Все мембраны являются барьерными структурами, резко ограничивающими свободную диффузию веществ между цитоплазмой и средой, с одной стороны, и между матрик-сом и содержимым мембранных органелл, с другой. Особенность же специфических функциональных нагрузок каждой мембраны определяется свойствами и особенностями белковых компонентов, большая часть из которых представляет собой ферменты или ферментные системы. Большую роль в функционировании мембран играют гликолипиды и гликопротеиды над-мембранного слоя.
36.Цветные реакции на белки.значение цветных р-й сост.в том,что они дают возможность обнаружить присутствие белка в биологич.жидкостях,р-рах и установить аминокисл-й состав различ.природных белков. Сущ.2 типа цветных р-й:1.универсальные – биуретовая(на все белки) и нингидриновая(на все альфа-аминок-ты и белки); 2.специфич-е – только на определ.аминок-ты кА в белке,так и в р-ре. Цветные р-и на белки проводят с 1%р-ром яичного белка или лошадиной сывороткой,разведенной в 5 раз 0,85%р-ром NaCl.Цветные реакции на отдельные аминокислоты: ТИР-, ЦИС, АРГ.На тирозин: при добавлении к р-ру белка реактива Миллона (р-р ртути в азот.к-те с небольш.кол-вом NaNO2) и при кипячении образуется кроваво-красный осадок ртутной соли динитротирозина, благодаря наличию в тирозине фенольного ядра. На аргинин: белки, содержащие АРГ,дают розово-красное окрашивание, т.к. арг имеет гуанидиновую группировку,которая в присутствии альфа-нафтола окисляется гипобромитом в щелочной среде и образует продукт конденсации розово-красного цвета. На цис: группы SH в беле или пептиде подвергаются щелочному гидролизу, в рез.чего происходит отщепление серы в виде сульфида
Поиск по сайту: |

 Родоначальником желчных кислот является холевая кислота, которая содержит ОН-группу в 3, 7 и 12 положениях. Производными холевой кислоты являются: 1. хенодезоксихолевая кислота, которая имеет 2 ОН-группы в 3 и 7 положениях; 2. дезоксихолевая кислота, имеющая окси-группы в 3 и 12 положениях; 3. литохолевая кислота, имеющая одну окси-группу в 3 положении. Большая часть желчных кислот в печени конъюгирована глицином и таурином. Их еще называют парные желчные кислоты, например гликохолиевые, таурохолиевые кислоты. Соотношение конъюгатов меняется в зависимости от характера принимаемой пищи. В случае преобладания углеводов увеличивается содержание глициновых конъюгатов. Если преобладают белки в диете, то увеличивается содержание тауриновых конъюгатов. Выделение желчных кислот способствует: 1. эмульгированию жира; 2. активации панкреатических липаз, фосфолипаз; 3. способствуют всасыванию труднорастворимых в воде веществ: ВЖК, ХС, моношлицеридов, жирорастворимых витаминов. При эмульгировании жир дробится на мелкие капельки, что значительно увеличивает поверхность контакта липида с ферментами. Желчные кислоты обволакивают эти капельки, препятствуя тем самым их слиянию. Таким образом стабилизируется эмульсия жира, который будет подвергаться гидролизу под влиянием панкреатических липаз. Помогают гидролизу жира ионы Са2+, которые образуют комплекс со свободными ВЖК. [рис. гидролиза трипальмитина: трипальмитин +3 воды® (липаза) глицерин+ 3 С15Н31СООН] [рис. гидролиза фосфатидилхолина: фосфатидилхолин +4 воды®(фосфолипазы А1, А2, С, D) глицерин + С15Н31СООН + С17Н31СООН +Н3РО4 +НО-СН2- СН2-Nº( СН3) 3] Фосфолипаза А1 действует на связь между глицерином и предельной ВЖК, А2 – между глицерином и непредельной ВЖК, С – между глицерином и фосфорной кислотой, D – между фосфорной кислотой и холином (HO-CH2-CH2-N+(CH3)3). В результате гидролиза пищевого жира образуются спирты, фосфаты, ВЖК, азотистые основания, АК и другие соединения. Необходимо отметить, что в расщеплении жиров принимают участие и кишечные липазы, но их активность невысокая. К тому же они расщепляют только моноглицериды. Установлено, что всасывание продуктов гидролиза жира имеет свои особенности. Легко всасываются простой диффузией в слизистую кишечника спирты, АК, фосфаты, короткоцепочечные ВЖК (10-14 атомов С), азотистые основания. Труднорастворимые в воде продукты гидролиза (ВЖК, моноглицериды, холестерин, жирорастворимые витамины) всасываются только в комплексе с желчными кислотами. Эти комплексы называются холеиновыми. В таком виде эти соединения проходят через биомембраны энтероцитов. В эпителии клеток ворсинок кишечника происходит распад холинового комплекса. При этом желчные кислоты сразу поступают в ток крови и через систему воротной вены попадают в печень, откуда они вновь поступают в составе желчи в желчный пузырь и могут вновь принимать участие в новом акте переваривания жира пищи.Установлено, что общий фонд желчных кислот у взрослого человека составляет 2,8-3,5 г. При этом они совершают 5-6 оборотов в сутки за счёт печёночно-кишечной циркуляции. После того, как продукты гидролиза жира поступили в энтероциты, в стенке кишечника начинают синтезироваться жиры, специфичные для данного организма, которые по своему строению отличаются от пищевого жира.
Родоначальником желчных кислот является холевая кислота, которая содержит ОН-группу в 3, 7 и 12 положениях. Производными холевой кислоты являются: 1. хенодезоксихолевая кислота, которая имеет 2 ОН-группы в 3 и 7 положениях; 2. дезоксихолевая кислота, имеющая окси-группы в 3 и 12 положениях; 3. литохолевая кислота, имеющая одну окси-группу в 3 положении. Большая часть желчных кислот в печени конъюгирована глицином и таурином. Их еще называют парные желчные кислоты, например гликохолиевые, таурохолиевые кислоты. Соотношение конъюгатов меняется в зависимости от характера принимаемой пищи. В случае преобладания углеводов увеличивается содержание глициновых конъюгатов. Если преобладают белки в диете, то увеличивается содержание тауриновых конъюгатов. Выделение желчных кислот способствует: 1. эмульгированию жира; 2. активации панкреатических липаз, фосфолипаз; 3. способствуют всасыванию труднорастворимых в воде веществ: ВЖК, ХС, моношлицеридов, жирорастворимых витаминов. При эмульгировании жир дробится на мелкие капельки, что значительно увеличивает поверхность контакта липида с ферментами. Желчные кислоты обволакивают эти капельки, препятствуя тем самым их слиянию. Таким образом стабилизируется эмульсия жира, который будет подвергаться гидролизу под влиянием панкреатических липаз. Помогают гидролизу жира ионы Са2+, которые образуют комплекс со свободными ВЖК. [рис. гидролиза трипальмитина: трипальмитин +3 воды® (липаза) глицерин+ 3 С15Н31СООН] [рис. гидролиза фосфатидилхолина: фосфатидилхолин +4 воды®(фосфолипазы А1, А2, С, D) глицерин + С15Н31СООН + С17Н31СООН +Н3РО4 +НО-СН2- СН2-Nº( СН3) 3] Фосфолипаза А1 действует на связь между глицерином и предельной ВЖК, А2 – между глицерином и непредельной ВЖК, С – между глицерином и фосфорной кислотой, D – между фосфорной кислотой и холином (HO-CH2-CH2-N+(CH3)3). В результате гидролиза пищевого жира образуются спирты, фосфаты, ВЖК, азотистые основания, АК и другие соединения. Необходимо отметить, что в расщеплении жиров принимают участие и кишечные липазы, но их активность невысокая. К тому же они расщепляют только моноглицериды. Установлено, что всасывание продуктов гидролиза жира имеет свои особенности. Легко всасываются простой диффузией в слизистую кишечника спирты, АК, фосфаты, короткоцепочечные ВЖК (10-14 атомов С), азотистые основания. Труднорастворимые в воде продукты гидролиза (ВЖК, моноглицериды, холестерин, жирорастворимые витамины) всасываются только в комплексе с желчными кислотами. Эти комплексы называются холеиновыми. В таком виде эти соединения проходят через биомембраны энтероцитов. В эпителии клеток ворсинок кишечника происходит распад холинового комплекса. При этом желчные кислоты сразу поступают в ток крови и через систему воротной вены попадают в печень, откуда они вновь поступают в составе желчи в желчный пузырь и могут вновь принимать участие в новом акте переваривания жира пищи.Установлено, что общий фонд желчных кислот у взрослого человека составляет 2,8-3,5 г. При этом они совершают 5-6 оборотов в сутки за счёт печёночно-кишечной циркуляции. После того, как продукты гидролиза жира поступили в энтероциты, в стенке кишечника начинают синтезироваться жиры, специфичные для данного организма, которые по своему строению отличаются от пищевого жира. →
→ 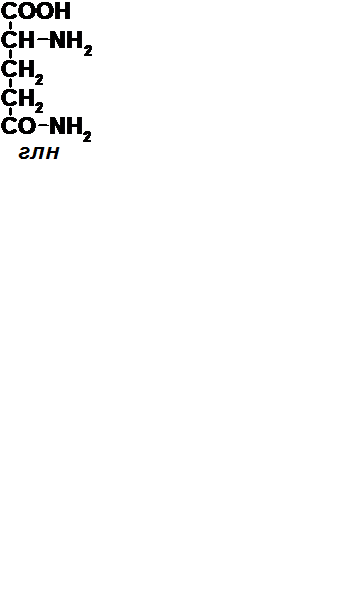
 →
→  2) восстановительное аминирование кетокислот. Этот путь и дает токсичность аммиака (из-за уменьшения кол-ва кетокислот).Такой азот (в виде конъюгатов аммиака) посупает в печень, где происходит окончательное обезвреживание аммиака – образование мочевины. Небольшое количество аминов отдают аммиак в почках, где он сразу синтезируется в мочу, где соединяется с протонами, образуя ионы аммония, которые выводятся с мочой. (В крови NH4+ нет!)Орнитиновый цикл мочевинообразования.Мочевина содержит 80-90% всего азота мочи. В сутки образуется 25-30 г мочевины NH2-CO-NH2. 1. NH3 + CO2 + 2АТФ + Н2О → H2N-CO-OPO3H2 + 2АДФ + Н3РО4 (над стрелочкой карбамоилфосфатсинтетаза). Образуется карамоилфосфат. 2. NH2-(CH2)3-CH(NH2)-COOH (это орнитин) + H2N-CO-OPO3H2 (это карбамоилфосфат) ® (орнитинкарбамоил-ТФ, – Н3РО4) NH2-CO-NH-(CH2)3-CH(NH2)-COOH (это цитруллин) Далее: NH2-CO-NH-(CH2)3-CH(NH2)-COOH (это цитруллин) +COOH-CH(NH2)-CH2-COOH (это АСП)® аргининосукцинатсинтетаза, АТФ→АМФ+ФФн) СООН-СН2-СН(СООН)-NH-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргининосукцинат) ®(аргининосукцинатлиаза) СООН-СН=СН-СООН (это фумарат, который идете в ЦТК)) +NH2-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргинин). Затем: NH2-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргинин)® (аргиназа, +Н2О) NH2-C(=O)-NH2 (это мочевина) + NH2-(CH2)3-CH(NH2)-COOH (это орнитин)Т.о., для синтеза мочевины необходимо два азота – один из АСП и один из ГЛУ, ГЛН, АЛА; а также 3 АТФ и 1 СО2.
2) восстановительное аминирование кетокислот. Этот путь и дает токсичность аммиака (из-за уменьшения кол-ва кетокислот).Такой азот (в виде конъюгатов аммиака) посупает в печень, где происходит окончательное обезвреживание аммиака – образование мочевины. Небольшое количество аминов отдают аммиак в почках, где он сразу синтезируется в мочу, где соединяется с протонами, образуя ионы аммония, которые выводятся с мочой. (В крови NH4+ нет!)Орнитиновый цикл мочевинообразования.Мочевина содержит 80-90% всего азота мочи. В сутки образуется 25-30 г мочевины NH2-CO-NH2. 1. NH3 + CO2 + 2АТФ + Н2О → H2N-CO-OPO3H2 + 2АДФ + Н3РО4 (над стрелочкой карбамоилфосфатсинтетаза). Образуется карамоилфосфат. 2. NH2-(CH2)3-CH(NH2)-COOH (это орнитин) + H2N-CO-OPO3H2 (это карбамоилфосфат) ® (орнитинкарбамоил-ТФ, – Н3РО4) NH2-CO-NH-(CH2)3-CH(NH2)-COOH (это цитруллин) Далее: NH2-CO-NH-(CH2)3-CH(NH2)-COOH (это цитруллин) +COOH-CH(NH2)-CH2-COOH (это АСП)® аргининосукцинатсинтетаза, АТФ→АМФ+ФФн) СООН-СН2-СН(СООН)-NH-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргининосукцинат) ®(аргининосукцинатлиаза) СООН-СН=СН-СООН (это фумарат, который идете в ЦТК)) +NH2-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргинин). Затем: NH2-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргинин)® (аргиназа, +Н2О) NH2-C(=O)-NH2 (это мочевина) + NH2-(CH2)3-CH(NH2)-COOH (это орнитин)Т.о., для синтеза мочевины необходимо два азота – один из АСП и один из ГЛУ, ГЛН, АЛА; а также 3 АТФ и 1 СО2.