 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Осмос. Осмотическое давление
Осмос – односторонняя самопроизвольная диффузия молекул растворителя через полупроницаеумю перегородку из раствора с низкой концентрацией в раствор с более высокой концентрацией. Полупроницаемые перегородки способны пропускать только молекулы растворителя, но не пропускают молекулы растворенного вещества. Примеры: природные полупроницаемые перегородки - стенки растительных и животных клеток, стенки кишечника; искусственные полупроницаемые перегородки – целлофан, пергамент, пленки из желатина. Количественной характеристикой осмоса является осмотическое давление раствора. Осмотическим давлением (Pосм.)называют избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью. К осмотическому давлению применимы все законы газового давления и для его вычисления можно использовать уравнение Клапейрона- Менделеева m P*V = M*R*T m P = M*V*R*T m См = M*V В 1887 г Вант-Гоффом в результате исследований была установлена такая зависимость:
P осм. = См*R*T [кПа] См –молярная концентрация растворенного вещества, моль/л R – универсальная газовая постоянная, 8,314 Дж/моль* К T – температура, К. Закон Вант-Гоффа: Осмотическое давление разбавленного идеального раствора неэлектролита равно тому давлению, которое производило бы растворенное вещество, если бы при той же температуре находилось бы в газообразном состоянии и занимало бы объем, равный объему раствора. Однако это уравнение справедливо только для растворов, в которых отсутствует взаимодействие частиц, т.е. для идеальных растворов. В реальных растворах имеют место межмолекулярные взаимодействия между молекулами вещества и растворителя, которые могут приводить или к диссоциации молекул растворенного вещества на ионы, или к ассоциации молекул растворенного вещества с образованием из них ассоциатов. Понижение давления пара над растворами приводит к тому, что они кипят и замерзают при температурах, отличающихся от соответствующих темпера- тур для чистых растворителей. Известно, что жидкость закипает, когда дав- ление ее насыщенного пара становится равным внешнему давлению, а кри- сталлизация жидкости начинается в тот момент, когда давление ее насыщен- ных паров становится равным давлению над твердой фазой, в которую она переходит. Поэтому растворы кипят при более высоких температурах (tК р-ля), а замерзают при более низких температурах (tЗ р-ля), чем чистые растворители (tЗ р-ля). Второй закон Рауля Второй закон Рауляопределяет зависимость температуры кристаллизации и кипения раствора от концентрации растворенного вещества: Повышение температуры кипения и понижение температуры кристаллизации разбавленных идеальных растворов пропорциональны моляльной концентрации растворенного вещества. Δtкип = Ккип·Сm, Δtкp = Ккр·Сm. Сm -моляльная концентрация раствора (моль/кг); Ккип - эбуллиоскопическая константа или константа кипения растворителя; Ккр - криоскопическая константа или константа кристаллизации растворителя. Для воды Ккип = 0,52°С, Ккр = 1,86°С.
5. Основные законы прохождения химической реакции. Первое начало термодинамики. Термохимические уравнения. Закон Гесса. Энтропия как функция состояния. Факторы, определяющие направление химической реакции. Свободная энергия Гиббса. Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1. Например, для реакции: Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: · природа реагирующих веществ, · наличие катализатора, · температура (правило Вант-Гоффа), · давление, · площадь поверхности реагирующих веществ. Химическая термодинамика изучает энергетические эффекты, сопровождающие химические процессы, а также возможность и направление самопроизвольного протекания процессов. Системой называется тело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособляемых от нее. В любом процессе соблюдается закон сохранения энергии: Это соотношение называется первым началом термодинамики и означает, что если к системе подводится теплота Q, то она расходуется на изменение внутренней энергии ΔU и на совершение работы A. Под внутренней энергией системы U подразумевается общий ее запас (энергия движения молекул, электронов, внутриядерная энергия и т.д.) кроме кинетической и потенциальной энергии системы в целом. Работа обычно совершается при расширении системы против внешнего давления и при постоянном давлении равна A=PΔV. Поэтому первое начало термодинамики можно записать в виде: Величина H=U+PV называется энтальпией. Таким образом, тепловой эффект процесса при постоянном давлении равен изменению энтальпии ΔH. При постоянном объеме V1=V2, поэтому Qv=ΔU. Qv≠Qp, т.е. тепловой эффект процесса зависит от условий его протекания. В лабораторных условиях реакции обычно проводятся при постоянном давлении (например, в колбе). Тепловые эффекты, измеренные при атмосферном давлении (101325 Па) называются стандартными и обозначаются ΔH°. В обозначении может указываться абсолютная температура, при которой определен тепловой эффект, например Реакции могут протекать с выделением тепла (экзотермические) и с его поглощением (эндотермические). Уравнения реакций, в которых указан тепловой эффект, называются термохимическими. Закон Гесса: Тепловой эффект процесса зависит только от состояния исходных веществ и конечных продуктов, но не зависит от способа его проведения. Проиллюстрируем применение закона Гесса схемой образования углекислого газа при окислении графита:
Углекислый газ может быть получен в одну стадию; тепловой эффект этой стадии равен ΔH.Двухстадийный путь состоит в окислении графита сначала до CO (тепловой эффект стадии равен ΔH1), а затем до CO2 (тепловой эффект ΔH2). При обоих способах проведения процесса система переходит из одного и того же начального состояния (графит) в одно и то же конечное (углекислый газ), поэтому, согласно закону Гесса, ΔH=ΔH1+ΔH2. В химических справочниках невозможно привести тепловые эффекты всех реакций. Но из закона Гесса можно получить важные следствия, позволяющие вычислить ΔH почти всех процессов. Теплотой образования вещества называется тепловой эффект реакции получения 1 моля этого вещества из простых веществ (обозначается Теплотой сгорания вещества называется тепловой эффект сгорания 1 моля этого вещества ( Следствие Тепловой эффект химической реакции равен разности между суммами теплот (энтальпий) образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в уравнении. Тепловой эффект реакции: bB + dD =lL + mM рассчитывается по уравнению ΔН1 = lΔfHL + mΔfHM – dΔfHD - bΔfHB Для термохимических расчетов используют стандартные энтальпии образования веществ ΔfH0 – это изменение энтальпии в процессе образования 1 моля соединения в стандартном состоянии из простых веществ, тоже находящихся в стандартном состоянии в устойчивых формах и модификациях. Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях, условно принимаются равными нулю. Следствие Важно для реакций, протекающих с участием органических веществ. Тепловой эффект реакции равен разности между суммами теплот (энтальпий) сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции. Теплота (энтальпия) сгорания – это тепловой эффект сгорания 1 моль органического вещества до СО2 и Н2О. Остальные продукты определяются конкретно для каждого случая. Энтропия Sявляется мерой свободы. С увеличением свободы неизбежно растет беспорядок, поэтому энтропию также называют мерой беспорядка. Энтропии можно придать ещё несколько физических смыслов: мера обесценивания системы, мера выравнивания, какого–либо свойства, уменьшение работоспособности системы. Все толкования энтропии являются аддитивными и одно можно вывести из другого. При выравнивании свойств неизбежно растёт свобода, потому что разность свойств, всегда поддерживается каким–то усилием со стороны окружающей среды, а это уменьшение свободы системы. Обесценивание системы всегда связано с выравниванием концентраций. Химически чистые вещества ценятся дороже, а обесценивание, смешение, выравнивание концентраций идёт самопроизвольно. Движущей силой процесса является разность, каких–либо свойств системы (давления, температуры, концентрации, электрических потенциалов и др.) Необратимость всех процессов связана с уменьшением движущей силы, т.е. уменьшением разности каких–либо свойств, а это есть выравнивание. Критерий самопроизвольности процесса устанавливается вторым законом термодинамики. Энтропия изолированной системы в самопроизвольном процессе возрастает: ΔS>0. Постулат Планка позволяет с помощью экспериментальных данных по теплоёмкостям и теплотам фазовых переходов различных модификаций вещества рассчитать абсолютное значение его энтропии при любой температуре. Например, увеличение энтропии вещества ΔS, вызванное теплотой Q при температуре Т, определяется по формуле ΔS = Q/Т. Единицей измерения энтропии является Дж/(моль К). Sо 298 – значение абсолютной энтропии при стандартных условиях (стандартная энтропия), приводится в справочниках. По мере повышения температуры растёт интенсивность теплового движения, т.е. число микросостояний, и соответственно термодинамическая вероятность и энтропия вещества. Энтропия растёт не только при нагревании, но и при эндотермических фазовых переходах: плавление, испарение и др. Энтропия резко возрастает при переходе вещества из жидкого состояния в газообразное. Изменение энтропии в химической реакции определяется разностью сумм энтропий продуктов и энтропий исходных веществ. Например, для реакции общего типа а А + b В + ... → с С + d D + … изменение энтропии, определяется выражением ΔSо=[c Sо(C) + d Sо(D) + …] – [a Sо(A) + b Sо(B) + …], где S – абсолютные значения энтропии всех веществ, Дж/(моль К) или кал /(моль К): ΔSо = ΣSопрод. – ΣSоисх.
ЭНЕРГИЯ ГИББСА Самостоятельно, т.е. без затрат работы извне, система может переходить только из менее устойчивого состояния в более устойчивое. В химических процессах одновременно действуют две тенденции: стремление частиц объединиться за счёт прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединиться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов – энтальпийного (ΔН) и энтропийного (TΔS). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса G или изобарно–изотермического потенциала. Согласно ΔН = ΔG + TΔS теплота TΔS идет на создание беспорядка (бесполезно рассеивается в окружающую среду) и потому не может быть использована для совершения работы; её часто называют связанной энергией. Теплота ΔG* может быть использована для совершения работы, и поэтому энергию Гиббса часто называют также свободной энергией:ΔG = ΔН – TΔS Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности процесса является неравенство ΔG<0.Иными словами, самопроизвольно протекают реакции, если энергияГиббса в исходном состоянии системы больше, чем в конечном. Увеличениеэнергии ГиббсаΔG>0 свидетельствует о невозможности самопроизвольного осуществленияпроцесса в данных условиях. Если же ΔG=0, система находится в состоянии химического равновесия.
Поиск по сайту: |
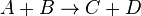 выражение для скорости выглядит:
выражение для скорости выглядит:  .
.

 (при 1 атм и 25°С).
(при 1 атм и 25°С).
 , кДж/моль).
, кДж/моль). , кДж/моль).
, кДж/моль).