 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Реакции горения и их тепловой эффект. Тепловой механизм.
Горение – сложный физико-химический процесс, основу которого составляют химические реакции окислительно-восстановительного типа, приводящие к перераспределению валентных электронов между атомами взаимодействующих молекул. Примеры реакций горения метана: СН4 + 2О2 = СО2 + 2Н2О; ацетилена: С2Н2 + 2,5О2 = 2СО2 + Н2О; натрия: 2Na + Cl2 = 2NaCl; водорода: Н2 + Cl2 = 2НCl, 2Н2 + О2 = 2Н2О; тротила: С6Н2(NO2)3CH3 = 2,5H2O + 3,5CO + 3,5C +1,5N2. Сущность окисления – отдача окисляющимся веществом валентных электронов окислителю, который, принимая электроны, восстанавливается. Сущность восстановления – присоединение восстанавливающимся веществом электронов восстановителя, который, отдавая электроны, окисляется. В результате передачи электронов изменяется структура внешнего (валентного) электронного уровня атома. Каждый атом при этом переходит в наиболее устойчивое в данных условиях состояние. В химических процессах электроны могут полностью переходить из электронной оболочки атомов одного вещества (элемента) в оболочку атомов другого. Так, при горении металлического натрия в хлоре атомы натрия отдают по одному электрону атомам хлора. При этом на внешнем электронном уровне атома натрия оказывается восемь электронов (устойчивая структура), а атом, лишившийся одного электрона, превращается в положительно заряженный ион. У атома хлора, получившего один электрон, внешний уровень заполняется восемью электронами, и атом превращается в отрицательно заряженный ион. В результате действия кулоновских электростатических сил происходит сближение разноименно заряженных ионов и образуется молекула хлорида натрия (ионная связь): Na+ + Cl– = Na+Cl– или 2Na + Cl2 = 2Na+Cl–. Атом магния имеет в наружном слое два электрона. При взаимодействии с кислородом два атома магния отдают четыре электрона молекуле (двум атомам) кислорода и превращаются в положительные двухзарядные ионы. Последние связываются с образовавшимися отрицательно заряженными ионами кислорода в кристаллы оксида магния MgO. 42. Расчет давления при взрыве газов Избыточное давление взрыва Р для индивидуальных горючих ве-ществ, состоящих из атомов С, Н, О, N, С1, Вr, I, F, определяется по формуле
где Рmax — максимальное давление взрыва стехиометрической газовоздушной или паровоздушной смеси в замкнутом объеме, оп-ределяемое экспериментально или по справочным данным в соот-ветствии с требованиями п. 3. При отсутствии данных допускается принимать Рmax равным 900 кПа; РO — начальное давление, кПа (допускается принимать равным 101 кПа); т — масса горючего газа (ГГ) или паров легковоспламеняющихся (ЛВЖ) и горючих жидкостей (ГЖ), вышедших в результате рас-четной аварии в помещение, вычисляемая для ГГ по формуле (6), а для паров ЛВЖ и ГЖ по формуле (11), кг; Z — коэффициент участия горючего во взрыве, который может быть рассчитан на основе характера распределения газов и паров в объ-еме помещения согласно приложению. Допускается принимать значение Z по табл. 2; Vсв — свободный объем помещения, м3; pг,п— плотность газа или пара при расчетной температуре tр, кг*м-3, вычисляемая по формуле
где М— молярная масса, кг*кмоль-1; VО — мольный объем, равный 22,413 м3*кмоль-1; tр — расчетная температура, oС. В качестве расчетной температуры следует принимать максимально возможную температуру воздуха в данном помещении в соответствующей климатической зоне или максимально возможную температуру воздуха по технологическому регламенту с учетом возможного повышения температуры в аварийной ситуации. Если такого значения расчетной температуры tрпо каким-либо причинам определить не удается, допускается принимать ее равной 61oС; Сст — стехиометрическая концентрация ГГ или паров ЛВЖ и ГЖ, % (об.), вычисляемая по формуле
где — стехиометрический коэффициент кислорода в реакции сгорания; nС, nН, nО, nХ ѕ число атомов С, Н, О и галоидов в молекуле горючего; КН— коэффициент, учитывающий негерметич-ность помещения и неадиабатичность процесса горения. Допускается принимать КН равным 3. Таблица 2
Расчет Р для индивидуальных веществ, кроме упомянутых в п. 10, а также для смесей может быть выполнен по формуле
где НТ — теплота сгорания, Дж*кг-1; pв — плотность воздуха до взрыва при начальной температу-ре ТО, кг*м-3; Ср — теплоемкость воздуха, Дж*кг-1*К-1 (допускается принимать равной 1,01*103 Дж*кг-1*К-1); ТО — начальная температура воздуха, К. 12. В случае обращения в помещении горючих газов, легковоспламеняющихся или горючих жидкостей при определении значения массы т, входящей в формулы (1) и (4), допускается учитывать работу аварийной вентиляции, если она обеспечена резервными вентиляторами, автоматическим пуском при превышении предельно допустимой взрывобезопасной концентрации и электроснабжением по первой категории надежности (ПУЭ), при условии расположения устройств для удаления воздуха из помещения в непосредственной близости от места возможной аварии. При этом массу горючих газов или паров легковоспламеняющихся или горючих жидкостей, нагретых до температуры вспышки и выше, поступивших в объем помещения, следует разделить на коэффициент К, определяемый по формуле К = АТ + 1, (5)
где А — кратность воздухообмена, создаваемого аварийной вентиляцией, с-1; Т — продолжительность поступления горючих газов и паров легковопламеняющихся и горючих жидкостей в объем помещения, с (принимается по п. 7). 13. Масса m, кг, поступившего в помещение при расчетной аварии газа, определяется по формуле m = (Va + VT) pr, (6)
где Va — объем газа, вышедшего из аппарата, м3; VT — объем газа, вышедшего из трубопроводов, м3. При этом Va = 0,01Р1 V, (7)
где P1 — давление в аппарате, кПа; V — объем аппарата, м3; VT = V1T + V2T, (8)
где V1T — объем газа, вышедшего из трубопровода до его отключения, м3; V2T — объем газа, вышедшего из трубопровода после его отключения, м3; V1T = qT, (9)
q — расход газа, определяемый в соответствии с технологическим регламентом в зависимости от давления в трубопроводе, его диаметра, температуры газовой среды и т.д., м3*с-1; Т — время, определяемое по п. 7, с; V2T = 0,01 Р2 (r21 L1 + r22L2 + ... + r2n Ln), (10)
P2 — максимальное давление в трубопроводе по технологическому регламенту, кПа, r — внутренний радиус трубопроводов, м; L — длина трубопроводов от аварийного аппарата до задвижек, м. 14. Масса паров жидкости m, поступивших в помещение при наличии нескольких источников испарения (поверхность разлитой жидкости, поверхность со свеженанесенным составом, открытые емкости и т.п.), определяется из выражения m = mр + mемк + mсв.окр., (11)
где mр — масса жидкости, испарившейся с поверхности разлива, кг; mемк — масса жидкости, испарившейся с поверхностей открытых емкостей, кг; mсв.окр — масса жидкости, испарившейся с поверхностей, на которые нанесен применяемый состав, кг. При этом каждое из слагаемых в формуле (11) определяется по формуле m = W Fи T, (12)
где W — интенсивность испарения, кг*с-1*м-2; Fи — площадь испарения, м2, определяемая в соответствии с п. 7 в зависимости от массы жидкости mп, вышедшей в помещение. Если аварийная ситуация связана с возможным поступлением жидкости в распыленном состоянии, то она должна быть учтена в формуле (11) введением дополнительного слагаемого, учитывающего общую массу поступившей жидкости от распыляющих устройств, исходя из продолжительности их работ. 15. Масса mр, кг, вышедшей в помещение жидкости определяется в соответствии с п. 7. 16. Интенсивность испарения W определяется по справочным и экспериментальным данным. Для ненагретых выше температуры окружающей среды ЛВЖ при отсутствии данных допускается рассчитывать W no формуле
где — коэффициент, принимаемый по табл. 3 в зависимости от скорости и температуры воздушного потока над поверхностью испарения; Рн — давление насыщенного пара при расчетной температуре жидкости tр, определяемое по справочным данным в соответствии с требованиями п. 3, кПа. Таблица 3
Поиск по сайту: |
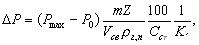 (1)
(1)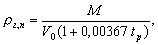 (2)
(2)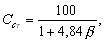 (3)
(3)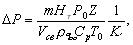 (4)
(4)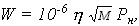 (13)
(13)