|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Внутренняя энергия системы. Энтальпия
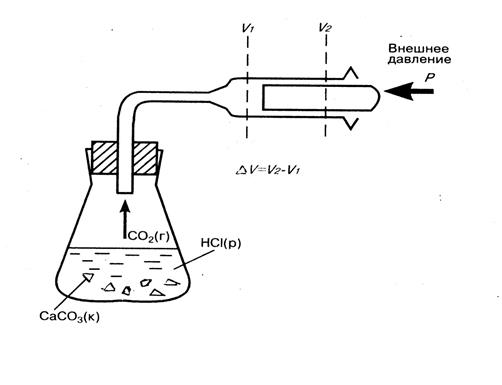
Один из самых общих законов природы – закон сохранения энергии говорит, что энергия не возникает из ничего и не исчезает, она может лишь превращаться из одного вида в другой. Поэтому в изолированной системе запас энергии постоянен, независимо от протекающих в ней процессов. Каждая система (тело, вещество, совокупность тел или веществ) обладает определенным запасом внутренней энергии U. Внутренняя энергия системы складывается из кинетической и потенциальной энергии частиц. Кинетическая энергия – это энергия поступательного, колебательного и вращательного движения частиц. Потенциальная энергия обусловлена силами притяжения и отталкивания между частицами. Во внутреннюю энергию системы не входят кинетическая энергия всей системы в целом и потенциальная энергия положения системы. Внутреннюю энергию системы нельзя измерить. Она представляет собой способность системы к совершению работы или передаче теплоты. Можно определить ее изменение при переходе из начального состояния 1 в конечное состояние 2, т.е. ΔU = U2 – U1, где U2 и U1 – внутренняя энергия системы в конечном и начальном состояниях. Так как химический процесс представляет собой превращение одних веществ в другие, запас внутренней энергии системы в ходе химического процесса должен меняться. Если система получит из внешней среды теплоту Q и перейдет при этом из состояния 1 в состояние 2, то теплота будет расходоваться на изменение внутренней энергии ΔU и совершение системой работы против внешних сил А: - математическое выражение первого закона термодинамики (частный случай закона сохранения энергии): Q = ΔU + А Для химических реакций работой против внешних сил является работа против внешнего давления. Обычно она совершается за счет расширения системы, например, при выделении газа в ходе реакции (рис. 2). Большинство химических реакций протекает при постоянном давлении (изобарный процесс) в открытом сосуде, поэтому реагирующие вещества могут расширяться. Поскольку увеличению объема системы препятствует внешнее давление Р, система должна совершать работу против внешнего давления: А = p ΔV, где ΔV = V2 - V1, т.е. А = p(V2 - V1) Тогда количество теплоты, полученное системой, Qp = ΔU + pΔV; Qp = (U1 - U2) + p(V2 - V1) = (U2 + pV2) – (U1 + pV1) Введем обозначение U + pV = Н, тогда Qp= Н2 - Н1 = ΔН Величину H = U + pV называют энтальпией. Энтальпия системы – это теплосодержание или энергосодержание системы, численно она равна сумме внутренней энергии и произведения давления на объем. Таким образом, для изобарного процесса выделение или поглощение теплоты равно изменению энтальпии системы: Qp = Δ H. При изохорномпроцессе (V = const, Δ V = 0) изменения объема системы не происходит. Таким образом, для изохорных процессов теплота, сообщенная системе, расходуется только на изменение внутренней энергии системы: Qv = U2 – U1= ΔН и, следовательно, изменение энтальпии и изменение внутренней энергии равны ΔН = ΔU.
Рис. 2. Работа системы против внешнего давления
При изотермическом процессе температура системы остается постоянной, значит, изменения внутренней энергии не происходит ΔU = 0. При изотермическом процессе поглощенная теплота расходуется только на совершаемую системой механическую работу: Qt = A = p ΔV. При адиабатномпроцессе теплообмена системы с окружающей средой не происходит, ΔQ = 0; тогда механическая работа будет совершаться только за счет убыли внутренней энергии системы: А = – ΔU.
Поиск по сайту: |