 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Глава 6.2. Потребность живых организмов в углеводах, липидах, белках и нуклеиновых кислотах
Для обеспечения нормальной жизнедеятельности организма необходимо постоянное поступление извне углеводов, липидов, белков, нуклеиновых кислот и веществ, называемых незаменимыми факторами питания. Пища снабжает организм энергией для протекания метаболических реакций и строительным материалом для его воспроизводства. Перечень незаменимых факторов питания существенно различается у отдельных биологических видов и находится в полном соответствии с особенностями обменных процессов для каждого из них. Часть веществ регулярно поступает с пищей и используется в качестве готовых строительных элементов при различных биосинтетических процессах. Ферментные системы, необходимые для биосинтеза этих веществ, постепенно утрачиваются, что превращает эти вещества в незаменимые (эссенциальные) факторы питания. Для человека такими факторами питания являются незаменимые аминокислоты, эссенциальные жирные кислоты, минеральные вещества и микроэлементы, витамины. 6.2.1. Незаменимые и условно заменимые аминокислоты. Потребность организма в азоте и аминокислотах удовлетворяется за счет потребления пищевого белка, который подвергается в органах пищеварения гидролизу до отдельных аминокислот, поступающих в кровоток. Для синтеза белков организму необходим весь набор аминокислот.
Рис. 6.37. Синтез аргинина в цикле мочевины: 1 – орнитин; 2 – карбамоилфосфат; 3 – цитруллин; 4 – аргининосукцинат; 5 – фумарат; 6 – аргинин; 7 – мочевина; CPS-1 – карбамоилфосфатсинтетаза 1; OTC – орнитин-транскарбамилаза; ASS − аргининосукцинатсинтетаза; ASL − аргининосукцинатлиаза; ARG1 – аргиназа 1 (согласно [17]) У человека синтез восьми аминокислот отсутствует. Эти аминокислоты, поступаемые с пищей, получили наименование незаменимые: валин, лейцин, изолейцин, метионин, фенилаланин, лизин, треонин, триптофан. Цистеин и тирозин образуются из незаменимых аминокислот метионина и фенилаланина, поэтому их называют условно заменимыми аминокислотами. Если метионина и фенилаланина недостаточно в пище, то и цистеин с тирозином становятся незаменимыми аминокислотами. Две другие условно заменимые аминокислоты − аргинин и гистидин − являются незаменимыми для детей младшего возраста, у которых еще недостаточно развиты ферментные системы, осуществляющие синтез этих аминокислот. Синтез аргинина происходит у человека в печени в цикле мочевины. Как видно из рис. 6.37, часть реакций цикла протекает в митохондриях, часть − в цитоплазме. Для бесперебойного функционирования цикла мочевины необходимо наличие орнитина и аспартата, запасы которых пополняются в результате анаплеротических реакций: орнитин синтезируется из глутаминовой кислоты, а аспартат – путем превращения фумарата в цикле трикарбоновых кислот и переаминирования образовавшегося оксалоацетата. Цистеин в организме образуется из метионина (первичный источник атома серы) и серина (источник углеродного скелета). Сначала метионин превращается в гомоцистеин с образованием на промежуточных стадиях S-аденозилметионина, S-аденозилгомоцистеина. Гомоцистеин, взаимодействуя с серином, дает цистатионин, расщепляющийся далее на цистеин и α-кетобутират (схема (64)).
Цистатионин-β-синтаза и цистатион-γ-лиаза, ферменты, катализирующие синтез и распад цистатионина, содержат в качестве кофермента пиридоксальфосфат (PLP).
Рис. 6.38. Синтез гистидина. Атомы гистидина, происходящие из 5-фосфорибозил-1-пирофосфата (ФРПФ) и АТР, изображены красным и голубым цветом, атомы азота Gln или Glu – оранжевым. Ферменты, участвующие в синтезе His: 1 – АТР-фосфорибозилтрансфераза; 2 – пирофосфогидролаза; 3 – фосфорибозил-АМР циклогидролаза; 4 – фосфорибозилформимино-5-аминоимидазол-4-карбоксамидрибонуклеотидизомераза; 5 – глутаминамидотрансфераза; 6 – имидазолглицерол-3-фосфатдегидратаза; 7 – гистидинолфосфатаминотрансфераза; 8 – гистидинолфосфатфосфатаза; 9 – гистидинолдегидрогеназа; КГ – α-кетоглутарат
Цистеин используется для синтеза белков, в образовании третичной структуры которых играет главную роль, в синтезе трипептида-антиоксиданта глутатиона, таурина (2-аминоэтилсульфоната), важной составной части желчных кислот, кофермента А и т. д. Биосинтез гистидина, второй условно заменимой аминокислоты, начинается с 5-фосфорибозил-1-пирофосфата (ФРПФ) с использованием фрагмента аденинового кольца АТР и атома азота глутамина (рис. 6.38). Гистидин, содержащий пять углеродных атомов, катаболизируется до α-кетоглутарата. Промежуточными соединениями этого превращения являются урокановая кислота, 4-имидазолон-5-пропионат, N-формиминоглутамат и глутаминовая кислота (рис. 6.39).
Рис. 6.39. Распад гистидина. Ферменты, катализирующие отдельные стадии этого превращения: 1 – гистидинаммиаклиаза (гистидиназа); 2 – уроканатгидратаза; 3 – имидазолонпропионаза; 4 – глутаматформиминотрансфераза При декарбоксилировании гистидина в тучных клетках соединительной ткани образуется гистамин, играющий роль нейромедиатора. Это соединение также участвует в развитии иммунных, аллергических и воспалительных реакций, вызывая покраснение кожи и отечность тканей. Гистамин появляется в кровотоке при повреждениях тканей в результате ожога, удара, выполняет функцию пищеварительного гормона, стимулируя секрецию желудочного сока (см. ч. 5 п. 5.1.1), повышает проницаемость капилляров, сокращает гладкую мускулатуру легких, вызывая удушье. Это соединение ответственно за болевой синдром. Тирозин образуется в результате реакции гидроксилирования фенилаланина, катализируемой монооксигеназой – фенилаланингидроксилазой (рис. 6.40). Коферментом в этой реакции служит 5,6,7,8-тетрагидробиоптерин, атом уходит в молекулу воды, второй внедряется в виде гидроксильной группы в n-положение фенилаланина. Окисленная форма 7,8-дигидробиоптерин восстанавливается с помощью NADH и дигидробиоптеринредуктазы. В случае пониженной активности фермента фенилаланингидроксилазы происходит переаминирование фенилаланина с образованиием фенилпирувата и продуктов его дальнейшего превращения: фениллактата, фенилацетата, фенилацетилглутамина. Все названные соединения, токсичные для мозговых клеток, выделяются с мочой. Это заболевание называется фенилкетонурией. Чаще всего это наследственное заболевание, обусловленное мутациями в гене фенилаланингидроксилазы, приводящее к снижению активности фермента или полной его инактивации. Большие концентрации фенилаланина препятствуют синтезу из тирозина нейромедиаторов − дофамина, норадреналина. Распад тирозина до фумарата и ацетоацетата происходит в печени. Сначала тирозин вступает в реакцию трансаминирования с α-кетоглутаратом с образованием n-гидроксифенилпирувата и глутаминовой кислоты. Реакцию катализирует пиридоксаль-зависимый фермент тирозинаминотрансфераза. При окислении n-гидроксифе-нилпирувата с помощью n-гидроксифенилпируватдиоксигеназы имеет место декарбоксилирование, гидроксилирование ароматического ядра и миграция боковой цепи, что приводит к образованию гомогентизиновой кислоты. Кофакторами в этой реакции являются витамин С и ион Fe2+. Под действием диоксигеназы гомогентизиновой кислоты, содержащей ион Fe2+, происходит расщепление ароматического кольца с образованием малеилацетоацетата, изомеризующегося в фумарилацетоацетат, гидролиз которого с помощью фумарилацетоацетатгидролазы приводит к высвобождению фумарата и ацетоацетата (схема (65)). Оба конечных продукта могут окисляться в ЦТК до СО2 и Н2О. Рис. 6.40
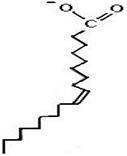
В щитовидной железе из тирозина синтезируются гормоны: тироксин и трийодтиронин (см. п. 6.1.9.4). В меланоцитах тирозин превращается в пигменты меланины. Это сложный многоступенчатый процесс, начинающийся с превращения тирозина в диоксифенилаланин (ДОФА) под действием тирозиназы, использующей в качестве кофактора ионы Cu+. Аналогичная реакция протекает в надпочечниках и нервной ткани при синтезе катехоламинов. Фермент, катализирующий эту реакцию в надпочечниках и в нервной ткани, отличается от тирозиназы, является зависимым от ионов Fe2+. Аналогично фенилаланингидроксилазе для протекания этой реакции в качестве кофактора необходим тетрагидробиоптерин (синтез катехоламинов будет подробно рассмотрен в ч. 7). 6.2.2. Полиеновые жирные кислоты.В организме важную роль играют липиды, основная масса которых представлена триацилглицеролами, являющимися в сущности формой депонирования энергии. В состав липидов входят насыщенные и ненасыщенные жирные кислоты. В организме человека это в основном жирные кислоты с четным числом атомов углерода, а по конфигурации двойных связей в ненасыщенных жирных кислотах это цис-изомеры (т. е. ацильные фрагменты находятся по одну сторону двойной связи), что делает алифатическую цепь жирной кислоты изогнутой и приводит к снижению температуры плавления (рис. 6.41). Жирные кислоты с транс-конфигурацией двойной связи, обнаруживаемые, например, в маргаринах, могут поступать в организм человека с пищей. У них отсутствует излом, они имеют более высокую температуру плавления и более твердые по консистенции. Большинство жирных кислот синтезируется в организме, но есть и незаменимые (эссенциальные) жирные кислоты, синтез которых в организме отсутствует. Это линолевая и α-линоленовая кислоты. Они должны поступать с пищей. Длинные жирные кислоты синтезируются в эндоплазматическом ретикулуме в основном из стеариновой кислоты путем удлинения ее с помощью малонилСоА. Процесс протекает аналогично синтезу пальмитиновой кислоты: перенос двууглеродного фрагмента от малонилСоА на стеарилСоА, восстановление кетогруппы до гидроксильного остатка с помощью NADPH, дегидратация и восстановление двойной связи с образованием насыщенной жирной кислоты,
Рис. 6.41. Пространственная структура мононенасыщенной олеиновой кислоты с цис-конфигурацией двойной связи между атомами углерода 9 и 10 удлиненной на двууглеродный фрагмент. Отличие лишь в том, что остаток стеарила связан не с ацил-переносящим белком синтазы жирных кислот, а с СоА.
Процесс введения двойных связей в жирные кислоты называется десатурацией. Этот процесс происходит в эндоплазматическом ретикулуме в присутствии молекулярного кислорода, NADH, цитохрома b5 и FAD-зависимой цитохром b5-редуктазы. Атомы водорода, отщепляемые от жирной кислоты, восстанавливают один из атомов молекулярного кислорода с образованием молекулы воды (схема (66)). Электроны для восстановления второго атома, а также выделения в виде воды поставляет цитохром b5, ион Fe2+ которого окисляется до Fe3+. Восстановление окисленной формы цитохрома b5 происходит под действием NADH и FAD-зависимой цитохром b5- редуктазы. В основном у человека образуются пальмитоолеиновая (С16:1Δ9) и олеиновая (С18:1Δ9) кислоты. Десатуразы жирных кислот человека не способны создавать двойные связи в жирных кислотах далее девятого атома углерода от карбоксильного конца, поэтому полиненасыщенные жирные кислоты семейств ω-3 (двойная связь за три углеродных атома от концевой метильной группы) и ω-6 (двойная связь располагается за шесть углеродных атомов от концевой метильной группы) не синтезируются в организме человека и должны присутствовать в пище. Представителями семейства кислот ω-3 являются α-линоленовая (С18:3Δ9,12,15), эйкозапентаеновая жирные кислоты (С20:5Δ5,8,11,14,17), а семейства кислот ω-6 – линолевая (С18:2Δ9,12), эйкозатриеновая (С20:3Δ8,11,14) жирные кислоты. На схеме (67) приведена последовательность реакций элонгации
и десатурации, в результате которой происходит синтез длинноцепочечных насыщенных и полиненасыщенных жирных кислот. Линолевая и α-линоленовая кислоты образуются только в растениях, ферментные системы которых способны к вводу двойных связей вблизи концевой (ω) метильной группы. Полиненасыщенные жирные кислоты входят в состав фосфолипидов клеточных мембран и мембран органелл, делая их текучими и подвижными. Эти соединения являются предшественниками эйкозаноидов, регуляторов клеточных функций. 6.2.2.1. Эйкозаноиды. К этому классу соединений, синтезируемых из длинных полиеновых жирных кислот (более двадцати углеродных атомов, от греч. эйкоза − «двадцать») относятся простагландины, тромбоксаны и лейкотриены. Эти вещества с коротким временем жизни оказывают на продуцирующую их клетку действие по аутокринному механизму, аналогичное гормональному, на соседние клетки – по паракринному механизму. Поэтому их называют также местными гормонами, действующими на уровне клетки. При повреждениях тканей и инфекциях эйкозаноиды вызывают развитие воспалительного процесса (они ответственны за такие признаки воспаления, как отек, боль, лихорадка), регулируют секрецию воды и ионов натрия в почках, участвуют в образовании тромбов,влияют на тонус бронхов, кишечника и матки. При избыточной секреции эйкозаноидов развиваются аллергические реакции, в том числе бронхиальная астма.
Предшественником эйкозаноидов является в основном ω-6-кислота – арахидоновая кислота (С20:4Δ5,8,11,14), которая в организме человека синтезируется, согласно схеме (67), из эссенциальной линолевой кислоты.
Арахидоновая кислота входит в состав глицерофосфолипидов мембран, при востребованности эйкозаноидов она высвобождается из фосфолипида гидролизом с помощью мембрансвязанной фосфолипазы А2 (схема (68)). Простагландины Наиболее распространенными в организме человека эйкозаноидами являются простагландины. Их обозначают PG. Существует несколько групп простагландинов в зависимости от заместителя в пятичленном кольце, например PGА, PGЕ2. Цифра внизу обозначает количество двойных связей в боковых цепях простогландина. Две двойные связи предшественника – полиеновой кислоты используются для образования кольца в молекуле простагландина.
Простациклины (PGI2, PGI3) в своей структуре имеют два кольца: одно пятичленное, как у всех простагландинов, другое – с участием кислородного атома. Цифра внизу также обозначает число двойных связей в молекуле простациклина.
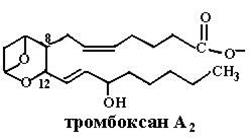
Тромбоксаны, синтезируемые только тромбоцитами и стимулирующие их агрегацию при образовании тромба, имеют шестичленное кольцо, содержащее атом кислорода, и разное количество двойных связей в боковых цепях: ТХА2, ТХА3 (отличаются друг от друга активностью), ТХВ2 (неактивный продукт превращения ТХА2).
После активации фосфолипазы А2 под действием гормонов, цитокинов, гистамина, механического воздействия и высвобождения арахидоновой кислоты из глицерофосфолипида возможны два пути ее превращения: циклооксигеназный, ведущий к образованию простагландинов, простациклинов, тромбоксанов (схема (69)), и липоксигеназный, в результате которого синтезируются лейкотриены. Превращение арахидоновой кислоты в PGH2 происходит в шероховатом эндоплазматическом ретикулуме и катализируется циклооксигеназой (СОХ), называемой также простагландин Н2-синтазой и обладающей двумя видами активностей: циклооксигеназной и перокидазной. PGH2 является предшественником тромбоксанов и других простагландинов. Сначала под действием циклооксигеназной активности СОХ и молекулярного кислорода арахидоновая кислота превращается в нестабильное гидропероксидное производное PGG2,
содержащее четыре атома кислорода. Гидропероксид при пятнадцатом углеродном атоме быстро восстанавливается гемом, локализованным в пероксидазном центре СОХ, до гидроксильной группы, образуя PGH2. Дальнейшие превращения PGH2 зависят от функциональной специфичности клетки. Известное противовоспалительное лекарство – аспирин (ацетилсалициловая кислота) ацетилирует остаток Ser530 в циклооксигеназном центре СОХ, тем самым блокируя синтез простагландинов и тромбоксанов (схема (70)) и уменьшая вызываемую простагландинами воспалительную реакцию. Ибупрофен (нестероидное противовоспалительное средство) действует как конкурентный ингибитор циклооксигеназной активности СОХ. В организме человека обнаружено две формы СОХ, имеющие близкие первичные и пространственные структуры. СОХ 1 – конститутивный фермент, используемый для синтеза простагландинов, активирующих секрецию желудочных слизей. СОХ 2, индуцируемая цитокинами изоформа, ответственна за воспалительный процесс, боль и т. д. Обе формы представляют собой гомодимеры, гидрофобные домены которых связаны с липидными мембранами эндоплазматического ретикулума (ЭР), а активные центры обращены в
полость ЭР. На схеме (71) изображен механизм циклооксигеназной активности СОХ. Под действием тирозильного радикала в циклооксигеназном активном центре происходит отрыв протона от тринадцатого углеродного атома арахидоновой кислоты. К образовавшемуся арахидоновому радикалу (одиннадцатому углеродному атому) присоединяется первая молекула кислорода, присоединение заканчивается образованием пероксидного мостика между 9 и 11 углеродными атомами. Присоединение второй молекулы кислорода может происходить по 15-му положению (путь 1 на схеме (71)), или по 13-му положению (путь 2). В гладкомышечных клетках из PGH2 образуется с помощью PGЕ-синтазы простагландин PGЕ2, а с помощью PGD-синтазы − простагландин PGD2. В тромбоцитах тромбоксансинтаза превращает PGH2 в ТХА2, действующий как сосудосуживающее средство, а простациклин PGI2, синтезированный из PGH2 с помощью простациклинсинтазы, наоборот, обладает сосудорасширяющим дейст-вием. Лейкотриены В структуре лейкотриенов, образующихся также из полиеновых кислот, отсутствуют циклы, но есть три сопряженные двойные связи (отсюда и название лейкотриен), хотя общее количество двойных связей может быть больше. Лейкотриены C4, D4 и E4 имеют заместители в виде глутатиона, глицилцистеина и цистеина.
Синтез лейкотриенов начинается с присоединения кислорода по двойной связи у пятого, двенадцатого или пятнадцатого углеродного атома под действием липооксигеназы с образованием гидропероксидэйкозатетраеноатов (ГПЭТЕ) (схема (72)). Последние или восстанавливаются до 5- (12- или 15)-гидроксиэйкозатетраеноатов (5-ГЭТЕ, 12-ГЭТЕ, 15-ГЭТЕ), или превращаются в лейкотриены. В зависимости от типа ткани липооксигеназа действует в пятом (в лейкоцитах), двенадцатом (в тромбоцитах) или пятнадцатом (в эозинофилах) положениях арахидоновой кислоты. В лейкоцитах 5-ГПЭТЕ превращается в эпоксид-лейкотриен А4 (LTA4). Его гидролиз в лейкоцитах под действием эпоксидгидролазы дает LTВ4. Присоединение по шестому положению LTA4 остатка глутатиона (глутамилцистеинилглицина) с помощью глутатион-S-трансферазы приводит к образованию LTС4, удаление остатка глутаминовой кислоты из LTС4 дает LTD4, отщепление глицина необходимо для образования LTЕ4, который содержит только остаток цистеина.
Лейкотриены стимулируют расширение сосудов, увеличивают их проницаемость, вызывают сокращение бронхов. В лейкоцитах под их воздействием увеличивается образование супероксидного аниона. Действие эйкозаноидов на клетки происходит через связывание со специфическими рецепторами, взаимодействующими с аденилатциклазой или протеинкиназой А (это рецепторы к PGЕ, PGD, PGI, ТХА2). Часто эйкозаноиды влияют на активацию аденилатциклазы, вызванную действием других гормонов, путем изменения конформации G-белков в мембранах клеток. При связывании со стимулирующим G-белком стимулирующий эффект основного агента усиливается, связывание с ингибирующим G-белком приводит к снижению эффекта. Эйкозаноиды действуют на все клетки организма. Время полужизни эйкозаноидов колеблется от нескольких секунд до нескольких минут. Простагландины инактивируются путем окисления существенной гидроксильной группы в положении 15 до
схема 72
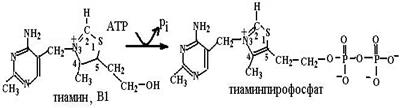
кетогруппы, восстановления двойной связи в положении 13, β-окисления боковой цепи и ω-окисления до конечных продуктов распада – дикарбоновых кислот. В ТХА2 происходит разрыв кислородного мостика между углеродными атомами в положениях 9 и 11, образование гидроксильных групп, что превращает активный ТХА2 в неактивный ТХВ2. Так как эйкозаноиды – медиаторы воспалительных реакций в организме, в мире широко развиваются исследования по поиску и созданию лекарств, блокирующих действие эйкозаноидов, использованию аналогов эйкозаноидов для лечения различных заболеваний (например, аналоги PGЕ1 и PGЕ2, известные как Н2-блокаторы, подавляют секрецию соляной кислоты в желудке, блокируя гистаминовые рецепторы в клетках слизистой оболочки желудка, и способствуют заживлению язв желудка и двенадцатиперстной кишки). Глава 6.3. Витамины Незаменимыми пищевыми факторами для человека являются также витамины, низкомолекулярные органические соединения различной химической природы и строения, синтезируемые в основном растениями и микроорганизмами. Существующая система классификации основывается на растворимости в различных растворителях − выделяются водорастворимые и жирорастворимые витамины. Нам больше импонирует классификация, основанная на разделении этих соединений по функциональной роли в определенных процессах. Согласно этой классификации витамины делятся на три группы: 1) предшественники коферментов (никотиновая кислота и никотинамид, рибофлавин, аскорбиновая кислота, тиамин, семейство витамина В6, биотин, пантотеновая кислота, липоевая кислота, фолиевая кислота, кобаламин, S-аденозилметионин, витамин К, ретиналь); 2) антиоксиданты (аскорбиновая кислота, токоферолы и токотриенолы, каротиноиды и витамины группы А, биофлавоноиды); 3) гормоны (витамины группы D, ретиноевая кислота). Некоторые соединения оказываются в нескольких группах в зависимости от процессов, в которых они принимают участие. 6.3.1. Витамины – предшественники коферментов.Эта группа витаминов самая многочисленная. Соединения, относящиеся к ней, попадая в организм с пищей и превращаясь в активные формы в результате восстановительных и трансферазных реакций, функционируют далее как коферменты с ферментными системами всех классов, кроме гидролаз: это окислительно-восстановительные реакции (никотиновая кислота и никотинамид, рибофлавин, аскорбиновая кислота, липоевая кислота, тиамин), трансферазные реакции (семейство витамина В6, пантотеновая кислота, фолиевая кислота, S-аденозилметионин), лиазное расщепление (тиамин, пиридоксаль), реакции изомеризации (ретиналь, кобаламин, пиридоксаль), лигазные реакции (биотин). 6.3.1.1. Превращение в коферментные формы. Поступившие в организм животного и человека с пищей витамины переходят в активные коферментные формы путем трансферазных реаций − переноса фосфогрупп (витамины В1, В2 и В6), нуклеотидильных остатков (витамин В2), метильных групп (витамин В12), катализируемых фосфо-, нуклеотидил- и метилтрансферазами (схемы (73)−(77)):
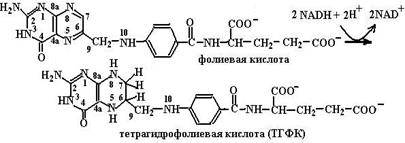
Некоторые коферменты образуются в результате окислительно-восстановительных реакций (витамин А, В9, К). Витамин К (хиноидная форма) восстанавливается с помощью NADPH и витамина К-редуктазы в гидрохинон (схема (78)):
Витамин В9 (фолиевая кислота) дважды восставливается с помощью NADH, фолат- и дигидрофолатредуктазы с образованием тетрагидрофолиевой кислоты – ТГФК (схема (79)):
Синтез некоторых коферментов из витаминов-предшествен-ников протекает в несколько стадий. Так, никотинамидаденин-динуклеотид, кофермент оксидоредуктаз, может синтезироваться или из никотиновой кислоты (витамин РР, витамин В3) (схема (80)), или из аминокислоты триптофана (схема (81)):
Пантотеновая кислота (витамина В5), состоящая из остатка 2,4-дигидрокси-3,3-диметилмасляной кислоты и β-аланина, соединенных амидной связью, является предшественником кофермента А (схема (82)), кофермента ацилтрансфераз, и 4-фосфопантотеина, кофермента пальмитоилсинтазы. 6.3.1.2. Ферментативные реакции с участием коферментов. NADP и NAD являются коферментами дегидрогеназ, FMN и FAD входят в состав флавиновых ферментов. Тиаминпирофосфат в составе пируватдегидрогеназного и α-кетоглутаратдегидрогеназного комплексов участвует в окислительном декарбоксилировании пирувата и α-кетоглутарата, в этих комплексах он выступает в качестве кофермента дегидрогеназ. Подобная реакция отличается от реакции декарбоксилирования пирувата в ацетальдегид, катализи-
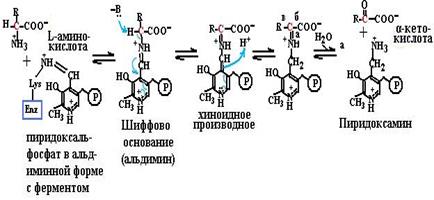
зируемой пируватдекарбоксилазой, где тиаминпирофосфат – кофермент лиазы. В пентозофосфатном пути превращения углеводов в составе транскетолазы тиаминпирофосфат выступает в роли коферменты трансферазы. ТГФК, кофермент трансфераз, участвует в переносе одноуг-леродных фрагментов различной степени окисления: метильных, оксиметильных, метиленовых, метенильных, формильных, форм-иминовых (схема (83)). Эти коферменты участвуют в синтезе пуриновых нуклеотидов, в превращении серина в глицин и т. д. СоА участвует в переносе ацильных фрагментов, активации жир- ных кислот, синтезе холестерина, обезвреживании ксенобиотиков. Пиридоксалевые коферменты важны для обмена аминокислот (схема (84)), катализируя трансферазные реакции трансаминирова- ния (84, а), лиазные реакции декарбоксилирования (84, б), изомераз-
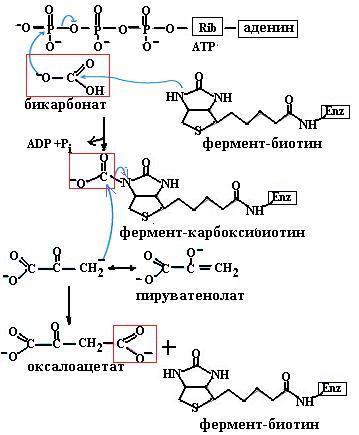
ные реакции рацемизации и метаболизма аминокислот (84, в). Эти коферменты необходимы и в синтезе гема. На основе витамина В12 синтезируются два кофермента: метилкобаламин в цитоплазме, участвующий в образовании метионина из гомоцистеина и производных фолиевой кислоты, необходимых для синтеза нуклеотидов, и дезоксиаденозилкобаламин в митохондриях, необходимый для превращений жирных кислот с нечетным числом углеродных атомов и аминокислот с разветвленной углеводородной цепью. Простетической группой карбоксилаз является биотин (витамин Н), участвующий в образовании активной формы углекислоты для реакций образования малонилСоА из ацетилСоА, оксалоацетата из пирувата (схема (85)), в синтезе пуринового кольца.
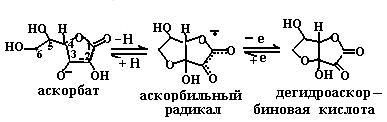
6.3.2. Витамины-антиоксиданты. Как уже говорилось в п. 6.1.2, в кислородной атмосфере в клетке присутствуют активные формы кислорода: синглетный кислород, супероксидный анион, перекиси водорода и липидов, гидроксильный радикал, гипохлорит, пероксинитрит. Все они участвуют в модификации биополимеров клетки: белков, нуклеиновых кислот, полисахаридов и липидов, приводя к изменению их структуры и механизма функционирования и вызывая в организме процессы воспаления, онкогенеза, радиационного распада, старения. Среди защитных механизмов клетки от действия активных форм кислорода стоит выделить витамины-антиоксиданты, название которых подчеркивает их предназначение. К ним относятся следующие соединения: аскорбиновая кислота, токоферолы и токотриенолы, каротиноиды и семейство витамина А, биофлавоноиды. Витамины-антиоксиданты взаимодействуют с активными формами кислорода, тем самым защищая биополимеры клетки от их разрушающего действия. 6.3.2.1. Аскорбиновая кислота (витамин С). Водорастворимая аскорбиновая кислота способна инактивировать практически все активные формы кислорода (схема (86)). Присутствуя в плазме крови, она более эффективно защищает биомембраны от перекисного окисления, инициируемого пероксильным радикалом, чем другие известные антиоксиданты: тиольные группы белков, ураты, билирубин, α-токоферол.
Аскорбиновая кислота способна защищать биомембраны от окисления также путем повышения активности жирорастворимого витамина Е, восстанавливая продукты его окисления активными формами кислорода, например токофероксильный радикал (см. п. 6.1.2.5). Витамин С присутствует во всех водных компартментах организма (цитоплазме клеток, плазме крови и в других внеклеточных жидкостях), где принимает участие в восстановлении токофероксильного радикала. Кроме этого, он проявляет свои коферментные свойства и в некоторых метаболически важных ферментативных реакциях, например в реакциях гидроксилирования (синтез оксипролина, дофамина и т. д.). 6.3.2.2. Витамин Е. Семейство витамина Е состоит из четырех токоферолов и четырех токотриенолов. В состав этих соединений входит хромановое кольцо с набором заместителей (гидроксильной и метильных групп) и боковая фитильная цепь, у триенолов содержащая три двойные связи (схема (87)). В структуре боковой цепи витамина Е имеется три хиральных атома углерода: 2’, 4’, 8’. Конфигурация природного витамина Е – RRR.
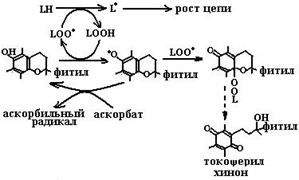
Будучи жирорастворимыми соединениями, представители семейства витамина Е выполняют свою основную биохимическую реакцию, защищая биомембраны внутри от окисления гидроксильными, пероксильными, алкоксильными радикалами и металлокислородными комплексами, обрывая цепную реакцию ПОЛ (схема (88)). В этой реакции гидроксильная группа витамина Е отдает свой атом водорода радикалу, что приводит к терминации радикальной цепи и окончанию реакции автоокисления липидов. Стоит отметить, что образовавшийся относительно стабильный токофероксильный радикал (см. схему (88)) может связать второй липидный радикал. Таким образом, молекула витамина Е обрывает две цепи липидного автоокисления, но в результате этих реакций сама перестает выполнять функции антиоксиданта.
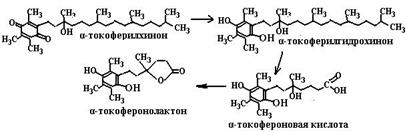
Токоферилхинон может восстанавливаться в токоферилгидрохинон NAD(P)H-зависимыми микросомальной и митохондриальной оксидоредуктазами (схема (89)). Метаболизм токоферолов в организме человека приводит к образованию двух видов продуктов. В случае взаимодействия с активными формами кислорода путем передачи двух электронов хромановое кольцо токоферолов разрушается и образуется стабильный токоферолхинон, который сначала восстанавливается в токоферолгидрохинон, а далее распадается с образованием токофероновой кислоты и ее лактона (схема (90)). При окислении боковой фитильной цепи витамина Е образуются другие метаболиты, а именно α- и γ-СМВНС (карбоксиметилбутилгидроксихроман) и α- и γ-СЕНС (карбоксиэтилгидроксихроман) (схема (91)). γ-Токоферол, являясь сильным нуклеофилом, способен обезвреживать электрофильные мутагены, такие как пероксинитрит.
Витамин Е выполняет свою функцию антиоксиданта в комплексе с другими соединениями, такими как витамин А, витамин С и селен. При этом синергизм настолько высок, что витамин А и селен в отсутствие токоферола окисляются, теряют свои антиоксидантные свойства, и витамин А быстро разрушается.
Токофероксильный радикал может восстанавливаться до исходного токоферола не только аскорбатом, но и глутатионом, цитратом, биофлаваноидами, восстановленной липоевой кислотой, убихиноном, карнозином, ансерином, β-каротином, витамином К, содержащимися в биомембране. Сочетание витаминов Е и С позволяет осуществить защиту клетки по аддитивному механизму: аскорбиновая кислота в водной среде, примыкающей к биомембранам, и витамин Е в липидном слое биомембраны. Были обнаружены многокомпонентные антиоксидантные комплексы: витамин Е – витамин С – селен; витамин Е – витамин А – селен; убихинон – витамин Е – витамин А – биофлаваноиды.
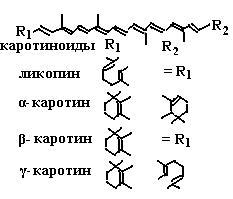
Кроме описанных выше реакций, витамин Е влияет на биосинтез некоторых ферментов, участвующих, например, в построении гема. Витамин Е в синергизме с селеном способствует продукции антител. Установлена связь токоферолов с функцией и состоянием эндокринных систем: половых желез, гипофиза, надпочечников и щитовидной железы. Витамин Е способствует нормальному течению беременности и развитию плода, участвует в процессах образования спермы. Он также стимулирует деятельность мышц, участвует в обмене белков и углеводов. α-Токоферол играет роль в межклеточной передаче сигналов, ингибирует пролиферацию клеток гладких мышц, уменьшает активность протеинкиназы C, увеличивает активность фосфопротеинфосфатазы 2A, управляет экспрессией гена тропомиозина, регулирует активность фосфолипазы A2 и циклооксигеназы. Витамин E поглощается в кишечнике и попадает в кровообращение через лимфатическую систему. Он транспортируется в печень вместе с липидами с помощью хиломикронов. Только для α-токоферола обнаружен высокоспецифичный транспортный белок (ТТР), который, проводя сортировку различных видов токоферолов, обеспечивает попадание в плазму крови лишь RRR-α-токоферолу. 6.3.2.3. Витамин А. Вместе с токоферолами и токотриенолами в обеспечении целостности липидных мембран участвуют представители семейства жирорастворимого витамина А и их предшественники – каротиноиды (схема (92)).
В связи с наличием нескольких двойных связей каротиноиды могут иметь несколько изомеров: полностью транс-изомер, 9-,11-,13-, 15-цис-изомеры (схема (93)).
Попав в организм животного, каротиноиды превращаются в производные витамина А: ретиналь, ретинол, ретиноевую кислоту, синтез которых представлен на схеме (94). При окислении β-каротина под действием β-каротин-15,15'-диоксигеназы (К.Ф. 1.11.13.21) образуется сначала ретиналь, который далее или восстанавливается NADH-зависимой оксидоредуктазой в ретинол, или окисляется NAD+-зависимой оксидоредуктазой в ретиноевую кислоту. Депонирование витамина А происходит в клетках печени в виде эфиров ретинола. Как уже говорилось, витамин А благодаря наличию нескольких двойных связей участвует в сложных антиоксидантных комплексах, защищающих клеточные мембраны от токсического действия активных форм кислорода. Кроме этого, он проявляет коферментные свойства. Наиболее детально изучено участие витамина А в зрительном акте, когда падающий на сетчатку глаза свет адсорбируется пигментами сетчатки и преобразуется в электрический импульс. В сетчатке
глаза содержатся два вида фоторецепторных клеток, представляющих собой высокоспециализированные нейроны, выполняющие сенсорную функцию: палочки и колбочки. Они выделяют нейромедиатор, в отличие от других нейронов, в состоянии покоя (в темноте), при возбуждении (на свету) выделение нейромедиатора тормозится. Далее медиатор воздействует на постсинаптические окончания нейронов второго порядка, через них сигнал поступает к нейронам третьего порядка и далее по зрительным нервам передается в мозг.
Рис. 6.42. Схематичное строение фоторецепторных клеток – палочек, состоящих из множества параллельных фоторецепторных дисков, в мембраны которых встроен зрительный пигмент – родопсин (согласно [5]) В мембраны фоторецепторных клеток (палочек) (рис. 6.42) встроен зрительный пигмент – родопсин, состоящий из белка опсина и его простетической группы – ретиналя. Родопсин – это рецептор, семь раз пронизывающий мембрану и связанный с типичным гетеротримерным G-белком – трансдуцином. Фотон света, взаимодействуя с простетической группой родопсина – 11-цис-ретиналем, фиксированным на родопсине альдиминной связью с Lys296 (в седьмой цитоплазматической петле), вызывает изомеризацию в транс-ретиналь, что приводит к изменениям в пространственной структуре родопсина.
Третья цитоплазматическая петля родопсина активирует трансдуцин, α-субъединица которого, обменяв связанный GDP на цитоплазматический GTP, диссоциирует из комплекса с β- и γ-субъединицами и связывается с ингибиторной γ-субъединицей тетрамерной (αβγ2) сGMP-фосфодиэстеразы, освобождая каталитические αβ-субъединицы от ингибирования (схема (95)).
Переведенная в активную форму сGMP-фосфодиэстераза гидролизует сGMP до 5'-GMР. сGMP в роли вторичного посредника в фоторецепторных клетках связывается с ионными каналами и открывает их (рис. 6.43). Через эти катионные каналы в клетку из внеклеточного пространства поступают ионы натрия и кальция (это происходит в темноте). Цитоплазматический уровень сGMP на свету резко падает, нуклеотид диссоциирует из комплекса с белками ионных каналов, ионные каналы закрываются, катионный ток прекращается, плазматическая мембрана гиперполяризуется (становится более отрицательно заряженной, чем в темноте). Гиперполяризация сопровождается снижением секреции нейротрансмиттера в синаптическую щель и передачей сигнала к нейронам высшего порядка.
Рис. 6.43. Фосфодиэстеразный каскад трансдукции светового сигнала в фоторецепторах сетчатки: Rho– родопсин, * Rho – фотоактивированный родопсин, Gt– трансдуцин, PDE– фосфодиэстераза, * PDE – активированная фосфодиэстераза. Внизу схематически показаны ионные каналы в открытом и закрытом состоянии В клетке снижается концентрация иона Са2+, откачиваемого из нее в обмен на ион Na+ с помощью Na+/K+,Ca2+-обменника. Этот обменник светонезависим, и выведение Ca2+ продолжается и после закрытия катионных каналов. Концентрация этого иона заметно падает, что приводит к запуску механизмов, возвращающих фоторецепторную клетку к темновому невозбужденному состоянию. Фосфодиэстеразный каскад многократно усиливает зрительный сигнал. За время фоторецепторного ответа, равное одной секунде, одна молекула родопсина способна проактивировать сотни молекул трансдуцина, одна молекула трансдуцина активирует одну молекулу сGMP-фосфодиэстеразы, гидролизующей до 3 000 молекул сGMP в секунду. Таким образом, сигнал (от фотона до гидролиза сGMP) усиливается в 100 000 раз.
Рис зрение (96)
Для того, чтобы возвратиться к темновому состоянию, родопсин фосфорилируется вблизи С-конца родопсинкиназой. Родопсинкиназа при высоких концентрациях иона Са2+ в цитоплазме находится в комплексе с Са2+-связывающим белком рековерином в неактивном состоянии. При уменьшении уровня Са2+ рековерин диссоциирует из комплекса с родопсинкиназой, активируя ее после передачи зрительного сигнала. С фосфорилированным родопсином связывается белок аррестин, что полностью блокирует активацию родопсином трансдуцина. GTP, связанный с α-субъединицей трансдуцина, гидролизуется под действием GTP-азной активности трансдуцина. Комплекс GDP- α-субъединица трансдуцина имеет малое сродство к γ-субъединице сGMP-фосфодиэстеразы, комплекс распадается, трансдуцин снова превращается в гетеротример (αβγ), а сGMP-фосфодиэстераза – в неактивный гетеротетрамер (αβγ2). Гидролиз сGMP прекращается. Зрительный каскад полностью выключен (схема (96)). Родопсин распадается на опсин и транс-ретиналь, который восстанавливается NADPH-зависимой ретинолдегидрогеназой (RDH) в транс-ретинол. Транс-ретинол изомеризуется в 11-цис-ретинол, окисляемый RDH обратно в 11-цис-ретиналь (схема (97)). Опсин дефосфорилируется протеинфосфатазой 2А. 11-Цис-ретинол образует основание Шиффа с молекулой опсина. Гуанилатциклаза, находящаяся в неактивном состоянии в темноте при высоком уровне ионов Са2+, переходит в активное состояние с помощью фоторецепторного Са2+-связывающего активаторного белка гуанилатциклазы. На свету при низкой концентрации Са2+ синтез сGMP ускоряется. Клетка возвращается к прежнему невозбужденному состоянию и принимает следующий квант света. Ретиноиды играют также фундаментальную роль в эмбриональном развитии и нормальных процессах клеточной диффе-ренцировки, в процессах роста. 6.3.2.4. Витамин К. Все проферменты свертывающей системы крови − II, VII, IX, X − содержат остатки g-карбоксиглутаминовой кислоты, которая образуется в результате посттрансляционной модификации этих белков в эндоплазматическом ретикулуме гепатоцитов.
Карбоксилирование остатков глутаминовой кислоты в проферментах системы свертывания крови катализирует карбоксилаза, коферментом которой выступает восстановленная форма витамина К - дигидрохинон. Витамин К, поступая в организм с пищей, восстанавливается в печени NADPH-зависимой витамин К-редуктазой с образованием дигидрохинона витамина К. На первой стадии витамин К-зависимой реакции карбоксилирования глутаминовой кислоты происходит окисление кислородом воздуха дигидрохинона витамина К до алкоксида витамина К (рис. 6.44), который, являясь сильным основанием, отрывает протон от g-углеродного атома Glu. Карбанион реагирует с СО2 с образованием g-карбоксиглута- миновой кислоты и 2,3-эпоксида витамина К. Эпоксид восстанавливается в дигидрохинон витамина К сложной редокс-системой, локализованной в эндоплазматическом ретикулуме и состоящей из нескольких субъединиц (рис. 6.45): витамин К-2,3-эпоксидредуктазы (VKORC1), протеиндисульфидизомеразы (PDI), оксидазы 1 эндоплазматического ретикулума (ERO1).
Рис. 6.44. Схема синтеза g-карбоксиглутаминовой кислоты Все перечисленные ферменты имеют тиоредоксин-подобные домены (на рис. 6.45 изображены как последовательность СХХС) и являются дитиол/дисульфид-зависимыми оксидоредуктазами. Восстановительные эквиваленты в этот комплекс поставляет PDI, которая, участвуя в правильном фолдинге вновь синтезированных в эндоплазматическом ретикулуме белков, например РНК-азы, путем создания необходимых дисульфидных связей, действует и как оксидоредуктаза, и как шаперон. За счет окисления двух сульфгидрильных групп ферментов комплекса до дисульфида происходит восстановление эпоксида в хинон и далее в гидрохинон витамина К. Недостаточность витамина К приводит к нарушению карбоксилирования проферментов свертывающий системы крови и сопровождается кровоточивостью и кровоизлияниями. Для предупреждения тромбозов используют препараты, ингибирующие тиолзависимые ферменты витамин К-2,3-эпоксидредуктазу и протеиндисульфид-изомеразу, вызывая торможение свертывания крови.
Рис. 6.45. Ферментативная система, обеспечивающая функционирование цикла витамина К (витК1) при синтезе g-карбоксиглутаминовой кислоты. ВитК1Н2 - дигидрохинон витамина К1, витK1>O - 2,3-эпоксид витамина К1, VKOR и VKORС1 - витамин К 2,3-эпоксидредуктаза, ERO1 - оксидаза 1 эндоплазматического ретикулума, PDI - протеиндисульфидизомераза, СХХС - аминокислотная последовательность в активном центре оксидоредуктаз, характерная для тиоредоксин-подобных ферментов и катализирующая реакции восстановления - окисления за счет превращения дитиол - дисульфид (согласно [30]) 6.3.3. Витамины-гормоны. К этой немногочисленной группе относятся ретиноевые кислоты, представители семейства витамина А, и семейство витамина D. 6.3.3.1. Ретиноевые кислоты. Из схемы (94) видно, что предшественником ретиноевых кислот является ретиналь, образующийся из каротиноидов, синтезируемых только в растениях. Образующаяся в результате окисления ретиналя полностью транс-ретиноевая кислота (см. схемы (94) и (98)) под действием внутриклеточных изомераз в дальнейшем превращается в 9-цис-ретиноевую кислоту, 11-цис-ретиноевую и 13-цис-ретиноевую кислоту. Первые две формы являются гормонами и участвуют в передаче сигнала в клетки (схема (86)). К 2002 году было обнаружено 532 гена, экспрессия которых регулировалась напрямую или косвенно ретиноевыми кислотами.
Для получения эффекта ретиноевая кислота должна попасть в ядро и специфически связаться с ядерным рецептором. Рецепторы ретиноевых кислот принадлежат к суперсемейству ядерных рецепторов стероидных и тиреоидных гормонов, а также витамина D. Аминокислотные последовательности доменов этих рецепторов, отвечающих за связывание с лигандом и ДНК, обладают высокой степенью гомологии. В семействе рецепторов ретиноевой кислоты описаны два подтипа – РРК (RAR) и РРХ (RXR) (схема (99)), которые различаются по степени сродства к разным ретиноидам. Полностью транс-ретиноевая кислота связывается только с RAR, в то время как 9-цис-ретиноевая кислота связывается и с RAR, и с RXR, а 13-цис-ретиноевая кислота не связывается ни с одним из этих рецепторов. Однако в процессе метаболизма последняя подвергается изомеризации в полностью транс-ретиноевую кислоту. Идентифицированы шесть рецепторов ретиноевой кислоты – RAR α, β, γ и RXR α, β, γ. Каждый рецептор может иметь свою собственную ткань-мишень. Рецептор ретиноевой кислоты состоит из 6 консервативных областей (A−F), включающих домены, связывающие лиганд (LBD, область Е) и ДНК (DBD, область С) (схема (100)).
Рядом с LBD располагается область, участвующая в димеризации рецепторов (именно димерный рецептор участвует в передаче сигнальной информации). При этом RAR и RХR могут образовывать гомо- и гетеродимеры (в случае с RАR гетеродимер образуется только с RХR). RХR входит в состав гетеродимеров не только с RAR, но и с рецепторами к стероидным, тиреоидным гормонам (TR), витамину D (VDR) (схема (101)).
Для узнавания и связывания с консенсусной последовательностью ДНК в промоторе гена-мишени в составе DBD имеется две структуры «цинковый палец» (схема (102)). В N- и С-концевых частях рецептора располагаются области, ответственные за взаимодействие с транскрипционным аппаратом клетки и его активацию (АF).
После связывания ретиноевой кислоты с димерным рецептором происходит активация рецептора путем изменения его конформа- ции. Теперь димерный рецептор выступает в роли транскрипционного фактора и, связавшись со специфическими участками ДНК, получившими название «элементов реакции на ретиноевую кислоту» (RARE – retinoic acid responsive element, его консенсусная последовательность – AGGTCA) (схема (102)), запускает транскрипцию генов-мишеней, при этом корепрессор транскрипции, включающий в свой состав гистондеацетилазу (действие этого фермента направлено на упрочнение комплекса ДНК-гистоны и получение
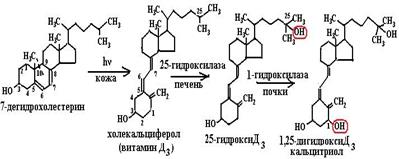
Рис. 6.46. Трехступенчатый механизм действия рецептора ретиноевой кислоты: а – в отсутствие лиганда RAR, связанный с RARЕ в промоторе гена-мишени, взаимодействуя с корепрессорным комплексом, в который входит гистондеацетилаза (HDAC), ингибирует процесс транскрипции; б – после связывания лиганда корепрессорный комплекс замещается на коактиваторный, в составе которого − гистонацетилаза (НАТ), метилтрансфераза и киназа, приводящие к деконденсации хроматина; в – коактиваторный комплекс инициирует процесс транскрипции (согласно [12]) хроматина в неактивном состоянии, неспособном к транскрипции), диссоциирует из комплекса с хроматином (рис. 6.46, а). С областью АF рецептора связывается коактиваторный комплекс, включающий в себя гистонацетилазу, которая, модифицируя хроматин, приводит к его разрежению (деконденсированию) (рис. 6.46, б) и способности взаимодействовать с РНК-полимеразой II (рис. 6.46, в). Ретиноевые кислоты вызывают многочисленные биохимические и метаболические изменения в тканях: 1) модификацию активности ферментов, участвующих в пролиферации или дифференцировке; 2) связывание со структурными белками и модификацию мембранных гликопротеинов; 3) проведение сигнала и экспрессию мембранных рецепторов; 4) модификацию экспрессии генов или онкогенов путем регуляции транскрипции или посттранскрипционных комплексов. 6.3.3.2. Витамин D. К семейству витамина D относятся несколько соединений, отличающихся по химическому строению и биологической активности, прежде всего это витамины D2 (эргокальциферол) и D3 (холекальциферол) (схема (103)). В основе этих витаминов лежит система циклопентанпергидрофенантрена, содержащего в третьем положении гидроксильную группу. Эргокальциферол синтезируется в растениях из эргостерина, а холекальциферол – из 7-дегидрохолестерина, присутствующего в коже человека и превращающегося в витамин D3 под действием солнечного света.
После транспортировки кровью в печень холекальциферол в митохондриях гепатоцитов подвергается реакции гидроксилирования по 25-положению с помощью цитохрома Р450, после чего продукт реакции переносится в почки, где происходит реакция гидроксилирования 25-гидроксихолекальциферола по 1-положению с помощью 1-гидроксилазы (цитохрома Р450) с образованием кальцитриола (1, 25-дигидроксихолекальциферола) (схема (104)):
Кальцитриол является гормоном. Его основная функция в организме человека и животных заключается в регуляции: 1) всасывания иона кальция в кишечнике; 2) гомеостаза Са2+ в крови; 3) обмена ионов кальция и фосфата для обеспечения целостности костей и зубов (рис. 6.47). Свое воздействие на клетки кальцитриол осуществляет аналогично ретиноевым кислотам. Рецептор кальцитриола (VDR) (схема (92)) относится к тому же семейству ядерных рецепторов, что и RAR, RХR, ТR, и имеет сходное строение (схема (105)).
Комплекс кальцитриола и гетеродимера VDR – RAR, образующийся в ядре клетки, служит транскрипционным фактором для определенных генов-мишеней. Процесс транскрипции, активируемый вышеописанным комплексом и изображенный на схеме (106), протекает аналогично процессу транскрипции, активируемому ретиноевыми кислотами (ср. рис. 6.46).
Рис. 6.47. Метаболизм 7-дегидрохолестерина в организме человека. Под действием солнечного облучения 7-дегидрохолестерин в коже превращается в витамин D3, в печени гидроксилируется по 25-положению, в почках по 1-положению (при этом 1-гидроксилаза в почках активируется паратиреоидным гормоном – РТН). 1, 25-дигидрокси D3 регулирует всасывание кальция в кишечнике, обмен ионов кальция и фосфата в костях. Выведение гормона из организма происходит после гидроксилирования по 24-положению (25-ГОлаза, 24-ГОлаза, 1-ГОлаза – 25-гидроксилаза, 24-гидроксилаза, 1-гидроксилаза) .
Гены, экспрессия которых зависит от кальцитриола, кодируют белки, участвующие в метаболизме ионов кальция и фосфата: остеокальцин, остеопонтин, 1- и 24-гидроксилазы, кальбиндин. 6.3.4. Витаминоподобные вещества. Некоторые соединения не попадают под определение витаминов. Во-первых, они синтезируются в организме человека, но не в достаточных количествах. Во-вторых, не установлена их бесспорная необходимость для животных и человека. В-третьих, в пище они встречаются не в микроколичествах, поэтому подобные соединения получили название «витаминоподобные». К ним относят оротовую, пангамовую и липоевую кислоты, инозит, убихиноны, метилметионин, карнитин. Подробно эти соединения рассмотрены в методическом пособии Мызиной С. Д., Халимской Л. М. «Биологически активные соединения. Витамины, гормоны и биорегуляторы» (Новосибирск, 2006. С. 30−41).
Поиск по сайту: |

 (64)
(64)


 (65)
(65)
 (66)
(66) (67)
(67)
 (68)
(68)

 (69)
(69) (70)
(70) (71)
(71)
 (73)
(73) (74)
(74) (75)
(75) (76)
(76) (77)
(77) (78)
(78) (79)
(79) (80)
(80) (81)
(81) (82)
(82) (83)
(83)
 (84)
(84) (85)
(85) (86)
(86)

 (87)
(87) (88)
(88) (89)
(89) (90)
(90) (91)
(91) (92)
(92) (93)
(93) (94)
(94)

 (95)
(95)
 (97)
(97)

 (98)
(98) (99)
(99) (100)
(100) (101)
(101) (102)
(102)
 (103)
(103) (104)
(104) (105)
(105)
 (106)
(106)