 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкенаСтр 1 из 5Следующая ⇒
Теоретические пояснения Органическая химия - наука, занимающаяся изучением соединений углерода (как природных, так и полученных синтетическим путем). Причины выделения органической химии в отдельную науку заключаются в многообразии органических соединений, обусловленном способностью атомов углерода соединяться друг с другом и с атомами других элементов. Кроме того, органические вещества имеют исключительное значение вследствие их важной роли в процессах жизнедеятельности животных и растительных организмов и широко применяются в различных отраслях промышленности строительных материалов, сельского и лесного хозяйства, в производстве промышленных и продовольственных товаров, в медицине и биологии. В настоящих методических указаниях авторы кратко попытались изложить теоретические аспекты основных классов органических соединений в свете представлений теории химического строения А.М. Бутлерова.
Алканы Методы получения Главным природным источником предельных углеводородов является нефть, а для первых членов гомологического ряда – природный газ. Однако, выделение индивидуальных соединений из нефти или продуктов ее крекинга –весьма трудоемкая, а часто и невыполнимая задача, поэтому приходится прибегать к синтетическим методам получения. 1.Алканы образуются при действии металлического натрия на моногало-генпроизводные – реакция Вюрца:
Если взяты разные галогенпроизводные, то образуется смесь трех различных алканов, так как вероятность встречи в реакционном комплексе одинаковых или разных молекул равна, а реакционная способность их близка:
2. Алканы могут быть получены при восстановлении алкенов или алкинов водородом в присутствии катализаторов.
3. Самые разнообразные производные алканов могут быть восстановлены при высокой температуре йодоводородной кислотой:
4. Алканы могут быть полученыпри сплавлении солей карбоновых кислот со щелочью. Образующийся при этом алкан содержит на один атом углерода меньше, чем исходная карбоновая кислота:
Химические свойства Предельные углеводороды при обычных условиях обладают большой химической инертностью. Это объясняется тем, что все 1. Радикальное галогенирование. На свету галогены (энергичнее всего хлор, с йодом реакция не идет) последовательно замещают атомы водорода в предельных углеводородах:
CH4 + Cl2 CH3Cl + Cl2 CH2Cl2 + Cl2 CHCl3 + Cl2
2. Нитрование. Азотная кислота при обычной температуре почти не действует на предельные углеводороды; при нагревании же действует главным образом как окислитель. При нагревании (около1400С) и под давлением азотная кислота действует как нитрующий агент, т. е. один из атомов водорода предельного углеводорода замещается на остаток кислоты –NO2 (нитрогруппа):
Эта реакция тоже радикального типа и подчиняется тем же закономерностям, что и реакция галогенирования, т. е. легче всего замещается водород у третичного атома, затем у вторичного и труднее всего у первичного атома углерода. 3. Окисление.Окислители, даже такие, как хромовая смесь и марганцевокислый калий, при обычных температурах не действуют на предельные углеводороды. При температуре выше 300оС предельные углеводороды воспламеняются и сгорают с образованием СО2 и Н2О: С5Н12 + 8О2 При очень высоких температурах в промышленности реализован процесс взаимодействия метана с водой: СН4 + Н2О 4. Сульфохлорирование. Эта реакция имеет большое значение в производстве моющих средств. Тяжелые фракции синтетических углеводородов С12–С18 в условиях ультрафиолетового облучения подвергаются совместному действию Cl2 и SO2. Образующиеся сульфонилхлориды при омылении щелочами дают соли сульфокислот:
а) Сl2 б) CH3(CH2)10CH3 в)CH3(CH2)10CH2• CH3(CH2)10CH2-SO2Сl натриевая соль додекансульфо-кислоты (моющее средство)
Реакция сульфохлорирования, как и реакция радикального галогенирования, является цепной реакцией. Алкены Методы получения 1. При действии спиртовых растворов щелочей на галогенпроизводные отщепляется галогенводород и образуется двойная связь:
СН3-СН2-CH2Br
Если в

2. Действием на спирты водоотнимающих средств:
3.При действии Zn или Мg на дигалогенпроизводные с двумя атомами галогена у соседних атомов углерода:
4. Гидрированием ацетиленовых углеводородов над катализаторами:
5. Алкены в виде сложных смесей получаютсяпри крекинге нефти
Химические свойства Наличие в молекулах алкенов двойной связи, состоящей из Естественно ожидать, что реакции алкенов будут проходить по двойной связи, а следовательно, будут реакциями присоединения, а не реакциями замещения, характерными для ранее рассмотренных алканов. 1. Присоединение водорода. Присоединение водорода к алкенам приводит к образованию предельных углеводородов:
СН3-СН=CH2 + Н2 2. Присоединение галогенов. Галогены присоединяются к алкенам с образованием вицинальных дигалогенпроизводных, т. е. содержащих атомы галогена у соседних атомов углерода.
3. Присоединение галогенводородов. Галогенводороды присоединяются к алкенам с образованием галогеналкилов. Присоединение в случае несимметричных молекул идет по правилу Марковникова, т. е. водород присоединяется к наиболее гидрогенизированному атому углерода (с наибольшим числом водородных атомов):
4. Присоединение воды и серной кислоты. В присутствии кислот вода присоединяется по двойной связи в соответствии с правилом Марковникова:
R-CH=CН2 + H2О │ ОН Так же идет и реакция с серной кислотой:
R-CH=CН2 + H2SО4 │ OSО3H
5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей. 3R-CH=CH-R + 2KMnO4 + 4H2O │ │
Кислые растворы перманганата окисляют алкены с разрывом цепи по С=С связи с образованием кислот или кетонов:
6. Действие озона на алкены.Действие озона на алкены приводит к образованию кристаллических сильно взрывчатых озонидов, которые при гидролизе образуют альдегиды или кетоны:
Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена. 7. Полимеризация алкенов. Большое значение получила полимеризация этилена и пропилена в полимеры с молекулярной массой около 105. До 1953 г. в основном применялась радикальная (инициируемая свободными радикалами) полимеризация, однако после, работ Циглера и Натта используют ионную полимеризацию (инициируемую ионами). Процесс полимеризации проводят в присутствии катализатора (триэтилалюминия или тетрахлортитана):
Полиэтилен, получаемый этим способом, представляет coбoй предельный углеводород с неразветвленной цепью. Благодаря сочетанию многих ценных свойств полиэтилен имеет очень широкое применение. Он является одним из лучших материалов для изоляции кабелей, применяется в радарной технике, радиотехнике, сельском хозяйстве и др. Из него изготавливают трубы, шланги, сосуды, тару для сельскохозяйственных продуктов и удобрений, пленки различной толщины и многие бытовые предметы.
Алкины Методы получения Наиболее общим способом получения ацетиленовых углеводородов является действие спиртового раствора щелочей на дигалогенпроизводные предельных углеводородов с вицинальным (а) или геминальным (б) расположением атомов галогена


Так как вицинальные дигалогенпроизводные обычно получают присоединением галогенов к этиленовым углеводородам, то реакцию (а) можно рассматривать как реакцию превращения этиленовых углеводородов в ацетиленовые. Геминальные дигалогенпроизводные (оба атома галогена у одного атома углерода) являются производными кетонов или альдегидов и, следовательно, с помощью реакций (б) можно осуществить переход от карбонильных соединений к алкинам. При отщеплении галогеноводородов действует правило Зайцева: водород отщепляется от углеродного атома, содержащего меньшее количество атомов водорода. Ацетилен можно получать непосредственно при высокотемпературном крекинге (термическом или электротермическом) метана или более сложных углеводородов: 2СН4
а так же при гидролизе карбида кальция – продукта высокотемпературного взаимодействия оксида кальция и углерода: СаСО3 СаО +3С CаC2 + Н2О Химические свойства В молекулах алкинов атом углерода находится в sp-гибридизации, следовательно молекулы алкинов имеют линейное строение, а между атомами углерода имеется тройная –Сº С– связь, состоящая из двух Все реакции присоединения, свойственные алкенам, наблюдаются и у алкинов. Однако, у алкинов после присоединения первой молекулы реагента остается еще одна Другой особенностью алкинов является наличие у некоторых из них, так называемого, ацетиленового атома водорода ( Так как s-электроны находятся ближе к ядру, чем соответствующие p-электроны, то электроны sp-орбитали значительно прочнее связаны с ядром, чем электроны sp2 и тем более sp3-орбиталей. Поэтому электронная пара связи Это действительно происходит, хотя и в значительно меньшей степени, чем для кислот обычного типа. Поэтому для алкинов, имеющих ацетиленовый атом водорода, следует помимо реакций присоединения по тройной связи ожидать и реакций замещения этого атома водорода на другие группы.
Поиск по сайту: |
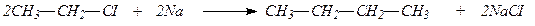



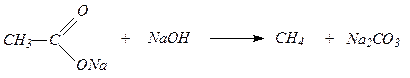
 -связи углерод — углерод и углерод — водород в них весьма прочны (энергии этих связей порядка 350-400 кДж/моль). К реакциям присоединения они вообще не способны вследствие насыщенности всех связей атомов углерода. C большинством химических реагентов алканы или вовсе не реагируют, или реагируют чрезвычайно медленно. Так, концентрированная серная кислота, обугливающая многие органические соединения, на предельные углеводороды не действует при комнатной температуре. Сильные окислители (например, марганцeвокислый калий) при комнатной температуре тоже не действуют на алканы.
-связи углерод — углерод и углерод — водород в них весьма прочны (энергии этих связей порядка 350-400 кДж/моль). К реакциям присоединения они вообще не способны вследствие насыщенности всех связей атомов углерода. C большинством химических реагентов алканы или вовсе не реагируют, или реагируют чрезвычайно медленно. Так, концентрированная серная кислота, обугливающая многие органические соединения, на предельные углеводороды не действует при комнатной температуре. Сильные окислители (например, марганцeвокислый калий) при комнатной температуре тоже не действуют на алканы. CH3Cl + HCl
CH3Cl + HCl

 5СО2 + 6Н2О
5СО2 + 6Н2О CH3(CH2)10CH2• + HCI
CH3(CH2)10CH2• + HCI CH3(CH2)10CH2-SO2
CH3(CH2)10CH2-SO2 
 CH3(CH2)10CH2-SO3Na + HCI
CH3(CH2)10CH2-SO3Na + HCI СН3-СН2=CH2 + NaBr + H2O
СН3-СН2=CH2 + NaBr + H2O -положении к атому углерода, связанному с галогеном, находятся третичный, вторичный и первичный атомы водорода, то преимущественно отщепляется третичный атом водорода, в меньшей степени вторичный и тем более первичный (правило Зайцева).
-положении к атому углерода, связанному с галогеном, находятся третичный, вторичный и первичный атомы водорода, то преимущественно отщепляется третичный атом водорода, в меньшей степени вторичный и тем более первичный (правило Зайцева).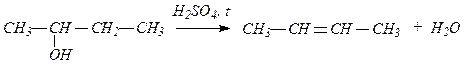


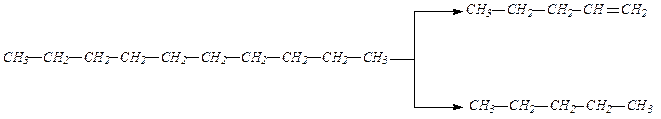
 - и
- и  -связь прочнее чем
-связь прочнее чем  СН3-СН2-CH3
СН3-СН2-CH3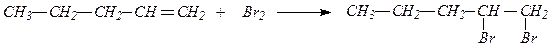

 R-CH-CН3
R-CH-CН3


 -(СН2-СН2 )n-
-(СН2-СН2 )n- Н-С
Н-С  С-Н + ЗН2
С-Н + ЗН2 СаО + СО2
СаО + СО2  C
C  Н) и следует ожидать более легкого гетеролитического разрыва этой связи с отщеплением протона Н+, т. е. проявления у незамещенных алкинов кислотных свойств.
Н) и следует ожидать более легкого гетеролитического разрыва этой связи с отщеплением протона Н+, т. е. проявления у незамещенных алкинов кислотных свойств.