 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Рідинні (хімічні) методи травленняСтр 1 из 2Следующая ⇒
Травлення Травлення являє собою процес видалення поверхневого шару об'єкта немеханічним способом. Дана технологічна операція застосовується для одержання максимально рівної бездефектної поверхні напівпровідникових пластин (хімічного полірування); видалення з поверхні пластин різних плівок (наприклад, шару SiО2 або металізації); локального видалення вихідного матеріалу з окремих ділянок поверхні підкладки; виявлення структурних дефектів на поверхні монокристалічних пластин; формування на поверхні підкладок покриттів, що маскують. При всьому різноманітті методів травлення їх можна розділити на дві великі групи: рідинне (хімічне) травлення й сухе (іонно-плазмове) травлення. В основі рідинного травлення звичайно лежить хімічна реакція рідкого травильника й твердого тіла, у результаті якої утвориться розчинна сполука. Сухе травлення проводять у спеціальних газорозрядних камерах, у яких підкладка обробляється іонами або хімічно активними частками плазми. Рідинні (хімічні) методи травлення За характером взаємодії розчинника з речовиною хімічне травлення (розчинення) буває трьох типів: молекулярне, іонне й реактивне. Молекулярне розчинення. Відмінною рисою цього типу розчинення є повна ідентичність хімічної формули речовини у вихідному стані й у розчині. Після видалення (наприклад, випару) розчинника розчинена речовина може бути отримана в хімічно незмінному виді, хоча з ним можуть відбутися морфологічні зміни. Прикладом такого типу реакцій може служити розчинення цукру у воді, полістиролу в бензолі й так далі. Частковим випадком молекулярного розчинення є утворення колоїдних розчинів, коли речовина в розчині перебуває не у вигляді окремих молекул, а групується у великі полімолекулярні утворення, так звані колоїдні частки. Іонне розчинення. У цьому випадку вихідний стан речовини й стан у розчині не ідентичні. У розчині відбувається поділ іонного кристала на катіони й аніони, які оточені сольватаційними оболонками (у водяних розчинах утвореними полярними молекулами води), які забезпечують стійкість таких розчинів. Проте, як і у випадку молекулярних розчинів, після видалення розчинника розчинена речовина може бути виділена в хімічно незмінному виді. Прикладом такого типу реакцій є розчинення NaCl у воді. Реактивне розчинення. Процес розчинення супроводжується хімічною взаємодією між розчиненою речовиною й розчинником, яка відбувається зі значним тепловим ефектом та суттєво перевищує тепловий ефект при молекулярному або іонному розчиненні. При цьому в розчині будуть присутні продукти, хімічно відмінні від вихідного стану системи. Видалення розчинника не дозволяє одержати розчинену речовину у вихідному виді. Прикладом такого типу розчинення є реакція:
В основному процес травлення можна представити у вигляді п'яти стадій.
ка й формуванню дифузійного потоку цих молекул до поверхні напівпровідника. Щільність потоку
де D - коефіцієнт дифузії молекул травильника; N0 і Ns - концентрації молекул травильника в об'ємі розчину й у поверхні пластини. 2. Адсорбція молекул травильника на поверхні напівпровідника. На цій стадії молекули травильника вступають у контакт із поверхнею. Цей контакт може бути або хімічною адсорбцією (хемосорбцією), або фізичною адсорбцією. У першому випадку між молекулами травильника й поверхневими атомами напівпровідника виникають іонні або ковалентні зв'язки. У другому випадку молекули травильника втримуються на поверхні слабкими силами Ван-Дер-Ваальса. Відповідно енергія активації адсорбції при хемосорбції виявляється істотно більшою, ніж при фізичній адсорбції. 3. Кінетична стадія процесу. На цій стадії в результаті хімічних реакцій молекул травильника з поверхневими атомами відбувається розрив хімічних зв'язків останніх і перехід їх у розчин. Механізми цих реакцій залежать від матеріалу пластини, сполуки травильника й умов травлення. Вони відрізняються більшим різноманіттям і часто бувають досить складні. 4. Десорбція продуктів реакції. У результаті протікання хімічних реакцій на поверхні напівпровідника накопичуються продукти реакції, які можуть бути фізично або хімічно пов'язані з поверхнею. Для того щоб перевести їх у розчин, необхідно розірвати ці зв'язки, що й відбувається на даній стадії. 5. Видалення продуктів реакції від поверхні напівпровідника в об'єм розчину. У результаті переходу розчиненого матеріалу в рідку фазу поблизу поверхні напівпровідника на відстані d накопичуються продукти реакції, концентрація яких Ns істотно перевищує їхню концентрацію N0 в об'ємі розчину (рис.3.23). У результаті виникає дифузійний потік jx молекул речовини, пропорційний градієнту концентрації.
реакції в розчині, або швидкістю хімічної реакції на поверхні пластини. Залежно від того, яка із цих стадій є тою, що лімітує, результати травлення виявляються різними. Нехай, наприклад, стадією, що лімітує, є дифузія молекул травильника (перша стадія) або молекул розчиненої речовини (п'ята стадія). У цьому випадку загальна швидкість процесу травлення буде визначатися щільністю потоку jx молекул (див. формулу 3.29), що залежить від температури, в'язкості травильника, механічних впливів, що сприяють перемішуванню травильника. Від властивостей самої поверхні (кристалічної орієнтації, наявності поверхневих дефектів і так далі) швидкість травлення не залежить. Отже, травлення в цьому випадку повинне відбуватися ізотропно, і в результаті травлення поверхня повинна стає гладкою, тобто травлення носить поліруючий характер. Травильники, для яких стадією, що лімітує, є дифузія, називаються поліруючими, а сам процес травлення - інтегральним. Поліруючі властивості травильників можна підсилити, якщо зменшити швидкість протікання дифузійних процесів. Це можна зробити за допомогою спеціальних добавок, що збільшують в'язкість травильника, або за рахунок зменшення температури процесу. Інтенсивне перемішування травильника, навпроти, руйнує дифузійний шар d, що знімає дифузійні обмеження й погіршує, таким чином, поліруючі властивості травильника. Якщо стадією, що лімітує, є кінетична стадія, то загальна швидкість процесу травлення Vтр буде приблизно дорівнює швидкості хімічної реакції на поверхні:
де Атр - константа швидкості хімічної реакції на поверхні об'єкта; Ns - концентрація молекул травильника на поверхні; DЕ - енергія активації хімічної реакції (надлишкова енергія, якою повинна володіти молекула в момент зіткнення з іншою молекулою, щоб бути здатною до хімічної взаємодії). Енергія активації DЕ залежить від неоднорідності поверхні пластини, кристалографічної орієнтації, наявності на поверхні структурних дефектів. Якщо, наприклад, на поверхні є виходи дислокацій, то в цих місцях енергія активації менше, ніж на ділянках поверхні без дефектів. Тому в «дефектних» ділянках швидкість травлення буде вищою, і на поверхні утворяться ямки травлення, форма яких залежить від кристалографічної орієнтації поверхні пластини. Травильники, у яких стадією, що лімітує, є хімічна реакція, називаються селективними, а процес травлення - диференціальним. Як треба з вираження (3.30), характер селективного травлення визначається не тільки властивостями поверхні, здатними вплинути на значення енергії активації хімічної реакції DЕ, але й у значній мірі температурою. З ростом температури селективність травильника виявляється вираженою менше. Тому для виявлення поверхневих дефектів бажано проводити травлення при низьких температурах. Однак при зниженні температури зменшується в'язкість травильника, і на швидкість усього процесу починають впливати дифузійні стадії, що знижують селективність травильника.
Поиск по сайту: |
 .
. Рис. 3.22. Схема дифузії молекул
травильника до поверхні пластини
Рис. 3.22. Схема дифузії молекул
травильника до поверхні пластини
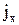 на підставі першого закону Фіка можна оцінити за формулою:
на підставі першого закону Фіка можна оцінити за формулою: , (3.29)
, (3.29) Рис.3.23. Схема дифузії продуктів реакції від поверхні пластини
Рис.3.23. Схема дифузії продуктів реакції від поверхні пластини
 , (3.30)
, (3.30)