 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Г. Реакції полімеризації та поліконденсації
Альдегіди, на відміну від кетонів, здатні до полімеризації. Ре-' акція полімеризації проходить за звичайних умов і прискорюється] в присутності мінеральних кислот. Наприклад, вже в 40 %-вому] водному розчині формальдегіду (формаліну), особливо при тем-1 пературі нижче 9 °С, спостерігається випадання білого осаду, про-]дукту лінійної полімеризації — параформу:
иН2С=0 + Н20 параформ Полімеризація ацетальдегіду в присутності слідів сульфатної кислоти приводить до утворення за певних умов двох циклічних продуктів — паральдегіду і метальдегіду. Паральдегід утворюється,! якщо реакцію проводити при 20 °С, а метальдегід — при 0 °С:
сн, л=3 не І о,
О лН3С—С
И СН СН
/ о \
н3с метал ьдегід Паральдегід — рідина з температурою кипіння 128 °С, метальдегід — тверда речовина, що використовується в побуті як паливо під назвою «сухий спирт». Реакція полімеризації є оборотною, при нагріванні продуктів реакції з мінеральними кислотами відбувається їх деполімеризація. Реакцію поліконденсації формальдегіду з фенолом, яка дає можливість отримання фенолоформальдегідних смол, уже було розглянуто (див. розд. 16.3.4).
ИаСйчені альдегіди і кетони Ґ. Реакції відновленнята окиснення Реакції відновлення.Реакцію відновлення альдегідів і кетонів широко застосовують для отримання спиртів (альдегіди відновлюються до первинних, а кетони — до вторинних спиртів). У техніці спирти добувають у результаті каталітичного гідрування; приєднання водню відбувається в присутності кобальту, нікелю або платини:
,^° .>% к—сн2—он "Н Відновлення альдегідів або кетонів до спиртів у лабораторії проводять за допомогою літійалюмінійгідриду (ІлА1Н4) або воднем у момент виділення:
^О ьіаіН4 н3с-сн2-с
пропаналь
н3с-с-сн3 о пропанон Реакції окиснення.Альдегіди й кетони по-різному реагують на дію окисників. Альдегіди дуже легко окиснюються, навіть при дії таких слабких окисників, якими є іони А§+ і Си2+ , перетворюючись на карбонові кислоти. Реакцію окиснення альдегідів аміачним розчином аргентум нітрату (реактив Толленса) часто називають реакцією «срібного Дзеркала». Аргентум-іон у цій реакції відновлюється до вільного срібла, яке виділяється у вигляді дзеркала на стінках пробірки: я
К_С^ + 2М\ + 4Ш3 + Н20 ^ОН "Н Альдегіди також відновлюють реактив Фелінга (суміш розчину купрум (II) сульфату з лужним розчином солі виннокам'яної кислоти): Си504 -1* Си(ОН)2 + №2$04
К-С^ + Си(ОН)2
+ Си20 червоний осад Реакції окиснення альдегідів аміачним розчином аргентум (І) оксиду і реактивом Фелінга застосовують в аналітичній практиці для виявлення альдегідної групи. Кетони за даних умов не окисінюються, тому цими реакціями розрізняють альдегіди й кетони. Відрізнити альдегіди від кетонів можна також кольоровою реакці-1єю з фуксинсульфітною кислотою, з якою реагують тільки альде-1 гіди (фіолетове забарвлення). Окиснення кетонів відбувається лише в присутності сильних окисників, таких як калій перманганат або калій дихромат, при\ цьому відбувається розрив зв'язків С—С між атомами Карбону] карбонільної групи та вуглеводневого радикала. У результаті реакції утворюється суміш кислот: н-
Т)Н
.0
•_,г-СН2 СН3
прошонова кислота За продуктами, що утворюються при окисненні, визначають будову кетонів. ОКРЕМІ ПРЕДСТАВНИКИ Мурашиний альдегід (формальдегід, метаналь) СН20.Безбарвний газ з різким запахом, розчинний у воді, здобувають термічним дегідруванням метанолу (600 °С) над срібним каталізатором:
сн,он
Поиск по сайту: |


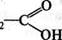 2-бутанон
2-бутанон