|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
БУДОВА БЕНЗЕНУ. АРОМАТИЧНІСТЬ
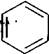
Найпростішим представником одноядерних ароматичних вуглеводнів є бензол С6Н6 (або бензен). Уперше бензен був здобутий М. Фарадеєм 1825 року з конденсованих залишків світильного газу, який утворюється в процесі переробки кам'яного вугілля. Проте будова його молекули тривалий час залишалася для хіміків загадкою. Незважаючи на те, що формула С6Н6 передбачає досить виражений ненасичений характер, бензен, на відміну від ненасичених сполук, виявився порівняно інертною сполукою. Так, він відносно стійкий до нагрівання та дії окисників, практично не вступає в характерні для ненасичених сполук реакції приєднання. Навпаки, для бензену більш характерними виявилися не властиві ненасиченим сполукам реакції заміщення. Будові С6Н6 приписувалися різні структурні формули, але всі вони не пояснювали повною мірою хімічні властивості бензену. Важливий етап у з'ясуванні будови бензену започаткувала висловлена німецьким хіміком А. Кекуле ідея про циклічну будову його молекули. У 1865 році вчений запропонував формулу у вигляді циклу з шести атомів Карбону з розташованими почергово простими та подвійними зв'язками. Ця формула увійшла в органічну хімію як формула Кекуле:
О Ненасичені вуглеводні. Глава 13 рдноядерні арени
Проте за формулою Кекуле бензен повинен мати два 1,2-диза-міщені ізомери: X
Але експериментально було встановлено, що 1,2-дизаміщені бензени не мають ізомерів положення, тобто вони існують у вигляді однієї речовини.
На пояснення цього протиріччя в 1872 році Кекуле висунув осциляційну гіпотезу, за якою три подвійні зв'язки в молекулі бен,-зену не фіксовані, а безперервно переміщуються (осцилюють) між двома можливими положеннями:
Правильно відображаючи деякі властивості бензену, формула Кекуле все ж таки не узгоджувалася з низкою встановлених фактів. Як і раніше, залишалося незрозумілим, чому за наявності в молекулі трьох подвійних зв'язків бензен виявляє значну інертність у реакціях приєднання і набагато більше схильний до реакцій заміщення, чому він стійкий до нагрівання та дії окисників. Усе це змушувало хіміків переглядати структуру бензену. Розгляньмо електронно-точкову схему утворення молекули бензену у відповідності з теорією Льюїса (рис. 13.1, а). За сучасними уявленнями, що грунтуються на даних квантової хімії та фізико-хімічних досліджень, молекула бензену являє собою правильний плоский шестикутник. Усі атоми Карбону знаходяться в стані ^-гібридизації. При цьому кожний атом Карбону утворює три а-зв'язки (один С—Н і два С—С), які лежать в одній площині під кутом 120° один до одного (рис. 13.1, б), і надає одну /7-орбіталь для утворення замкненої спряженої л-електронної системи. Електронна густина я-системи розподілена рівномірно (де-
Рис. 13.1. Будова молекули бензену: а — о-скелет молекули; б — схема утворення о-зв'язків; в — схема утворення замкненої я-електронної системи локалізована) між атомами Карбону та сконцентрована переважно над і під площиною о-скелета молекули (рис. 13.1, в). Обов'язковою умовою повної делокалізації я-електронів, умовою повноти спряження є плоска будова молекули. Утворення замкненої спряженої системи (ароматичного секстету) є для молекули енергетично вигідним процесом. За квантово-механічними Розрахунками Полінга встановлено, що спряження в циклі бензену приводить до зменшення енергії на 150,7 кДж/моль, тобто реально бензен виявився на 150,7 кДж/моль стабільнішим, ніж можна було припустити, виходячи з формули Кекуле. Різниця енергій реального стану молекули бензену і розрахованої для гіпотетичної структури — 1,3,5-циклогексатриєну утворює енергію спряження, або енергію резонансу, і є причиною високої стійкості молекули. Унаслідок спряження всі карбон-карбонові зв'язки в молекулі бензену вирівняні. Ненасичені вуглеводні. Глава 1 Рдноядерні арени
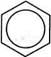
Отже, у бензеновому кільці немає простих! і подвійних зв'язків. На кожний карбон-кар-боновий зв'язок, окрім двох а-електронів, при- і падає електронна густина одного л-електро-на. Такий зв'язок називають ароматичним. Якщо довжина простого зв'язку С—С в алка-нах становить 0,154 нм, довжина подвійного зв'язку в алкенах — 0,134 нм, то довжина кар-бон-карбонового зв'язку в молекулі бензену дорівнює 0,140 нм, тобто є проміжною між довжинами одинарного та подвійного зв'язків (рис. 13.2). Делокалізацію я-електронної густини і вирівняність зв'язків у бензеновому кільці графічно зображують у вигляді кола всередині правильного шестикутника:
О або мезомерні (граничні) структури Однак поряд з таким зображенням у хімії широко послуговуються і формулою Кекуле, яка особливо зручна для опису механізмів реакцій. Але, застосовуючи формулу Кекуле, необхідно пам'ятати, що я-електронна густина в бензеновому кільці делокалізована, а зв'язки між атомами Карбону вирівняні. Сукупність специфічних властивостей бензену, а саме висока стабільність, інертність у реакціях приєднання та схильність до реакцій заміщення, одержала назву ароматичність, або ароматичні властивості. У 1931 році німецький вчений Е. Хюккель на підставі квантово-механічних розрахунків сформулював правило стабільності циклічних спряжених систем, що являє собою теоретично обгрунтований метод, який дозволяє передбачити, буде циклічна спряжена система ароматичною чи ні. За правилом Хюккеля критерієм ароматичності органічної сполуки є наявність в його структурі плоского циклу, який має замкнену спряжену систему із (4л + 2) я-елект-ронів, де п = 1, 2, 3 і т. д. До найбільш поширених ароматичних систем, які містять 6 я-електронів (п = 1), належать бензен і його похідні. Правило Хюккеля застосовують і до систем з конденсованими ядрами, такими, як нафтален, антрацен і фенатрен:
нафтален Ю я-електронів (л=2)
Поиск по сайту: |

 Формула Кекуле передбачає рівноцінність усіх атомів Карбону та Гідрогену в молекулі, що пізніше було підтверджено дослідженнями А. Ладенбурга (1874 р.) і Е. А. Вроблевського (1878 р.).
Формула Кекуле передбачає рівноцінність усіх атомів Карбону та Гідрогену в молекулі, що пізніше було підтверджено дослідженнями А. Ладенбурга (1874 р.) і Е. А. Вроблевського (1878 р.).