 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГІБРИДИЗАЦІЯ АТОМНИХ ОРБІТАЛЕЙ
За квантово-механічною теорією хімічного зв'язку кількість утворених атомом ковалентних зв'язків визначається кількістю одноелектронних атомних орбіталей, тобто кількістю неспарених електронів. Однак атоми деяких елементів утворюють більшу кількість ковалентних зв'язків порівняно з кількістю неспарених електронів в основному стані. Так, атом Карбону в основному стані має два неспарені електрони, але, як відомо, в органічних сполуках він утворює чотири ковалентні зв'язки. Це можна пояснити, якщо уявити, що один з 25-електронів переходить на вакантну 2/>г-орбіталь: 1$ 2з 2рх 2ру 2рг 1$ 2$ 2рх 2ру 2рг \\ \\ \ \\\ \ І І І основний стан Карбону збуджений стан Карбону У такому стані, який називають збудженим, атом Карбону має чотири одноелектронні орбіталі. Оскільки валентні орбіталі Карбону нерівноцінні (одна — я, а три — р), то і ковалентні зв'язки, утворені з їх участю, не повинні бути еквівалентними. Насправді ж, наприклад, у молекулі метану СН4 всі чотири ковалентні зв'яз- Глава З Хімічнии зв язок
Суть гібридизації полягає в тому, що з декількох різних за формою і близьких за енергією атомних орбіталей утворюється така ж кількість однакових за формою та енергією гібридних орбіталей. Наприклад, при взаємодії одієї 5- і трьох /ьатомних орбіталей утворюються чотири 5/?3-гібридні орбіталі. За формою гібридна орбі-таль відрізняється від 5- і ^-орбіталей, являючи собою несиметричну об'ємну вісімку: О Гібридні орбіталі є атомними орбіталями, але виникають вони тільки в процесі утворення хімічного зв'язку і не відображають реальної структури вільного атома. Унаслідок перекриття більшої частки гібридної орбіталі з атомними орбіталями інших атомів утворюється ковалентний зв'язок. У порівнянні з негібридизова-ними гібридні орбіталі вигідніші геометрично і внаслідок більшого перекриття з орбіталями інших атомів утворюють міцні зв'язки. Для атома Карбону характерні три види гібридизації з участю 5- і /ьорбіталей: зр3-, зр2-, ^-гібридизація. Кожному з цих видів відповідає певний валентний стан атома. «^-Гібридизація атомних орбіталей Карбону(перший валентний стан). При 5р3-гібридизації з однієї 5- і трьох /ьорбіталей утворюються чотири якісно нові, рівноцінні .^-гібридні орбіталі, направлені в просторі під кутом 109° 28' (від центра правильного тетраедра до його вершин). Тому 5/?3-гібридизацію називають ще тетраедричною. Виходячи зі схеми, поданої на рис. 3.1, можна припустити, що частка 5-хмари в гібридних 5/?3-орбіталях дорівнює 1/4. У першому валентному стані атом Карбону утворює лише прості ковалентні зв'язки. зр -Гібридизація атомних орбіталей Карбону(другий валентний стан). 5/?2-Гібридизація відбувається внаслідок взаємодії однієї $-і двох /7-орбіталей (рх, ру). Таким чином утворюються три еквіва-
Рис. 3.1. Схема утворення і розміщення в просторі гібридних і/^-орбіталей чотири зр -гібридні орбіталі
Три «р -орбіталі
Рис. 3.2. Будова атома Карбону в ^-гібридному стані:
а — схема утворення гібридних л/^-ор-біталей; б — взаємне розміщення гібридних та негібридної АО
Глава З Умовно частка я-хмари в 5/?2-гібридних орбіталях дорівнює 1/3. Атом Карбону в цьому стані утворює подвійний зв'язок.
зр-Гібридизація Карбону(третій валентний стан). ^-Гібридизація виникає внаслідок злиття однієї 5- і однієї /ьорбіталі (рх). При цьому утворюються дві др-гібридні орбіталі, розташовані одна відносно одної під кутом 180°. Тому ^-гібридизація називається лінійною. Негібридизовані ру- та /?г-орбіталі розташовані у двох взаємно перпендикулярних площинах під Прямим кутом до 5р-гібридних орбіталей (рис. 3.3).
три зр -орбіталі
Рис. 3.3. Будова атома Карбону в 5/?-гібридному стані:
а — схема утворення гібридних 5р-АО; б — взаємне розміщення АО в просторі 5-Характер лр-гібридних орбіталей дорівнює 1/2. У стані ^-гібридизації атом Карбону утворює потрійний зв'язок. Слід зазначити, що поряд з трьома граничними варіантами гібридизації 5- і /«-орбіталей існує багато проміжних типів.
Поиск по сайту: |


 ки С—Н рівноцінні. Для пояснення цього факту у квантово-механічній теорії хімічного зв'язку введено математично обгрунтоване поняття про гібридизацію атомних орбіталей.
ки С—Н рівноцінні. Для пояснення цього факту у квантово-механічній теорії хімічного зв'язку введено математично обгрунтоване поняття про гібридизацію атомних орбіталей.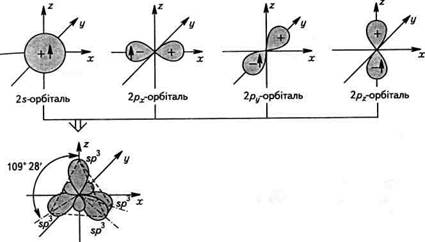
 лентні 5/?2-гібридні орбіталі, що лежать в одній площині під кутом 120°. Тому 5р2-гібридизація називається ще тригональною. Залишена негібридизованою /?г-орбіталь розташована в площині, перпендикулярній до площини гібридних орбіталей (рис. 3.2).
лентні 5/?2-гібридні орбіталі, що лежать в одній площині під кутом 120°. Тому 5р2-гібридизація називається ще тригональною. Залишена негібридизованою /?г-орбіталь розташована в площині, перпендикулярній до площини гібридних орбіталей (рис. 3.2).




