 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ПОСТУЛАТЫ БОРА И СЛЕДСТВИЯ ИЗ НИХ
Попытку устранить выше перечисленные противоречия предпринял датский физик Нильс Бор в 1913 г. Идея о квантах, высказанная Планком в применении к излучению абсолютно черного тела, была перенесена Бором на внутриатомные процессы. В основу развитой им квантовой теории строения атома Бор положил три постулата: 1. Первый постулат Бора.Существуют стационарные состояния атома. Этим стационарным состояниям соответствуют вполне определенные (стационарные) орбиты электронов. При движении по стационарным орбитам электроны не излучают и не поглощают электромагнитные волны. 2. Второй постулат Бора.При переходе электрона с внешней стационарной орбиты на внутреннюю, ближе к ядру, атом излучает квант энергии:
где En, Em – энергии электрона на соответствующих орбитах. 3. Правило квантования орбит Бора. Момент импульса электрона, находящегося на стационарной орбите, квантуется.
где n – целое число. При En > Em происходит излучение кванта (переход атома из состояния с большей энергией в состояние с меньшей энергией), при En < Em – его поглощение. Набор возможных дискретных частот n = (En-Em)/h квантовых переходов и определяет линейчатый спектр атома. Частота фотона, излучаемого при переходе из состояния n в состояние m, будет равна разности термов:
По второму постулату Бора:
Здесь n – главное квантовое число. Если n = 1, то атом находится в основном или нормальном (невозбуждённом) состоянии, при Условие стационарных орбит Бор получил, исходя из постулата Планка. Пусть электрон движется в поле атомного ядра с зарядом
Тогда из правила квантования орбит
Радиус первой боровской орбиты водородного атома называется боровским радиусом и равен: Внутренняя энергия атома складывается из кинетической энергии электрона (ядро считается неподвижным) и энергии взаимодействия электрона с ядром:
но из (5) следует:
тогда: Подставив (6), для rn получим разрешённые значения внутренней энергии атома (h =
При переходе атома водорода из состояния n в состояние m излучается фотон:
Частота излучённого света равна:
Получена обобщённая формула Бальмера. Для постоянной Ридберга получилось выражение:
Несомненным достоинством теории Бора было то, что он впервые обосновал дискретность энергетического спектра атомов, что позволило затем оценить фундаментальную роль, которую понятие энергетического спектра играет во всей физике микромира. Не имея теоретического обоснования, постулаты Бора позволили построить количественную теорию атома водорода. Основной недостаток теории Бора – использование понятий классической механики, в частности, траектории движения, при описании движения электрона в атоме. Все попытки количественного описания многоэлектронных атомов с помощью теории Бора, даже простейшего из них – атома гелия, содержащего всего два электрона, оказались неудачными. Теория Бора явилась лишь переходным этапом на пути последовательной квантово-механической теории атома.
1.5. Опытное обоснование квантовой теории строения атома. ОПЫТ ФРАНКА-ГЕРЦА
Поиск по сайту: |
 , (2)
, (2) , (3)
, (3) ,
,  .
. ,
, (4)
(4) – в возбуждённом. Знак минус показывает, что электрон связан в атоме силой притяжения к ядру, Еn – энергия связи электрона в атоме, находящемся в состоянии n. Состояние
– в возбуждённом. Знак минус показывает, что электрон связан в атоме силой притяжения к ядру, Еn – энергия связи электрона в атоме, находящемся в состоянии n. Состояние  соответствует ионизации атома – отрыву от него электрона.
соответствует ионизации атома – отрыву от него электрона. , где Z – порядковый номер атома. При Z = 1 это атом водорода, при других Z – любой атом у которого удалены все электроны кроме одного. Тогда уравнение движения электрона имеет вид:
, где Z – порядковый номер атома. При Z = 1 это атом водорода, при других Z – любой атом у которого удалены все электроны кроме одного. Тогда уравнение движения электрона имеет вид: (5)
(5) ,следует
,следует  , подставим в (5) и получим:
, подставим в (5) и получим: ,
, ,
,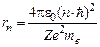 , (n = 1, 2, 3,…). (6)
, (n = 1, 2, 3,…). (6) . Боровские орбиты электрона представляют собой геометрическое место точек, в которых с наибольшей вероятностью может быть обнаружен электрон.
. Боровские орбиты электрона представляют собой геометрическое место точек, в которых с наибольшей вероятностью может быть обнаружен электрон. ,
, ,
, .
. ):
): , (n =1, 2, 3….). (7)
, (n =1, 2, 3….). (7) .
. .
.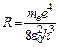 . (8)
. (8)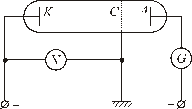 Квантовые постулаты Бора нашли экспериментальное подтверждение в опытах Джеймса Франка и Густава Герца. Идея опытов заключалась в следующем. Сквозь трубку (рис. 2), наполненную ртутными парами, пропускался поток электронов. Электроны вылетали из накалённого катода К, к аноду А, перед которым расположена сетка С. Между сеткой и катодом прикладывалась разность потенциалов j1, ускорявшая электроны, а между сеткой и анодом – разность потенциалов j2, тормозившая электроны, пролетавшие сквозь отверстие сетки (j2 < j1).
Квантовые постулаты Бора нашли экспериментальное подтверждение в опытах Джеймса Франка и Густава Герца. Идея опытов заключалась в следующем. Сквозь трубку (рис. 2), наполненную ртутными парами, пропускался поток электронов. Электроны вылетали из накалённого катода К, к аноду А, перед которым расположена сетка С. Между сеткой и катодом прикладывалась разность потенциалов j1, ускорявшая электроны, а между сеткой и анодом – разность потенциалов j2, тормозившая электроны, пролетавшие сквозь отверстие сетки (j2 < j1).
 На рис. 3 показана зависимость анодного тока от напряжения между катодом и сеткой. Из графика видно, что значения тока имеют пики, которые находятся на примерно равных расстояниях друг от друга, составляющих величину 4,9 В.
На рис. 3 показана зависимость анодного тока от напряжения между катодом и сеткой. Из графика видно, что значения тока имеют пики, которые находятся на примерно равных расстояниях друг от друга, составляющих величину 4,9 В. Такую зависимость можно объяснить с помощью постулатов Бора. Электрон передает атому лишь определенную порцию энергии, которая равна разности двух энергетических уровней атома ртути. В промежутках между пиками кинетическая энергия электронов меньше указанной порции, поэтому электроны проходят путь до анода, практически не замедляясь. С дальнейшим ростом напряжения энергия растет до того момента, пока она не достигнет значения, необходимого для перехода атома ртути с одного энергетического уровня на другой. Столкновения снова становятся неупругими, электроны отдают свою энергию атомам ртути, и им не хватает энергии для преодоления запирающего напряжения между сеткой и анодом. Анодный ток падает. Второй максимум на вольт - амперной характеристике отвечает двукратным неупругим соударениям, когда электрон успевает набрать необходимую для возбуждения атома ртути энергию после первого неупругого соударения. И так далее… Схема переходов показана на рис. 4.
Такую зависимость можно объяснить с помощью постулатов Бора. Электрон передает атому лишь определенную порцию энергии, которая равна разности двух энергетических уровней атома ртути. В промежутках между пиками кинетическая энергия электронов меньше указанной порции, поэтому электроны проходят путь до анода, практически не замедляясь. С дальнейшим ростом напряжения энергия растет до того момента, пока она не достигнет значения, необходимого для перехода атома ртути с одного энергетического уровня на другой. Столкновения снова становятся неупругими, электроны отдают свою энергию атомам ртути, и им не хватает энергии для преодоления запирающего напряжения между сеткой и анодом. Анодный ток падает. Второй максимум на вольт - амперной характеристике отвечает двукратным неупругим соударениям, когда электрон успевает набрать необходимую для возбуждения атома ртути энергию после первого неупругого соударения. И так далее… Схема переходов показана на рис. 4. Ускоряющий потенциал 4,9 В называется резонансным потенциалом атома ртути. Опыты Франка и Герца подтвердили дискретность энергетических уровней атомов.
Ускоряющий потенциал 4,9 В называется резонансным потенциалом атома ртути. Опыты Франка и Герца подтвердили дискретность энергетических уровней атомов.