 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Расчёт горения топлива
Расчет горения топлива нужен для того, чтобы правильно выбрать дутьевые и тяговые устройства к печи, обеспечивающие нормальный процесс горения, движения дымовых газов и необходимый температурный режим в рабочем пространстве печи. Этот расчет проводится с целью определения расхода воздуха, необходимого для горения, количества образующихся продуктов горения, их состава и температуры горения. В качестве топлива используется природный газ Березовского месторождения, состав которого берётся из справочника [1] с. 203. Исходный состав природного газа приведен в таблице 2.1. Таблица 2.1 – Состав сухого газа, % об.
Сумма компонентов природного газа составляет 100%. Газ сжигают с коэффициентом избытка воздуха α =1,05. Принимаем содержание влаги в газе 1%. Пересчет состава газообразного топлива с сухого на рабочую массу производится по следующим формулам:
CH4 =
где
CH4 = 92,1 ∙ (100 - 1) / 100 = 91,17 об.%; Аналогично пересчитываем остальные составляющие топлива. Результаты расчетов сводим в таблицу 2.2.
Таблица 2.2 – Рабочий состав воздуха, об.%
Теплота сгорания газообразного топлива определяется как сумма произведений тепловых эффектов составляющих газа на их количество, выраженное в объемных процентах. Для природного газа, кДж/м3:
Qнр = 358,2 ∙ СН4 + 637,5 ∙ С2Н6 + 912,5 ∙ С3Н8 + 1186,2 ∙ С4Н10 + 1460 ∙ С5Н12 , (2.2)
где Qнр – теплота сгорания 1 м3 газообразного топлива, кДж/м3.
Qнр = 358,2 ∙ 91,17 + 637,5 ∙ 3,76 + 912,5 ∙ 0,792 + 1186,2 ∙ 0,299 = 36132,8 кДж/м3.
Далее ведется расчет расхода воздуха, необходимого для горения. В расчетах принимают следующий состав воздуха по объему, %: азот - 79 и кислород - 21. Количество влаги, вносимое атмосферным воздухом, значительно увеличивает расход воздуха. При расчетах тепловых агрегатов влагосодержание атмосферного воздуха принимают 8–12,5 г/кг [1]. Теоретически необходимый для горения расход сухого воздуха определяется по следующей формуле:
L0 = 0,0476 ∙ (2 ∙ СН4 + 3,5 ∙ С2Н6 + 5 ∙ С3Н8 + 6,5 ∙ С4Н10 ), (2.3)
где L0 – теоретически необходимое количество сухого воздуха для горения 1 м3 газообразного топлива, м3/м3.
L0 = 0,0476 ∙ (2 ∙ 91,17 + 3,5 ∙ 3,76 + 5 ∙ 0,792 + 6,5 ∙ 0,299) = 9,58 м3/м3.
Определяем расход атмосферного воздуха при влагосодержание d=8 г/кг сухого воздуха (принимаем самостоятельно):
L0′ = (1 + 0,0016 ∙ d ) ∙L0, (2.4)
где L0′ – теоретическое количество атмосферного воздуха необходимое для сжигания 1м3 газообразного топлива, м3/м3.
L0′ = (1 + 0,0016 ∙ 10) ∙ 9,58 = 9,71 м3/м3.
Для практически полного сгорания топлива требуется подвод воздуха в количестве, превышающем теоретически необходимое, так как трудно достичь идеального смешения воздуха с топливом. Действительный расход сухого воздуха с учетом коэффициента расхода воздуха:
Lα = α ∙ L0, (2.5)
где Lα – действительное количество сухого воздуха необходимого для сжигания 1м3 газообразного топлива, м3/м3; α – коэффициент избытка воздуха (принимаем α = 1,2). Lα = 1,05 ∙ 9,58 = 10,05 м3/м3.
Действительный расход влажного воздуха рассчитываем по формуле: Lα′ = α ∙ L0′ , (2.6) Действительный расход влажного воздуха составит: Lα′ = (1 + 0,0016 ∙8) ∙ 10,05= 10,12 м3/м3. Определим количество и состав продуктов горения при α=1,2. Находим объём отдельных составляющих по формулам:
VCO2 = 0,01 ∙ (CO2 + СН4 + 2 ∙ С2Н6 + 3 ∙ С3Н8 + 4 ∙ С4Н10 + 5 ∙ C5H12), (2.7)
VH2O = 0,01 ∙(2 ∙СН4 + 3 ∙ С2Н6 + 4∙С3Н8 + 5∙С4Н10 + 6∙С5H12 + H2O + 0,16 ∙ d ∙Lα) , (2.8)
VN2 = 0,79 ∙ Lα + 0,01 ∙ N2 , (2.9)
VO2 = 0,21 ∙ (α–1) ∙ L0 , (2.10)
где VCO2, VH2O, VN2, VO2 , – состав продуктов горения (углекислого газа, воды, азота, кислорода соответственно) при сгорании 1 м3 газообразного топлива, м3/м3.
VCO2 = 0,01 ∙ (0,099 + 91,17 + 2 ∙ 3,76 + 3 ∙ 0,792 + 4 ∙ 0,299) = 1,023 м3/м3;
VH2O = 0,01 ∙ (2 ∙ 91,17 + 3 ∙ 3,76 + 4 ∙ 0,792 + 5 ∙ 0,299 + 1 + 0,16 ∙ 8 ∙10,05) = 2,12 м3/м3;
VN2 = 0,79 ∙ 10,0 + 0,01 ∙ 2,87 = 7,92 м3/м3;
VO2 = 0,21 ∙ (1,05 – 1) ∙ 9,58 = 0,1.
Общее количество продуктов горения составляет:
Vα = VCO2 + VH2O + VN2 + VO2 , (2.11)
Vα = 0,1 + 2,12 + 7,92 + 1,02 = 11,1 м3/м3.
Процентный состав продуктов горения определяется следующим образом, %:
СО2 = 100 / Vα ∙ VCO2 , (2.12)
СО2 = 100 / 11,1 ∙ 1,023 = 9,21 %;
H2O = 100 / 11,1 ∙ 2,18 = 19,63 %;
N2 = 100 / 11,1 ∙ 7,92 = 71,35 %;
O2 = 100 / 11,1 ∙ 0,1 = 0,90 %.
Составляем материальный баланс процесса горения на 100 м3 топлива (перевод в кг осуществляется путем умножения на плотность) по следующей форме (таблица 2.3). Таблица 2.3 – Материальный баланс процесса горения топлива
Невязка баланса составляет:
(1378,3 – 1380,3) / 1378,3 < 0,1 %
Определим теоретическую и действительную температуры горения топлива. Для этого находится общая энтальпия природного газа
где Принимаем температуру подогрева воздуха
Далее вычисляем теплосодержание с учетом потерь,
Действительная температура определяется по
Поиск по сайту: |
 ∙ (100 -
∙ (100 -  ) / 100 , (2.1)
) / 100 , (2.1) – содержание метана в рабочем и сухом газе соответственно, %;
– содержание метана в рабочем и сухом газе соответственно, %;  , кДж/м3:
, кДж/м3: , кДж/м3 (2.13)
, кДж/м3 (2.13) − теплота сгорания топлива, кДж/м3;
− теплота сгорания топлива, кДж/м3;  , – объемные изобарные теплоемкости соответственно газа и воздуха при температурах
, – объемные изобарные теплоемкости соответственно газа и воздуха при температурах 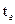 ,
,  .Lα − действительное количество атмосферного воздуха, м3/м3;
.Lα − действительное количество атмосферного воздуха, м3/м3; =400°С. Природный газ используется при температуре окружающей среды ,следует его физическая теплота в виду малости может не учитываться, то формула (2.13)примет вид:
=400°С. Природный газ используется при температуре окружающей среды ,следует его физическая теплота в виду малости может не учитываться, то формула (2.13)примет вид: ,
,

 диаграмме, которая приведена в справочнике [1] на рисунке 1.2.Для найденного значения
диаграмме, которая приведена в справочнике [1] на рисунке 1.2.Для найденного значения