|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Возможности применения редоксиметрических титрований.
Прямое редоксиметрическое титрование возможно при выполнении следующих условий: Ø Взаимодействие реагирующих веществ специфическое; Ø Реакция должна проходить стехиометрично; Ø Реакция должна проходить быстро; Ø Константа равновесия должна быть достаточно высокой; Ø Должна быть возможность применения конкретного способа фиксации точки стехиометричности (или конечной точки титрования). Окислители (восстановители) взаимодействуют с веществами, в которых определяемый элемент имеет одну или несколько степеней окисления. При этом с окислителями реагируют вещества, в которых элемент имеет низшие степени окисления, а с восстановителями – вещества, в которых этот элемент имеет высшие степени окисления. Специфичность взаимодействия достигается только при наличии одной конкретной степени окисления, которая подходит для взаимодействия соответственно с окислителем или восстановителем. Если в анализируемом объекте элемент имеет несколько степеней окисления или одну, не подходящую для Ox-Red взаимодействия, то до начала титрования его необходимо окислить или восстановить до необходимой степени окисления. Такую предварительную операцию называют предварительным окислением или восстановлением. Предварительный окислитель или восстановитель должен обеспечить количественное переведение определяемого элемента в желательную степень окисления. Предварительный окислитель или восстановитель должен быть веществом, от избытка которого перед началом титрования легко избавиться. Так, например, если предварительное восстановление осуществляется с помощью SO2, то от избытка оксида серы (IV) легко избавиться кипячением раствора. Чаще всего предварительное восстановление осуществляется с помощью таких металлов, как Zn, Al, Cd. Эти металлы восстанавливают также ионы Н3О+, в результате чего выделяется Н2. Поэтому часто их применяют в виде амальгам. В таком случае реакция между атомами металлов и ионами Н3О+ практически не проходит даже в очень кислых растворах. Для предварительного окисления обычно используют такие окислители, как Н2О2, (NH4)2S2O8, KMnО4. После проведения окисления от избытка пероксида водорода, персульфата аммония раствор освобождается кипячением. От избытка перманганат-ионов можно избавиться, восстанавливая их этанолом или кипячением с хлоридной кислотой. Окислительно-восстановительные взаимодействия могут оказаться неспецифичными вследствие хода индуцированных реакций. Так, например, при перманганатометрическом титровании солянокислого раствора ионов Fe (II) индуцируется реакция окисления хлорид-ионов. Перманганат-ионы суммарно взаимодействуют не только с ионами железа, но также с хлорид-ионами, и результаты определений получаются завышенными. Для получения правильных результатов в титрованный раствор следует добавить ионы Mn (ІІ), которые взаимодействуют с Mn (III, IV) быстрее, чем Cl--ионы, и потому устраняют протекание индуцированной реакции. Окислительно-восстановительные реакции не всегда проходят стехиометрично. В таких случаях применяют титрование заместителя. Например, растворы большинства сильных окислителей непосредственно нельзя титровать раствором тиосульфата натрия, так как тиосульфат-ионы при этом окисляются до S4O62-, SO42- и других ионов. Поэтому к раствору окислителя прибавляют в избытке раствор йодида калия: Cl2 + 2I- = I2 + 2Cl-; ClO- + 2I- + 2H3O+ = I2 + Cl- + 3H2O; BrO3- + 6I- + 6H3O+ = 3I2 + Br- + 9H2O; H2 O2 + 2I- + 2H3O+ = I2 + 4H2O; Cr2O72- + 6I- + 14H3O+ = 3I2 + 2Cr3+ + 21H2O и т.д. Йод, который образовался (заместитель) потом оттитровывают раствором натрий тиосульфата: I2 + 2S2O32- = 2I- + S4O62-. Большинство редоксреакций протекают очень медленно. В таких случаях применяют обратное титрование. Так оксиды MnО2, PbО2, Pb3O4 медленно реагируют с оксалатной кислотой, например: MnО2 + H2C2O4 + 3H3O+ = Mn2+ + 2CO2 + 4H2O. Определение этих веществ осуществляется добавлением оксалатной кислоты в избытке, а потом избыток оттитровывают раствором калия перманганата: 5H2C2O4 + 2MnО4- + 6H3O+ → 2Mn2+ +10CO2 + 14H2O. Константа равновесия редоксреакции определяется разностью реальных стандартных потенциалов:
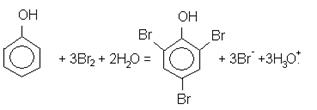
Необходимое значение этой разности, в свою очередь, при величине ошибки не больше ± 0,1 %: ΔЕО, Р ≥ 0,24 В, а при величине ошибки до ± 0,01 %: ΔЕО, Р ≥ 0,35 В. Если же число электронов, которыми обмениваются восстановленная и окисленная формы редоксипары, если n>1, то переход электронов может происходить ступенчато, что равноцено одновременному присутствию нескольких редоксипар. Измеренный потенциал предопределяется наличием всех этих редоксипар и не может быть рассчитан применением уравнения Нернста к одной из этих пар. Потенциал, который возникает при этом, называют смешанным. Если возникают смешанные потенциалы, то теоретически предусмотреть возможность проведения титрования, конечно, невозможно, ее следует проверить экспериментально. Так, например, титрование раствором перманганата калия целиком пригодно для количественного определения ионов Fe (ІІ), хотя кривая титрования не совпадает с теоретической кривой. Для увеличения разности реальных стандартных потенциалов иногда используют реакцию осаждения. Редоксиметрию успешно можно использовать для определения органических веществ. Цериметрическим титрованием определяют такие соединения, как глицерин, глюкозу, сахарозу, ацетилацетон, тартратную, цитратную, яблочную кислоты и др. Для этого к хлорнокислому раствору определяемого вещества прибавляют в избытке хлорнокислый раствор Се (IV) и выдерживают при повышенной температуре. Органические вещества окисляются до формиатной кислоты и диоксида карбона. Потом избыток Се (IV) оттитровывают раствором ионов Fe (II). При броматометорическом определении органических веществ используют взаимодействие бромат- и бромид-ионов, в результате которого выделяется бром: BrО3- + 5Br- + 6H3O+ = 3Br2↓ + 9H2О.
Бром, который выделился, реагирует с органическими веществами. Например, с фенолом реагирует три молекулы брома: С молекулой 8-хинолинолинола (8-оксихинолин) реагирует две молекулы брома:
Для количественного бромирования органических веществ необходимо 10-30 минут. Поэтому к исследуемому раствору прибавляют бромат-бромидную смесь в избытке и через определенный промежуток времени, необходимый для бромирования избыток брома определяют йодометрически. Следует отметить, что 8-хинолинол образует малорастворимые комплексы со многими ионами металлов. Эти комплексы могут быть использованы для определения металлов-комплексообразователей. Для этого осадки комплексов отфильтровывают, промывают, растворяют в кислоте и в полученном растворе броматометрически определяют 8-хинолинол. Зная состав комплекса по количеству 8-хинолинола рассчитывают стехиометрическое количество ионов-комплексообразователя. Органические нитро- и азосоединения могут быть определены титанометрическим или хромометрическим титрованием, например: R-NO2 + 6TiOH2+ → R-NH2 + 6Ti2+ + 2H2O; R-N=N-R′ + 4Cr2+ + 4H3O+ → R-NH2 + R′-NH2 + 4Cr3+ +4H2O. При определении азосоединений индикатор не нужен, так как скачок кривой титрования можно найти по исчезновению интенсивной окраски, которая присуща этим соединениям. Титанометрию широко используют также для определения органических красителей – индиго, фуксина, метиленовой сини, малахитового зеленого, эозина, родаминов и других веществ, которые во время титрования переходят в бесцветные соединения.
Поиск по сайту: |