 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Визначення швидкості переміщення межі колоїдний розчин – дисперсійне середовище ⇐ ПредыдущаяСтр 2 из 2
По шкалі відмічають положення межі розділу в обох колінах U –подібної трубки, включають струм ( у присутності викладача) та відмічають час початку досліду. Спостерігаючи за переміщенням межі, визначають знак заряду колоїдних частинок. Відліки положення рівнів у колінах трубки слід робити кожні п’ять хвилин. Дослід ведуть протягом 20хвилин. У кожному досліді відмічають різність потенціалів та вимірюють відстань між електродами. Якщо межа розділу у одному з колін приладу занадто розмивається, то відлік слід вести по положенню границі у другому коліні і по ньому визначати зміщення межі. Слід пам’ятати також, що при додаванні електроліту з багатовалентним іоном може відбутися перезарядка колоїдної частинки. Після закінчення першого досліду прилад відключають від джерела струму. Електроди виймають із U-подібної трубки. Прилад звільнюють від розчину, промивають дистильованою водою і заповнюють наступною порцією золю з електролітом, як описано в пункті 5.2.2, включають струм і ведуть спостереження, як у першому досліді. Дослід повторюють з третім зразком і відповідною концентрацією електроліту. Результати досліду записують у таблицю 1.
Таблиця 5.1 - Дослідні дані з електрофорезу
5.3 Обробка результатів вимірювання
Для розрахунку електрокінетичного потенціалу використовують рівняння (5.1). Для водних золів εвідн. = 81; h = 1 × 10-3 Па ·с; ε0 = 8,85· 10 –12 Ф/м.
Напруженість електричного поля дорівнює:
Е = V/L (5.3) де: V – різниця потенціалів на електродах, В; L – відстань між електродами, м; L = l1 + l2 + l3 (див. рис. 1)
Лінійна швидкість руху частинок (або межі розділу золь-дисперсійне середовище). U = Δ hсер./ τ (5.4) де: Δ hсер – середнє зміщення межі, м; τ – час, за який відбувається зміщення межі, с;
Підставивши (3) і (4) у рівняння (1), отримуємо розрахункову формулу: ζ = η ·Δhcp · L/(τ εвідн. ε0 · V) (5.5)
За вирахуваними значеннями електрокінетичного потенціалу ζ будують графік, залежності ζ – потенціалу від концентрації електроліту. У звіті необхідно привести рівняння реакцій, які приводять до утворення важкорозчинних сполучень і записати формулу міцели досліджуваного золю. При цьому слід базуватися на експериментально встановлений знак заряду колоїдної частинки.
Контрольні питання
1 Укажіть можливі причини виникнення подвійного електричного шару (ПЕШ) на міжфазній поверхні. Наведіть приклади. 2 Дайте характеристику ПЕШ. Як змінюється потенціал з відстанню від поверхні? 3 Перечисліть електрокінетичні явища та поясніть, чим вони обумовлені. Вкажіть практичне застосування цих явищ. 4 Поясніть поняття “електрокінетичний потенціал”. Які чинники впливають на величину ζ – потенціалу? Покажіть, як буде мінятися ζ – потенціал негативно заряджених часток гідрозолю при додаванні нітратів калію, барію, лантану? 5 Що таке перезарядка колоїдної частинки? Які причини можуть приводити до перезарядки? 6 Поясніть, як пов’язана агрегативна стійкість колоїдного розчину з величиною ζ – потенціалу? 7 Вирішіть задачу.
Література
1 Фролов Ю.Г Курс коллоидной химии.- М.:Химия,1989,с.256-270 2 Лабораторные работы и задачи по коллоидной химии. – Под ред. Ю.Г. Фролова.-М.:Химия.1986, с.93-95.
Лабораторна робота 6 Синтез гідрозолю гідроксиду заліза, вивчення його коагуляції та стабілізації.
Ціль роботи: - отримати гідрозоль гідроксиду заліза конденсаційним методом; - визначити поріг електролітної коагуляції золю та вивчити залежність його від заряду іону, який її викликає; - визначити захисне число стабілізатора (високомолекулярної сполуки).
6.1 Обґрунтування запропонованої методики експерименту
Агрегативну стійкість золю гідроксиду заліза забезпечує перед усе наявність на поверхні дисперсних частинок подвійних електричних шарів. Поверхня агрегату може заряджатися завдяки вибірковій адсорбції іонів із дисперсійного середовища або дисоціації молекул в поверхневому шарі агрегату. У відповідності з правилом Пєскова-Фаянса адсорбуються переважно іони, які входять до складу агрегату, або специфічно взаємодіють з ним. Ці іони надають агрегату поверхневий заряд і називаються потенціалвизначаючими. Полімолекулярний агрегат разом з потеціалвизначаючими іонами утворюють ядро міцели [Fe(OH)3]m·nFe3+ , яке має позитивний поверхневий заряд за рахунок адсорбції іонів nFe3+ із середовища (n – кількість адсорбованих іонів). Заряд ядра компенсується еквівалентним зарядом протилежно заряджених іонів – протиіонів , які знаходяться в об’ємі середовища. Протиіони, які знаходяться у безпосередній близькості від поверхні ядра (на відстанях, близьких до діаметрів іонів), крім електростатичних сил зазнають дію сил адсорбційного притягання поверхні. Тому вони відносно міцно зв’язані з ядром міцели і утворюють адсорбційний шар ( їх кількість складає 3(n-x)). Решта протиіонів (їх число становить 3х) утворює дифузно побудовану зовнішню іонну оболонку, яку називають дифузною частиною подвійного електричного шару (ПЕШ). Товща адсорбційного шару δ мала (δ<1нм) і постійна. Товща дифузного шару λ значно більша (може бути > 10 нм) і залежить від концентрації електролітів у дисперсній системі. При високих концентраціях електролітів або при введені багатозарядних іонів товща дифузного шару λ мала і прагне до нуля. Частинка стає електронейтральною. В цьому випадку протиіони адсорбційного шару повністю компенсують поверхневий заряд ядра, внаслідок чого колоїдна частинка переходить в ізоелектричний стан, який часто супроводжується втратою агрегатної стійкості системи. Агрегативна стійкість дисперсних систем визначається балансом енергії притягання та енергії відштовхування частинок. Енергія притягання зумовлена міжмолекулярними силами, головним чином силами Ван-дер-Ваальса. У першому наближенні ця енергія зворотно пропорціональна квадрату відстані між частинками. За теорією ДЛФО (Дерягіна, Ландау, Фервея, Овербека), енергія відштовхування зменшується з відстанню за експоненціальним законом. Для області малих електричних потенціалів сумарна енергія взаємодії сферичних частинок, які не проводять електричний струм може бути описана рівнянням: U (h) = 2 ε ε0 χ φ2 e-χh –A*/(12π h2) (6.1) де ε – відносна діелектрична проникність дисперсійного середовища; ε0 – електрична стала вакууму; φ – електричний потенціал дифузного шару; χ – величина, зворотна товщі дифузійного шару; А* – константа міжмолекулярної взаємодії; h – відстань між частинками. Сумарна потенціальна енергія взаємодії часток негативна на близьких та відносно далеких відстанях (переважає енергія притягання). Потенціальна енергія може бути позитивна на середніх відстанях (переважає енергія відштовхування). Максимум на потенціальній кривій (рисунку 6.1) відповідає потенціальному бар’єру.
DU h
II
I
Рисунок 6.1 - Потенціальна енергія взаємодії частинок Перший мінімум 1 відповідає безпосередньому стиканню частинок, а другий II – притяганню частинок, між якими є прошарки дисперсійного середовища. Коагуляція ліофобних дисперсних систем може відбуватися внаслідок дії різних зовнішніх чинників, наприклад, при механічних впливах (ультразвук), дії електричного поля, при нагріванні або заморожуванні системи. Коагуляція ліофобних золів може відбуватися також за рахунок сильного розбавлення або концентрування. Найчастіше коагуляція дисперсних систем відбувається при додаванні електролітів. Додавання електролітів знижує висоту потенційного бар’єру (див. рисунок 6.1). При невеликих концентраціях електроліту енергетичний бар’єр залишається, і коагуляція частинок не відбувається. Агрегація наступає при додаванні деякої кількості електроліту, відповідної порогу коагуляції для даної системи. Поріг швидкої коагуляції СК визначається кількістю електроліту, яка необхідна для коагуляції одиниці об’єму колоїдної системи при повному зникненні потенціального бар’єру. При збереженні невеликого потенціального бар’єру у системі протікає повільна коагуляція. При коагуляції, яка відбувається за концентраційним механізмом, (для сильно заряджених частинок) поріг коагуляції СК згідно з теорією Дерягіна-Ландау (яка обґрунтовує емпіричне правило Шульце-Гарді) зворотно пропорційний заряду z коагулюючого іона у шостій степені, тобто:
СК = const/z6 (6.2)
У процесі коагуляції високодисперсного золю гідроксиду заліза утворюється порівняно невеликі за розмірами седиментаційно стійкі агрегати. Тому дослідження коагуляції частинок Fe(OH)3 зручно проводити за допомогою турбідиметричного методу на приладі КФК-2. Застосування цього методу засновується на залежності світлорозсіювання від розмірів частинок (див. стор. 22) . При коагуляції частинок воно збільшується, відповідно збільшується оптична густина золю. Оскільки при проходженні світлового потоку через зафарблені золі деяка частка світла розсіюється, а частка поглинається, то при вивченні коагуляції методом турбідиметрії необхідно виключати поглинання світла. Щодо золю Fe(OH)3 цього можна досягнути завдяки червоному світлофільтру, тобто проводячи виміри при довжині хвилі падаючого світла λ = 670 нм. Опис приладу КФК-2 та методика вимірювання оптичної густини дані в лабораторній роботі №2 “Визначення розмірів частинок дисперсних систем турбідиметричним методом”. Поріг швидкої коагуляції знаходять за пороговим (критичним) об’ємом електроліту VК (см3), при якому оптична густина золю досягає максимального значення, а при подальшому додаванні електроліту не змінюється . Значення cК розраховують за формулою: сК = де: сел. – концентрація введеного електроліту, моль/л; V – об’єм золю, см3 .
Для запобігання агрегації частинок та захисту гідрозолів і гідросуспензій від дії електроліту використовують високомолекулярні сполуки та колоїдні поверхнево-активні речовини (ПАР), розчинні у воді, наприклад білки, мила, крохмаль, декстрин. Їх стабілізуюча дія заснована на утворенні на поверхні частинок дисперсної фази адсорбційних желеподібних плівок і пов’язана як зі зменшенням міжфазного натягу, так із структурно-механічними властивостями поверхневих шарів. Захисна здібність полімерів або ПАР відносно вибраного золю характеризується захисним числом S – кількістю речовини, яка потрібна для стабілізації одиниці об’єму золю. Захисне число S, як і поріг коагуляції сК, визначається методом турбодіметрії. Захисне число S (г/л золі) визначають за рівнянням:
S = де: сст.- концентрація розчину стабілізатору, г/л; V – об’єм розчину стабілізатору, необхідний для запобігання коагуляції, см3.
6.2 Виконання роботи
Для виконання роботи потрібні: 2%-ний розчин FeCI3; 2 комплекта пробірок; бюретка для дистильованої води; розчини Na2SO4 та СН3СООNa; розчин желатину; колба місткістю 250 см3 Гідрозоль гідроксиду заліза отримують методом хімічної конденсації за допомогою реакції гідролізу хлориду заліза при температурі 1000С:
FeCI3 + 3H2O → Fe(OH)3 + HCI
Реакція гідролізу FeCI3 проходить інтенсивно з утворенням високодисперсних нерозчинних у воді частинок Fe(OH)3. Для одержання гідрозолю Fe(OH)3 у колбу з 250 см3 дистильованої води, яка кипить, наливають 10 см3 2%-ного розчину хлориду заліза. Отримають золь червоно-коричневого кольору, який охолоджують до кімнатної температури. Далі досліджують коагуляцію золю гідроксиду заліза при додаванні до нього розчинів сульфату натрію або ацетату натрію шляхом виміру оптичної густини отриманих систем. У 10 пробірок наливають по 10 см3 золю, воду та електроліт (розчин Na2SO4 або СН3СООNa) у таких об’ємах:
Електроліт додають у кожну пробу золю за 2-4 хвилини перед тим, як вимірювати його оптичну густину. Вимірюють оптичну густину золю у кожній колбі за допомогою фотоелектроколориметру з використанням світлофільтру № 8 або № 9. Отримані дані заносять у таблицю 6.1.
Таблиця 6.1- Результати дослідження коагуляції золю
Для визначення захисного числа полімеру (желатину) відносно золю Fe(OH)3 готують 10 проб: у пробірки наливають золь і розчини в таких об’ємах та послідовності:
Як і при вивченні коагуляції загальний об’єм проб повинен бути однаковим і становити 20 см3. Електроліт-коагулятор додають через 10-15 хвилин після введення желатину (для адсорбції желатину на частинках золю). Оптичну густину золю виміряють через 3-5 хвилин після введення електроліту. Значення оптичної густини записують у таблицю 6.2.
Таблиця 6.2 - Результати визначення захисного числа
6.3 Обробка результатів вимірювань
6.3.1 За результатами вимірювань будують графік залежності оптичної густини від об’єму електроліту Na2SO4 або СН3СООNa. Графік використовують для визначення об’єму електроліту VК, який викликає швидку коагуляцію золю. Об’єм еоектроліту – коагулянту визначають за оптичною густиною, при якій подальше додавання електроліту не викликає її подальшого збільшення. За формулою (6.3) розраховують значення сК.
6.3.2 Будують графік залежності оптичної густини від об’єму стабілізатора D = f(Vcт). Знаходять об’єм розчину желатину Vзах., необхідний для запобігання коагуляції золю, і за формулою (6.4) розраховують захисне число S.
Контрольні питання.
1 Що таке агрегативна стійкість золів? 2 Як впливає температура на агрегативну стійкість золів? 3 Які причини викликають втрату агрегативної стійкості? 4 Як запобігти втраті агрегативної стійкості? 5 Чім повільна коагуляція відрізняється від швидкої?
Література
1Фролов Ю.Г Курс коллоидной химии.- М.:Химия,1989,с.372-392. 2Лабораторные работы и задачи по коллоидной химии.-Под ред. Ю.Г. Фролова.-М.:Химия.1986,с159-166.
Лабораторна робота 7 Вивчення процесу набухання твердих полімерів
Ціль роботи: - побудувати кінетичну криву процесу набухання полімеру; - визначити константу швидкості набухання полімер.
7.1 Обґрунтування запропонованої методики експерименту
Розчиненню високомолекулярних сполук /ВМС/ з лінійними молекулами передує набухання. Причиною набухання є те, що швидкість дифузії молекул розчинника значно переважає швидкість дифузії молекул полімеру. Набухання, яке самодовільно переходить у розчинення, і при цьому утворюються однофазна гомогенна система, називається необмеженим, а коли набухла речовина остається у вигляді гелю – обмеженим. Набухання полімеру в розчині кількісно характеризується ступенем набухання, який визначається за рівнянням:
де w0 – наважка зразка полімеру до набухання; w - наважка зразка набухлого полімеру. Тобто ступінь набухання чисельно дорівнює масі рідини, поглиненої одиницею маси ВМС.
Визначивши ступінь набухання через певні проміжки часу, можна побудувати криві, які характеризують кінетику набухання. Швидкість набухання описується рівнянням: dα/dt = k (α де: k – костанта швидкості набухання , яка залежить від природи полімеру та розчинника; α – ступінь набухання; α
Це рівняння показує, що кінетика набухання підчиняються кінетичному рівнянню першого порядку, оскільки швидкість набухання визначається швидкістю процесу дифузії розчину у полімер. Інтегрування цього рівняння дозволяє визначити константу швидкості набухання:
Рівняння (7.2) можна вирішити і графічно. Для цього будують залежність ступеню набухання від часу (рисунок 1) і графічним диференціюванням визначають швидкість набухання (dα/dt) у різні моменти часу: у декількох точках проводять дотичні до кривої α=ƒ(t) та визначають тангенси кутів нахилу дотичної до осі t. Перетворивши рівняння (7.2) на α = α та побудувавши залежність α = ƒ(dα/dt), (рисунок 2). Визначають константи кінетичного рівняння. Як випливає з рівняння (7.4) α dα/dt = 0, а k · α Таким чином константу швидкості набухання можна визначити за співвідношенням відрізків, які відтинаються на осях координат (рисунок 7. 2) k = ОД/ОВ.
Рисунок 7.1Кінетична крива набухання
Рисунок 7.2 Визначення константи швидкості набухання
7.2 Виконання роботи
Для виконання роботи потрібні: зразок висушеного желатину; аналітичні терези; бюкс; фільтрувальний папір.
Зразок масою приблизно1г зважують на аналітичних терезах у бюксі з кришкою. Потім поміщають його у склянку та заливають дистильованою водою (100см3). Через 7 хвилин зразок виймають з склянки, фільтрувальним папером знімають вологу і знову зважують у бюксі. По різниці знаходять приріст ваги і розраховують ступінь набухання. Зразок знову занурюють у воду для набухання. Виконують 6-7 зважувань через кожні 7 хвилин. Отримані дані заносять у таблицю 7.1.
Таблиця 7.1 - Результати дослідження кінетики набухання
7.3 Обробка результатів вимірювань
На підставі отриманих результатів дослідження будують кінетичну криву набухання. У 5 – 6 точках проводять дотичні до кінетичної кривої і визначають тангенси кутів нахилу дотичних, тобто швидкості набухання у різні моменту часу. Будують залежність ступеню набухання від швидкості. Визначають відрізки ОД і ОВ та вираховують їх співвідношення.
Контрольні питання
1 Яка причина граничного набухання ВМС? 2 Від чого залежить ступінь набухання ВМС? 3 Що таке контракція і які її причини? 4 Чім відрізняється розчини ВМС від колоїдних розчини? 5Чім схожі розчини ВМС і колоїдні розчини?
Література
1. Фролов Ю.Г Курс коллоидной химии. – М.:Химия,1989,с.351-367. 2. Практикум по коллоидной химии и электронной микроскопии / Под ред. Воюцкого С. С.М.:Химия,1974,с.151-156. Додаток А
Додаток Б
Навчальне видання
Поиск по сайту: |





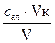 (6.3)
(6.3)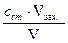 (6.4)
(6.4) (7.1)
(7.1) - α) (7.2)
- α) (7.2) (7.3)
(7.3)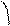

 a
a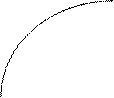 j
j
 t
t α
α B
B O D dα/dt
O D dα/dt