 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Порядок виконання роботи. ТА ДИСПЕРСНІ СИСТЕМИСтр 1 из 2Следующая ⇒
ПОВЕРХНЕВІ ЯВИЩА ТА ДИСПЕРСНІ СИСТЕМИ
ЛАБОРАТОРНІ РОБОТИ
Поверхневі явища та дисперсні системи. Лабораторні роботи (для студентів напряму 6.051301 Хімічна технологія)/ Укладач Семененко С.В. – Рубіжне: ІХТ СНУ ім. В.Даля, 2009. – 45с.
Призначені для студентів напряму 6.051301 Хімічна технологія. Містить методичні вказівки щодо практичного виконання лабораторних робіт, форми представлення експериментальних даних, методики обробки результатів експерименту, вказівки з техніки безпеки, контрольні питання.
Розглянуто на засіданні кафедри ЗХД Протокол № 8 від « 30 » 03 2009р.
Схвалено методичною радою ІХТ СНУ ім. В.Даля Протокол №від «» 2009р.
Зміст
1 Загальні відомості
1.1 Ціль лабораторного практикуму
Ціль лабораторного практикуму з колоїдної хімії полягає у ознайомленні з найважливішими властивостями дисперсних систем, а також з колоїдно-хімічними основами очистки промислових викидів та скидів, у надбанні студентами навичок експериментальної роботи: уміння планувати послідовність дій при виконанні експерименту, правильно здійснювати вимірювання, фіксувати результати вимірювань згідно до вимог до оформлення результатів експерименту, уміння обробляти результати вимірювань, користуючись аналітичними та графічними методами, робити висновки, щодо отриманих результатів експериментів. Лабораторний практикум складається з підготовки до лабораторної роботи, отримання допуску, безпосереднього виконання лабораторної роботи, обробки результатів, захисту звіту про лабораторну роботу.
1.2 Отримання допуску до виконання лабораторної роботи
Для виконання кожної лабораторної роботи студент повинен отримати допуск за позитивними результатами тестування або співбесіди з викладачем з таких питань: - ціль експерименту; - теоретичні засади досліду (закон, рівняння); - параметри, які визначають в ході експерименту, метод, який використовується для вимірювання; - обладнання, прилад, який буде використовуватися; - план виконання експерименту з урахуванням заходів з техніки безпеки (письмово); - інформація, яка буде зафіксована під час виконання експерименту в лабораторному журналі і її форма (таблиці); - метод обробки результатів вимірювань, які будуть отримані (графічний, аналітичний). Під час співбесіди студент має користуватись особистим лабораторним журналом (у звичайному зошиті) з титульним листом відповідно до додатку А. Відмітку про допуск викладач реєструє відповідно до додатку Б на початку звіту про лабораторну роботу.
1.3 Виконання лабораторної роботи
Студент має право приступити до виконання лабораторної роботи лише після отримання допуску. Під час виконання експерименту результати вимірювань студент повинен одразу фіксувати у особистому лабораторному журналі у відповідних таблицях. Якщо студент порушує правила техніки безпеки при роботі в навчальній хімічній лабораторії, він відсторонюється від виконання роботи і для продовження лабораторного практикуму повинен пройти повторний інструктаж з техніки безпеки. Після завершення роботи в лабораторії студент зобов’язаний здати робоче місце викладачу (або інженеру кафедри, який відповідає за навчальну лабораторію). Робоче місце і посуд мають бути чистими, прилади непошкодженими.
1.4 Обробка результатів та оформлення звіту
Обробку отриманих результатів вимірювань студент виконує самостійно і фіксує її у звіті про лабораторну роботу. Рівняння повинні бути наведені у загальному вигляді та з підставленими даними. Результати досліджень і розрахунків повинні бути зведені у відповідній таблиці. На підставі цих даних студент виконує розрахунок похибок. Графіки повинні виконуватися на міліметровому папері. На ось ординат наноситься функція, на ось абсцис – аргумент. Осі повинні мати позначки величин та назву одиниць вимірювання. На осі наноситься десятинна шкала згідно масштабу. При розмітці осей слід використовувати не дослідні, а округлені та рівновіддалені значення Х та У в межах експерименту. Крива повинна займати приблизно усе поле креслення. Координати експериментальних точок наносять вельми тоненько і обводять кружком, квадратиком чи трикутником або помічають хрестиком. За експериментальними точками проводять усереднюючи криву. Точки, які випали, не використовуються, але показуються. На аркуші, де виконаний графік, повинно бути позначено: назва графіка, об’єкт дослідження, номер роботи, прізвище студента. Наприкінці звіту слід зробити висновок з аналізом отриманих результатів відповідно до рекомендацій, які надано до лабораторної роботи. Форма звіту наведена у додатку Б.
1.5 Захист звіту
Захист повністю оформленого звіту про кожну лабораторну роботу здійснюється у формі співбесіди (або письмово) за наступними пунктами: - яким саме чином була здійснена ціль, поставлена у лабораторній роботі; - оцінка точності отриманих результатів; В умовах виконання лабораторного практикуму на початку семестру захист кожної лабораторної роботи є результатом поточного контролю рівня засвоєння студентом навчального матеріалу дисципліни. Захист лабораторних робіт проводиться під час лабораторних занять за розкладом.
1.6 Техніка безпеки під час виконання лабораторних робіт
Студент допускається до роботи в навчальній хімічній лабораторії лише після проходження інструктажу з техніки безпеки. Нижче наведені основні положення з техніки безпеки при виконанні лабораторних робіт з колоїдної хімії, які передбачені робочою навчальною програмою. 1.6.1 Користуватися лише хімічним посудом, застосовувати штативи. Посуд перед застосуванням промивати дистильованою водою. 1.6.2 Запобігати попаданню реактивів на шкіру та сльозову оболонку. В разі попадання розчину кислоти промити спочатку великою кількістю проточної водопровідної води, а потім розчином соди; при попаданні розчину луги – після промивання водою обробити розчином борної кислоти. В разі опіку шкіри обробити розчином перманганату калію. 1.6.3 Бути обережним при роботі зі склом. У випадку, коли скляний посуд розбився, збирати осколки за допомогою ганчірки, віника та совка. 1.6.4 Для візуального спостереження посуд (піпетку, бюретку) слід держати перед собою на рівні очей. 1.6.5 Відбирати розчини із склянок чистими сухими піпетками. Не повертати у склянки невикористаний надлишок розчину. 1.6.6 При відборі невеликої кількості отрутної рідини слід користуватися піпеткою з гумовою грушею 1.6.7 Роботу з леткими рідинами проводять тільки у витяжній шафі; голову слід тримати поза витяжною шафою. 1.6.8 Під час роботи з електричними приладами не торкатись електричних проводів, ламп, не заглядати під кожухи приладів. В разі необхідності вмикати та вимикати прилади з розетки, тримаючи виделку (а не шнура). 1.6.9 Під час роботи з оптичними приладами обережно поводитись з кюветами, оберігати прилад від ударів та попадання води. Для видалення вологи з поверхні кювет та призм рефрактометру слід обережно промокнути фільтрувальним папером (не терти). 1.6.10 Не класти та не ставити на прилади посуд, зошити, папір, тощо. 1.6.11 В разі будь-яких сумнівів щодо нормальної роботи приладів негайно зупинити роботу і повідомити викладача або інженера кафедри, якій відповідає за навчальну лабораторію.
1.7 Література, рекомендована для підготовки до лабораторних занять
1 Фролов Ю.Г Курс коллоидной химии. - М.: Химия, 1989, 320с. 2 Гомонай В.І. г-64 Фізична та колоїдна хімія: Підручник. – Вінниця: НАВА Книга, 2007. – 496с. 3 Лабораторные работы и задачи по коллоидной химии / Под ред. Ю.Г. Фролова, А.С. Гродского.-М.: Химия, 1986.-216 с. 4 Практикум по коллоидной химии и электронной микроскопии / Под ред. Воюцкого С. С.М.:Химия,1974,- 223с.
Лабораторна робота 1 Отримання колоїдних розчинів
Ціль роботи: - отримати колоїдні розчини різними методами, надати опис зовнішніх властивостей, привести будову міцели.
1.1 Обґрунтування запропонованої методики
Існують два способи отримання ліофобних систем: конденсаційний і диспергаційний. Загальним для них є виділення нової фази внаслідок пересичення середовища відносно фази, яка утворюється, та наявність стабілізатора. Конденсаційний спосіб полягає в утворенні нової фази з молекулярно диспергованої речовини. Відрізняють конденсацію хімічну та фізичну. При хімічній конденсації нова фаза виникає внаслідок перебігу хімічної реакції з утворенням малорозчинної речовини. Наприклад: AgNO3 + KI → AgI↓ + KNO3 Тут деяка кількість (m) молекул AgI складає так званий полімолекулярний агрегат. Для отримання агрегативно стійкого колоїду беруть невеликий надлишок одного із вихідних електролітів, в даному випадку КІ (стабілізатор). Згідно з правилом Фаянса-Панета на поверхні полімолекулярного агрегату адсорбуються і входять у склад ядра в першу чергу ті іони, які можуть добудувати кришталеву решітку твердої фази, або ізоморфні іони. В прикладі, наведеному вище, на поверхні ядра будуть адсорбуватися іони йоду (у деякій кількості - n іонів), які називають потенціалвизначаючими. Полімолекулярний агрегат разом з потенціалвизначаючими іонами створюють ядро міцели. Потенціалвизначаючі іони за рахунок електростатичної взаємодії притягують протиіони (іони калію) до ядра, створюючи внутрішню частину подвійного електричного шару (ПЕШ); інша частина цих іонів (х) за рахунок теплового руху розташовується на деякій відстані від ядра у рідині (дифузна частина ПЕШ) [ (m AgI) n I- (n-x) K+] xK+
ядро
частинка
міцела Ядро з потенціалвизначаючими іонами і зв’язаними протиіонами складають власне частинку, а частинка разом з дифузійно розташованими протиіонами – міцелу. Міцела завжди електронейтральна, а частинка – заряджена. Фізичну кнденсацію можна здійснити двома засобами: прямою конденсацією з пари за умови зниження температури та заміною розчинника. Пептизацію можна використовувати для перетворення осадів, первинні частинки яких мають колоїдні розміри, на колоїдний розчин.
1.2 Виконання роботи насичений розчин FeCI3
Для виконання роботи потрібні:
20%-ний розчин К4 [ Fe(CN)6] 1,7%-ний розчин AgNO3 1,7%-ний розчин КІ 1,5%-ний розчин КМnO4 1%- ний розчин Na2S2O3 10%- ний розчин CuSO4 1%- ний розчин каніфолю у етиловому спирті насичений (без нагріву) розчин сірки у етиловому спирті концентрований розчин аміаку бензол або соняшникове масло 10%- ний розчин олеату натрію
1.2.1 Отримання золів методом хімічної конденсації
1.2.1.1 Золь гідроксиду заліза (ІІІ). До 100 см3 води, яка кипить, добавляють 3-4 краплі насиченого розчину FeCI3. При цьому енергійно протікає гідроліз хлорного заліза, появляються молекули гідроксиду заліза, які конденсуються в колоїдні частки. Отриманий золь гідроксиду заліза має вишнево-червоний колір.
1.2.1.2 Золь гексаціаноферату (ІІ) заліза. 0,25 см3 20%-ного розчину К4 [ Fe(CN)6] розводять водою до 50 см3. До одержаного розчину додають при перемішуванні 1-2 краплі насиченого розчину FeCl3. Утворюється прозорий золь гексаціаноферату (ІІ) заліза синього кольору.
1.2.1.3 Золь йодиду срібла. 0,5 см3 1,7%-ного розчину AgNO3 розводять водою до 50 см3. До одержаного розчину AgNO3 додають краплями при перемішуванні 0,5 см3 1,7%-ного розчину КІ. Створюється голубуватий опалесцюючий золь йодиду срібла.
1.2.1.4 Золь йодиду срібла. 5 см3 1,7%-ного розчину КІ розводять до 50 см3 водою і до розведеного розчину добавляють при розмішуванні 0,5 см3 1,7%-ного розчину AgNO3. Створюється голубуватий опалесцюючий золь йодиду срібла.
1.2.1.5 Золь діоксиду марганцю. Сіль марганцю відновлюють тіосульфатом, для чого 5 см3 1,5%-ного розчину КМnO4 розводять водою до об’єму 50 см3. В цей розчин вводять по краплям 1-2 см3 1%-ного розчину Na2S2O3. Створюється вишнево-червоний золь діоксиду марганцю.
1.2.1.6 Золь гексаціаноферату (ІІ) міді. 0,25 см3 20%-ного розчину К4[Fe(CN)6] розводять до 50 см3 водою. В цей розчин прибавляють 1-2 краплі 10%-ного розчину CuSO4 при розмішуванні. Створюється золь гексаціаноферату (ІІ) міді червоно-бурого кольору.
1.2.2 Отримання золів методом фізичної конденсації
1.2.2.1Золь каніфолю. До 50 см3 води додають 10-15 крапель 1%-ного розчину каніфолю у етиловому спирті. Утворюється золь каніфолю у воді з негативно зарядженими колоїдними частками.
1.2.2.2 Золь сірки. До 50 см3 води додають при розмішуванні 1-2 см3 насиченого (без нагріву) розчину сірки у етиловому спирті (із крапельниці). Створюється голубуватий опалесцюючий золь сірки з негативно зарядженими колоїдними частками.
1.2.3 Отримання золів методом пептизації.
1.2.3.1 Золь гексаціаноферату (ІІІ) заліза . До 10-15 см3 20%-ного розчину гексаціаноферату (ІІІ) калію додають 2-3 краплі насиченого розчину хлориду заліза (ІІІ). На дно опадає темно-синій осад гексаціаноферату (ІІІ) заліза, який швидко переходить в стан гелю. Рідину, яка знаходиться над гелем, обережно зливають, невелику кількість гелю скляною лопаточкою переносять у стакан з дистильованою водою та перемішують. Гель пептизується з утворенням синього золю гексаціаноферату (ІІ) заліза.
1.2.3.2 Золь гідроксиду заліза (ІІІ). 1 см3 насиченого розчину FeCI3 розводять водою до 20 см3 в цей же розчин додають концентрований розчин аміаку до повного осадку Fe(OH)3. Рідину над осадом обережно зливають, осад промивають водою декілька раз декантацією. 20 см3 0,1 н. розчину НСІ розводять до 50 см3 водою і заносять в колбу з осадом гідроксиду заліза. При розмішуванні утворюється золь вишнево-червоного кольору.
1.2.4 Отримання емульсії До 50 см3 води додають 5-10 см3 бензолу або соняшникового масла і 0,3 см3 10%-ного розчину олеату натрію. Суміш ретельно перемішують. Отримують стійку емульсію. Для визначення типу емульсії на поверхню однієї частки відібраної емульсії вводять барвник судан Ш, а на поверхню другого – метиленовий голубий. Якщо емульсія зафарблюється суданом Ш, то це емульсія типу в/м (вода у маслі), а в випадку забарвлення метиленовим голубим – типа м/в (масло у воді).
Контрольні питання
1 Які чинники визначають розмір частинок золю, отриманого конденсаційним методом? 2 Як отримати високодисперсний золь? 3 Як можна стабілізувати золі, отримані конденсаційним методом? 4 Що таке пептизація? Які види пептизації існують? 5 Які види пептизації застосовують в даній роботі? 6 Як класифікують емульсії? Які речовини використовують для стабілізації прямих та зворотних емульсій?
Література
1 Фролов Ю.Г Курс коллоидной химии.- М.:Химия,1989,с.115-128. 2 Лабораторные работы и задачи по коллоидной химии.-Под ред. Ю.Г. Фролова.-М.:Химия.1986, с171-173.
Лабораторна робота 2 Вивчення адсорбції поверхнево-активних речовин (ПАР) на межі розділу рідина-газ
Ціль роботи: - побудувати ізотерму поверхневого натягу σ= f (с); - побудувати ізотерму адсорбції ПАВ Г = f (с); - розрахувати значення граничної адсорбції Г∞; - розрахувати площу, яку займає молекула адсорбата в поверхневому шарі S0; - розрахувати товщину адсорбційного шару δ.
2.1 Обґрунтування запропонованої методики
Для вимірювання поверхневого натягу в роботі використовується метод максимального тиску пухирців повітря, яке видувається в досліджуваний розчин через капіляр. Тиск Р в момент відриву пухирця максимальний і зв’язаний з поверхневим натягом співвідношенням σ= Кр, (2.1) де: К – коефіцієнт пропорційності, який визначається з виміру величини тиску р для рідини з відомим значенням поверхневого натягу σ, наприклад води, для якої σ = 72,75 · 10-3 Н/м при Т = 293 К. Знаючі поверхневий натяг води і вимірявши для неї величину тиску р у момент відриву пухирця, на підставі (1) отримуємо σ = Коефіцієнт К залежить від форми капіляру, його розміру та глибини занурення в розчин, який досліджується. Результати виміру σ використовують для побудови ізотерми поверхневого натягу в координатах σ – с (рисунок 2.1) Адсорбцію визначають за рівнянням Гіббса: Г = де с – концентрація розчину, кмоль/м3; R – універсальна газова стала, яка дорівнює 8,314 Дж/(мольК) або 8314 Дж/(кмоль К);
s0
Z x
сx с
Рис 2.1 Ізотерма поверхневого натягу. Для визначення поверхневої активності проводять графічне диференціювання залежності σ = f(с). Якщо в точці х провести дотичну до ізотерми поверхневого натягу, то тангенс кута нахилу ( кут φ) її до осі абсцис буде дорівнювати dσ/dc. З графіка видно, що відрізок Z, який відтинається на осі ординат ординатою точки х та дотичною, яка проведена через цю точку
Z = - сx· tgφ = - сx·dσ/dc, (2.4)
де: сх – концентрація ПАВ, яка відповідає точці х. Звідки: - dσ/dc = Z/сx (2.5) Підставивши останній вираз в рівняння (2.3), одержуємо Г, кмоль/м2: Г= Обробивши описаним способом в 6-8 точках побудовану за експериментальними даними криву σ = f (с), будують ізотерму адсорбції (рисунок 2.2).
Рисунок 2.2 Ізотерма адсорбції
Ізотерма адсорбції такого вигляду може бути описана рівнянням Ленгмюра: Г= Г∞ де: Г К – константа адсорбційної рівноваги.
Для того, щоб знайти Г
Відрізок, який відтинається прямою на осі ординат, дорівнює tg
с/Г m
l n с
Рисуонок 2.3 Ізотерма адсорбції в координатах лінійної форми рівняння Ленгмюра.
Визначене таким чином значення Г∞ використовують для розрахунку площі S0, яку займає молекула ПАР на поверхні розділу фаз, та товщини адсорбційного шару δ, яка відповідає довжині молекули ПАР. S0 =
δ = де NA - стала Авогадро; М – молекулярна маса; р – густина ПАР кг/м3
Значення молекулярної маси і густини деяких ПАР, необхідні для розрахунку товщини адсорбційного шару, наведені у таблиці 1.
Таблиця 2.1 - Молекулярна маса та густина ПАР
Продовження таблиці 2.1
2.2 Виконання роботи
Для виконання роботи потрібні: прилад для вимірювання поверхневого натягу; вихідні розчини ПАР; бюретка для дистильованої води; піпетки
2.2.1 Опис установки
Для вимірювання поверхневого натягу використовують установку, запропоновану Ребіндером (рисунок 2.4). Установка містить вимірювальну комірку 1 з капіляром 2, аспіратор 4, за допомогою якого створюють зовнішній тиск, і манометр 3.
Рисунок 2.4 Схема установки для визначення поверхневого натягу методом максимального тиску: Досліджувану рідину заливають у комірку 1. Капіляр шляхом обертання в отворі гумової пробки розміщують так, щоб він занурювався у рідину не більш ніж на 1 мм. Відкривши кран 5 встановлюють меніск на нульовій відмітці. Кран 5 закривають і відкривають кран 6 аспіратора. В устаноавці створюється розрядження, внаслідок чого манометрична рідина піднімаються у трубці манометра. Пухірець повітря, який сформувався на кінці капіляру, при досягненні рmax пробивши поверхневий шар лопається. В цей момент в системі зменшується і манометрична рідина починає опускатися, але внаслідок утворення нового пухирця знов починає підніматися. Таким чином, рівень манометричної рідини весь час колихається. Щоб зменшити пульсацію у вимірювальній трубці, слід домагатися рівномірного проскоку пухирців з інтервалом 5 – 20 с. Час утворення і відриву пухирців регулюють шляхом змінення швидкості витікання води із аспіратора.
Порядок виконання роботи
У чисту та просушену комірку 1 за допомогою чистої та сухої мірної піпетки наливають точно 1 см3 розчину поверхнево-активної речовини , що досліджується (завдання дає викладач). Комірку 1 з розчином щільно закривають резиновою пробкою (корисно злегка змочити пробку чистою водою). Капіляр 2, повертаючи в пробці, обережно переміщують так, щоб капілярний кінець тільки стикався з розчином, але не занурювався в нього (відсутність занурювання обов’язкова). Щоб запобігти попаданню жирових забруднень в розчин, не можна доторкатися пальцями кінця капілярної трубочки. При відкритому крані 5 відмічають з похибкою не більш, як 0,5 мм, та записують значення рівня рідини в одному з колін манометра (умовна точка відліку), яке зазвичай не співпадає з нульовою точкою шкали. Далі всі виміри проводять по одному і тому ж коліну манометра. Приєднавши комірку 1 до системи, випробують її на герметичність. Для цього закривають кран 5 і відкривають кран 6, випускають невелику кількість рідини з аспіратора 4, створюючи у системі деяке розрідження. Потім кран 6 закривають. Якщо різниця рівнів на манометрі 3 не зменшується протягом 2-3 хвилин, то система достатньо герметична, і це дозволяє приступити до вимірювань. В іншому випадку перевіряють щільність з'єднань резинових пробок та трубок зі склом. Упевнившись в герметичності приладу, повільно збільшують розрідження у системі, для чого при закритому крані 5 по краплям випускають воду з крана 6. Під впливом різниці тиску, атмосферного та в середині системи на капілярному кінці, який торкається рідини, створюється пухирець повітря, який з часом відривається. Швидкість створення та відриву пухирця регулюють зміною швидкості витікання води з крана 6 з таким розрахунком, щоб створення пухирця проходило за 5-10 секунд. Це необхідно для встановлення адсорбційної рівноваги на поверхні пухирця. Часу відриву пухирця відповідає деяке максимальне розрідження у системі, яке вимірюється за висотою Н стовпчика рідини у одному з колін манометра. (похибка не більш ніж 0,5 мм). Оскільки тиск повітря пухирця більший за тиск у системі, то у момент відриву та розпаду пухирця розрідження у колбі зменшується і відбувається деяке падіння стовпа манометричної рідини. Потім розрідження знову нарощується, формується та відривається новий пухирець повітря і т.д. Таким чином, періодично (через 5-10 сек.) різниця тиску досягає максимуму, а потім падає і т.д. Відмічають декілька значень максимальної висоти Н, відкривають кран 5 і ждуть відновлення початкового рівня манометричної рідини. Вносять в отримане значення Н поправку на початковий рівень рідини у манометрі і записують одержаний результат у таблицю 2 (1-й вимір). Таким же шляхом проводять не менше 5 вимірів з одним розчином. Різниця між паралельними вимірами не повинна перевищувати 1 мм. Слід пам’ятати, що відлік максимальної висоти стовпчика Н з всіма розчинами потрібно вести в одному і тому же коліні манометра 3.
Таблиця 2.2 - Результати вимірювань висоти стовпчика рідини
Вийнявши пробку з комірки 1, підливають до розчину 1 см3 води з бюретки, розводячи тим самим розчин удвічі. Щільно закривають колбу пробкою з капіляром. Перемішують розчин круговими обертами колби. Потім ретельно промивають кінчик капіляра розчином, обережно набирають та видавлюють з кінчика капіляра рідину за допомогою резинової трубочки, яка надіта другий кінець капіляра. Як і в першому випадку, регулюють висоту капіляра, щоб його кінець стинався з поверхнею рідини, та вимірюють висоту Н по манометру для розбавленого удвічі розчину описаним вище способом. Розбавляють розчин, який є в колбі знову вдвічі, для цього у колбу з бюретки додають 2 см3 води і повторюють усі описані операції та вимірюють Н. Потім до розчину добавляють послідовно 4, 8, 16 і 32 см3 води (6 разів послідовно розбавляють розчин вдвічі). Для кожного розчину вимірюють висоту Н, попередньо промивши кінчик капіляру. Усі результати вимірів заносять у таблицю 2.2. Закінчивши вимір поверхневого натягу розчинів, комірку споліскують дистильованою водою, а потім наливають в неї 1см3 води та замірюють максимальну висоту стовпа Н(н2о).
2.3 Обробка результатів вимірювань
Якщо температура досліду відрізняється від 298 К, то поверхневий натяг води розраховують за формулою: σ (н2о) т = σ298 + де Поверхневий натяг розчинів розраховують за рівнянням (2.2). За отриманими значеннями поверхневого натягу на міліметровому папері будують залежність σ = f(с) та обробляють її описаним вище способом. Результати розрахунків заносять у таблицю 3, на підставі якої будують залежність Г = f(с) та с/Г= f(с).
Таблиця 2.3 - Результати обробки ізотерми поверхневого натягу
*) Концентрації, для яких визначають z і Г можуть бути і іншими.
На підставі останньої залежності визначають граничну адсорбцію Г∞ і характеристики молекул ПАР. Обробку лінійної залежності рекомендується проводити методом найменших квадратів.
Контрольні питання
1 Що таке поверхнева активність? Які речовини називають поверхнево-активними? 2 Визначте поверхневу активність речовини, з якою працювали? 3 Як розрахувати товщину поверхневого шару? Від чого вона залежить? 4 Чім визначається величина граничної адсорбції? 5 Які фактори впливають на агрегатний стан ПАР у поверхневому шарі? 6 Розкажіть про орієнтацію молекул ПАР у поверхневому шарі. 7 Сформуйте правило Дюкло-Траубе. Які причини можуть привести до порушення правила Траубе?
Література
1 Фролов Ю.Г.Курс коллоидной химии.-М.:Химия,1989,с.39-45,184-191 2 Лабораторные работы и задачи по коллоидной химии – Под ред. Ю.Г. Фролова.-М.:Химия.1986, с.11-17.
Лабораторна робота 3 Дослідження адсорбції органічних кислот на поверхні активованого вугілля Ціль роботи: - побудувати ізотерму адсорбції розчиненої речовини на твердому адсорбенті; - визначити константи в рівнянні ізотерми адсорбції Фрейндліха.
3.1 Обґрунтування запропонованої методики експерименту
Для твердих пористих адсорбентів у межах середніх концентрацій ізотерма адсорбції може бути задовільно описана емпіричним рівнянням Фрейндліха:
а = х/m = К ∙ срівн.1/ n , (3.1)
де а – адсорбція у мілімолях на 1 грам адсорбенту, тобто кількість речовини, яка адсорбується одиницею маси адсорбенту; К – адсорбційна стала, яка залежить від природи адсорбенту та адсорбату і дорівнює величині адсорбції при Срізн. = 1 моль/дм3 ; срівн. – рівноважна концентрація розчиненої речовини, моль/дм3; 1/n - константа, яка враховує відхилення ізотерми адсорбції від лінійної залежності. При логарифмуванні рівняння Фрейндліха одержують залежність In a = In∙ K + 1/n Inсрівн. , (3.2)
яку наведену на рисунку 3.1 і яку використовують для визначення констант рівняння. Тангенс кута нахилу прямої до осі абсцис дорівнює 1/n , а відрізок, який відтинається на осі ординат дорівнює InK.
lnK
Рисунок 3.1 - Ізотерма адсорбції Фрейндліха в координатах лінійної форми рівняння
Величину адсорбції зазвичай вираховують за концентрацію розчину до та після адсорбції. При адсорбції слабких органічних кислот, рівноважну срівн (та початкову споч) концентрацію можна визначити методом титрування, розчином NaOH. А величину адсорбції розрахувати за формулою: а = х/m =(споч. - срівн)/m · V (3.3) де: m – маса навісу адсорбенту (вугілля), г; V – об’єм розчину, в якому відбувається адсорбція, дм3.
4.2 Виконання роботи
Для виконання роботи потрібні: набір конічних колб місткістю 250 см3 – 12 шт; бюретка для титрування; стаканчики, колба для титрування, фільтрувальний папер; розчин органічної кислоти; титрований розчин NaOH; розчин індикатора (фенолфталеїну); активоване вугілля; технічні терези, рівноваги; лійки для фільтрування; піпетки на 10см3 та 20см3; мірні циліндри Перш за все, визначають концентрацію, взятої для досліду кислоти, методом титрування розчином NaOH, в присутності індикатора фенолфталеїну. Концентрацію кислоти вираховують за законом еквівалентів
Nк · Vк = Nл · Vл , (3.4)
де Nк, Nл - концентрація досліджуваної кислоти та концентрація розчину NaOH у моль-екв/дм3; Vк та Vл - об’єм взятої кислоти і об’єм розчину лугів, який використали на титрування.
Результати титрування заносять у таблицю 3.1. З вихідного розчину кислоти готують декілька розчинів різної концентрації шляхом розбавлення удвічі. Для цього у першу колбу вносять 50 см3 кислоти вихідної концентрації. У другу колбу вносять 50см3 кислоти вихідної концентрації і 50 см3 води. Після перемішування отриманого розчину 50 см3 його з цієї колби, переносять у третю колбу та розбавляють водою у кількості 50 см3 і т.д. У шостій колбі після розбавлення повинно бути 100 см3 розчину. Для того, щоб розрахунок і в цьому випадку вести на 50 см3 розчину, необхідно 50 см3 розчину з цієї колби надібрати та вилити у злив.
Таблиця 3.1 - Результати титрування
Як адсорбент використовують активоване вугілля. До 50 см3 кожного з шести приготовлених розчинів додають по 1г вугілля. Процес адсорбції проходить зазвичай швидко, але дифузія розчиненої речовини у розчинах, під впливом якої поповнюється втрачена концентрація на поверхні адсорбенту, проходить повільно і затримує встановлення адсорбційної рівноваги. Для більш прискореного встановлення рівноваги рекомендується перемішувати або струшувати розчини з адсорбентом протягом декількох хвилин. Після чого одфільтровують розчин, відокремлюючи перші порції фільтрату. Рештку фільтрату використовують для титрування, відбираючи проби по 10 см3 . Отримані результати титрування проб після адсорбції, як і результати титруванні вихідного розчину, записують в таблицю 3.1. За результатами титрування вираховують кількість речовини (у мілімолях), яка знаходиться у 50 см3 розчину до та після адсорбції. Слід замітити, що до адсорбції титрують тільки вихідний розчин, а вміст речовини в більш розведених розчинах вираховують зменшенням у два рази кількості речовини, яка міститься у 50 см3 попереднього розчину. Отримані дані заносять до таблиці 3.2
Таблиця 3.2 - Визначення кількості адсорбованої речовини
3.3 Обробка результатів вимірювань
Дані таблиці 3.2 використовують для побудови ізотерми адсорбції. По осі абсцис відкладають значення рівноважної концентрації, а по осі ординат – кількість речовини, яка була адсорбована одним грамом вугілля, тобто величину адсорбції. Для визначення константи К і 1/n у рівнянні Фрейндліха будують графік у координатах In x/m – In С. Вихідні дані для нього заносять у таблицю 3.3.
Таблиця 3.3 - Визначення констант у рівнянні Фрейндліха
Константи визначають, як вказано в пункті 3.1. При обробці результатів рекомендується використовувати метод найменших квадратів. Після того, як знайдено константи, слід записати рівняння Фрейнліха. За цим рівнянням розраховують величину адсорбції при декількох концентраціях (в інтервалі досліджених) та наносять отримані значення на графік для оцінки коректності отриманого рівняння.
Контрольні питання 1 Чим можна пояснити вигляд одержаної ізотерми адсорбції? 2 Який вигляд матиме ізотерма адсорбції, якщо процес проводити при більш високій температурі? 3 Як впливає розчинник на адсорбцію розчиненої речовини? 4 Які властивості адсорбенту слід враховувати при використанні адсорбції для процесів очистки та витягнення з розчинів? 5 Що таке іонообмінна адсорбція? им вона відрізняється від молекулярної?
Література 1. Фролов Ю.Г Курс коллоидной химии.- М.:Химия,1989,с.174-183,198-208. 2. Практикум по коллоидной химии и электронной микроскопии / Под ред. Воюцкого С. С.М.:Химия,1974,- с.83-87
Лабораторна робота 4 Визначення розмірів частинок дисперсних систем турбідиметричним методом Ціль роботи: - визначити розмір частинок високодисперсних систем.
4.1 Обґрунтування запропонованої методики експерименту
Визначення розмірів частинок засновано на розсіюванні світла незабарвленими дисперсними системами. Світлорозсіювання, або опалесценція, належить до дифракційних явищ, які зумовлені неоднорідностями, розміри яких менші довжини хвилі падаючого світла. Такі неоднорідності розсіюють світло у всіх напрямках. В основі теорії світлорозсіювання (опалесценції), розробленої Релеєм, лежить рівняння для інтенсивності світла Ip, розсіяного одиницею об’єму дисперсної системи із сферичними діелектричними частинками, значно меншими за довжину хвилі падаючого світла:
Ip = I0 [ Fv2 · ν / (λ4 )] (4.1)
де: I0 - інтенсивність світла, яке направлене на дисперсну систему; F – функція показника переломлення дисперсної фази та дисперсійного середовища; ν – кількість частинок в одиниці об’єму системи (частинкова концентрація); v– об’єм окремої частинки; λ – довжина хвилі світла, направленого на дисперсну систему ;
Функція F визначається співвідношенням F = 24π3 де: n1 і n0 - показник переломлення світла речовини дисперсної фази та дисперсійного середовища відповідно.
На підставі рівняння Релея ґрунтуються оптичні методи визначення розмірів часток і концентрації дисперсної фази: ультрамікроскопія, нефелометрія та турбідиметрія. Турбідиметрія заснована на вимірі оптичної густини. Інтенсивність світла, направленого на дисперсну систему, зменшується внаслідок його розсіювання. Розсіяне світло можна вважати фіктивно поглинутим і, таким чином, є усі підстави прийняти, що закономірності розсіювання світла підчиняються рівнянню, аналогічному закону Бугера-Ламберта-Бера:
IП = Io · e-τI
або – ln
де: I0, IП – інтенсивність світла, направленого на дисперсну систему, та світла, яке пройшло через систему; D – оптична густина; D = Ig I0/IП; τ – мутність дисперсної системи; l – товщина шару дисперсної системи.
Інтенсивність випромінювання, яке пройшло через дисперсну систему можна представити у вигляді різниці:
IП = I0 - Ip I (4.4)
де: Ip l – інтенсивність світла, яке розсіялося зразком довжиною 1.
Після ділення на I0 та логарифмування отримуємо: -2,3 D = In (1 – Ip1/I0) (4.5) Взявши до уваги, що Ip1<< I0, розкладуючи у ряд логарифм і зневажаючи безкінечно малими величинами другого порядку, отримаємо:
2,3 D ≈ Ipl/I0 = Ip ∙ 1/I0 = τ ·l (4.6)
У цьому рівнянні, τ – мутність, яка висловлюється відношенням інтенсивностей розсіяного та падаючого світла, віднесеним до одиниці довжини зразку τ = Ip/I0. Мутність, а звідси оптична густина D відповідно до рівнянь (4.1 і 4.6) пропорційна концентрації та квадрату об’єму частинки. Це дозволяє визначити розміри частинок та їх концентрацію за оптичною густиною дисперсної системи методом порівняння зі стандартними системами за допомогою фотоелектроколориметру. Рівняння Релея може використовуватися для визначення розміру частинок сферичної форми, якщо їх радіус r не перевищує 1/20 від довжини хвилі λ падаючого світла. Згідно з рівнянням (4.1) та 4.3) радіус таких частинок дорівнює:
r = (3τλ4/ 4π с F) 1/3 (4.7)
де: с = ν·v – об’ємна концентрація дисперсної фази.
Необхідною умовою використання рівнянь (4.1) і (4.7) є відсутність поглинання світла, а також вторинного світорозсіювання. Тому рівняння Релея використовується тільки для незабарвлених, так званих «білих золів», тобто таких, які не поглинають світло, та при малих концентраціях дисперсної фази. Збільшення розмірів частинок порушує закон Релея і інтенсивність розсіяного світла становиться зворотно пропорційною довжині хвилі в меншій ступені, ніж четверта. В цьому випадку використовують рівняння, які випливають із загальної теорії світлорозсіювання, або емпіричні співвідношення. Зокрема, якщо розмір (діаметр) частинок лежить у межах від 1/10 до 1/3 від довжини світлової хвилі і показники переломлення світла частинками дисперсної фази та середовищем не особливо відрізняються, для опису світлорозсіювання дисперсною системою можна скористатися емпіричними рівняннями, запропонованими Геллером:
D = kλ-n та τ = k' · λ-n (4.8)
де: k і k' - константи, які не залежать від довжини хвилі.
Залежність InD (або In τ) від Inλ відповідно до рівняння 4.8) являє собою пряму лінію, тангенс кута нахилу якої до осі Inλ дорівнює показнику ступені n з негативним знаком. Значення показника ступені n у цих рівняннях залежить від співвідношення між розміром частинки та довжиною хвилі падаючого світла, яке характеризується параметром Z:
Z = 8πr /λ (4.9)
Зі збільшенням Z значення n зменшується, добігаючи 2, для частинок, радіус яких більший довжини хвилі. При менших значеннях Z виконується рівняння Релея і n = 4. Значення n для різних значень параметра Z наведені у таблиці 4.1. Показник ступеню n у рівнянні (4.8) знаходять на підставі турбодіметричних вимірювань оптичної густини розчинів на різних довжинах хвиль і графічної обробки рівняння Геллера. Слід підкреслити, що цей метод, як і рівняння Релея, використовується тільки для незабарвлених дисперсних систем (метод базується тільки на світлорозсіюванні).
Таблиця 4.1 - Показник ступені n у рівнянні Геллера в залежності від параметру Z.
4.2 Виконання роботи
Для виконання роботи потрібні: фотоелектричний концентраційний калориметр КФК-2; набір латексів; піпетки
4.2.1 Опис приладу
Оптичну густину золю можна вимірювати за допомогою фотоелектричного концентраційного калориметра КФК-2, оптична схема якого наведена на рисунку 4.1. Нитка лампи 1 конденсором 2 відображається у площині діафрагми (3) d = 2 мм. Це відображення об’єктивами 4,5 переноситься в площину, яка віддалена від об’єктиву на відстані 300 мм, зі збільшенням у 10х . Кювета 10 з розчином, що досліджується, вводиться у світловий пучок між захисним склом 9,11. Для виділення вузьких ділянок із суцільного спектру випромінювання лампи у калориметрі передбачено кольорові світлофільтри 8.
Рисунок 4.1 - Принципова оптична схема приладу КФК-2 (пояснення у тексті)
Теплозахисний світлофільтр 6, уведений у світловий пучок для роботи у видимій області спектру (400-590 нм). Для ослаблення світлового потоку при роботі у спектральному діапазоні 400-500 нм встановлені нейтральні світофільтри 7. Фотоприймачі у різних областях спектру: Фотоелемент Ф-2617 у області спектру 315-540 нм; Фотоцид ФД-24К 12 – у області 590-980 нм. Пластина 15 розділяє світловий потік на два: ≈ 10% світлового потоку направляється на фотодіод ФД-24К і ≈ 90% - на фотоелементФ-26. Для зрівняння фотострумів, які знімають з фотоприймачів ФД-24К при роботі з різними кольоровими світлофільтрами, перед ним встановлений світлофільтр 14 із кольорового скла СЗС-16.
4.2.2 Підготовка приладу до роботи
1) Включити прилад у сіть. Тумблер на задній панелі в положення “сіть”. 2) Обертанням ручки “світлофільтр” встановити потрібний світлофільтр. 3) Ручка «чутливість» при роботі із світлофільтрами, які відповідають λ < 540 нм, повинна бути встановлена на шкалі з чорними поділками; при роботі із світлофільтрами, відповідними λ > 540 нм, ручка «чутливість» встановлюється на шкалі з червоними поділками.
4.2.3 Установка нуля
1) Відкрити кришку кюветного простору. Встановити кювету з розчинником (дисперсійна середа) на шляху “світлового променю” переміщенням ліворуч ручки на передній панелі приладу. 2) Кювету з золем, що досліджують встановити у другий кюветоутримувач. 3) Закрити кришку. Ручкою “установка 100” встановити стрілку приладу на ділення “нуль” по шкалі “Д”.
2.2.4 Вимір оптичної густини
1) Переміщенням ручки праворуч встановити кювету з золем на шляху світлового променю. 2)Прочитати та записати значення оптичної густини розчину по шкалі “Д”.
Значення довжини хвилі, які відповідають світлофільтрам приладу КФК-2, і становлять:
4.2.5 Визначення розмірів частинок дисперсних систем, які не підчиняються рівнянню Релея Спочатку вимірюють оптичну густину золю (латексу) за допомогою фотоелектроколориметру, використовуючи світлофільтр № 3. Значення оптичної густини латексу повинно бути в межах 0,70-0,95. Якщо значення оптичної густини зразку менше чи більше вказаного, то слід відповідно зменшити або збільшити концентрацію дисперсної фази у латексі. Для досягання потрібного результату можна також варіювати товщину кювету. Потім визначають оптичну густину зразку латексу при других довжинах хвиль падаючого світла (використовують світлофільтри № 3-9). На кожній довжині хвилі оптичну густину вимірюють три рази та визначають середнє значення. Отримані результати записують у таблицю 4.2.
Таблиця 4.2 - Дослідні дані для розрахунку розмірів частинок
4.3 Обробка результатів вимірювань
Знаходять значення Inλвак. та InDср і будують графік у координатах InDсер – In λВАК. За допомогою графіка визначають показник ступеню n у рівнянні (4.8), як показано у пункті 4.1. За даними таблиці 4.1 будують графік у координатах Z – n, який використовують для визначення параметру Z, відповідного визначеному раніше показнику ступеню n у рівнянні (4.8). На підставі рівняння (4.9) розраховують радіус частинок латексу. Слід зауважити, що при розрахунку радіусу r на підставі рівняння (4.9) потрібно використсовувати середнє значення довжини хвилі λсер у тому інтервалі, в якому визначаємо показник ступеню n. Величину λсер находять за співвідношенням λсер= Знайдене значення r відповідає середньому радіусу частинок латексу.
Контрольні питання
1 Які оптичні явища спостерігаються при проходженні світла через дисперсну систему? Які методи дослідження дисперсних систем засновані на цих явищах? 2 Які оптичні методи використовують для визначення розмірів частинок дисперсної фази? Укажіть межі використання (за дисперсністю частинок) цих методів. 3 Чим обумовлене світлорозсіювання в дисперсних системах та істинних розчинах? 4 Які золі називають «білими»? Який зв’язок між оптичною густиною та мутністю «білих» золів? 5 Для яких дисперсних систем придатне рівняння Релея? 6 Як впливають розміри частинок на залежність оптичної густини “білих» золів від довжини хвилі падаючого світла? 7 Чім відрізняються нефелометричний і турбодіметричний метод визначення розміру частинок? Які рівняння використовують для опису розсіювання світла в цих випадках? 8 Вирішіть задачу.
Література
1 Фролов Ю.Г Курс коллоидной химии. – М.:Химия,1989,с.288-310 2 Лабораторные работы и задачи по коллоидной химии.-Под ред. Ю.Г. Фролова.-М.:Химия.1986,с.111-117.
Лабораторна робота 5 Визначення електрокінетичного потенціалу за швидкістю електрофорезу.
Ціль роботи: - визначити величину електрокінетичного потенціалу частинки золю при різних концентраціях електроліту; - побудувати залежність ξ – потенціалу від концентрації електроліту та пояснити її.
5.1 Обґрунтування запропонованої методики експерименту
Електрофорезом називають рух частинок дисперсної фази відносно дисперсійного середовища під дією постійного зовнішнього електричного поля. Причиною електрофорезу є наявність подвійного електричного шару на поверхні частинок дисперсної фази. Колоїдна частинка, яка має за рахунок іонів внутрішньої обкладки подвійного електричного шару надлишковий електричний заряд, переміщується до протилежно зарядженого електроду. Протиіони дифузійного шару, рухаються до протилежного електроду. Зміщення дисперсної фази відносно дисперсійного середовища відбувається по поверхні сковзання. Напрямок руху частинок дисперсної фази визначається знаком заряду їх поверхні. Наближаючись до відповідного електроду, частинки злипаються, утворюючи видимі оком агрегати або прилипають до електроду. Так явище електрофорезу можна спостерігати візуально. Одночасно границя розділу колоїдний розчин – дисперсійне середовище зміщується до того ж електроду. Вимірявши лінійну швидкість руху межі розділу під впливом градієнту потенціалу відповідного зовнішнього постійного електричного поля, можна розрахувати потенціал на поверхні сковзання, так званий електрокінетичний потенціал за рівнянням Смолуховського:
ξ = η U/(E· ε · ε0) (5.1)
де: ξ – електрокінетичний потенціал, В; η – в’язкість дисперсійного середовища, Па ·с; U – лінійна швидкість руху частинки, м/с; Е – напруженість електричного поля (градієнт потенціалу), В/м; ε – відносна діелектрична проникність середовища; ε0 –діелектрична проникність вакууму, Ф/м. Рівняння (1) було виведене у припущенні стаціонарного режиму і не враховує електрофоретичне гальмування та електричну релаксацію.
5.2 Виконання роботи
Для виконання роботи потрібні: прилад для виміру швидкості руху межі розділу колоїдний розчин – дисперсійне середовище; 1%-ний розчин FeCI3; 0,1%-ний розчин K4 [Fe(CN)6]; 47%-ний розчин FeCI3; розчини KCl та Al(NO3) з концентрацією 0,1М; колби місткістю 250, 200, 150 см3, піпетки.
5.2.1 Приготування золів
Готують колоїдний розчин (за завданням), використовуючи один з наведених способів. а) золь берлінської лазурі (заряд позитивний). 6 см<
Поиск по сайту: |



 (2.2)
(2.2) ; (2.3)
; (2.3) - поверхнева активність
- поверхнева активність
 s
s


 j
j
 (2.6)
(2.6) Г
Г
 Г¥
Г¥ с
с (2.7)
(2.7) - максимальна адсорбція ПАВ, яка відповідає утворенню насиченого мономолекулярного адсорбційного шару;
- максимальна адсорбція ПАВ, яка відповідає утворенню насиченого мономолекулярного адсорбційного шару; (2.8)
(2.8)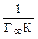 , а
, а =
= 

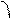 a
a (2.9)
(2.9) (2.10)
(2.10)
 (2.11)
(2.11) = -0,163·10-3
= -0,163·10-3  - температурний коефіцієнт поверхневого натягу. Отримане значення використовують для визначення коефіцієнта К за рівнянням (2.1).
- температурний коефіцієнт поверхневого натягу. Отримане значення використовують для визначення коефіцієнта К за рівнянням (2.1).
 lnа
lnа j
j ln Cрівн.
ln Cрівн.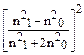 (4.2)
(4.2)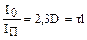 ; (4.3)
; (4.3)
 (4.10)
(4.10)