 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Стандартные электродные потенциалы окислительно-восстановительных систем
Величина электродного потенциала окислительно-восстановительной системы зависит от концентрации окисленной и восстановленной формы и температуры. Эта зависимость выражается уравнением Нернста: Е(Ox/Red) = Е°(Ox/Red) + Е(Ox/Red) - искомый потенциал окислительно-восстановительной системы (в вольтах)
Е°(Ox/Red) - ее стандартный потенциал R – универсальная газовая постоянная (8,324 Дж/моль∙К) T – абсолютная температура F – постоянноя Фарадея (96485 Кл/моль) n – количество электронов передаваемых от окисленной формы к восстановленной a(Ox) и a(Red) активности окисленной и восстановленной формы соответственно . В случае разбавленных растворов (ионная сила растворов близка к нулю) вместо активностей можно использовать их молярные концентрации: Е(Ox/Red) = Е°(Ox/Red) + При температуре Т = 298° К, подставляя численные значения R и F, используя десятичный логарифм вместо натурального (ln(a) = 2,3∙lg(a)) получаем: Е(Ox/Red) = Е°(Ox/Red) + Для системы металл/раствор соли данного металла с учетом того, что активность гетерофазы [Red] величина постоянная и равна единице уравнение принимает вид: Е(Меn+/Me) = Е°(Меn+/Ме) + Если в уравнение полуреакции входит протон или гидроксид-ион, то величина электродного потенциала зависит и от рН среды. Например, для полуреакции: МnО4- +8Н+ + 5е- = Мn2+ + 4Н2О потенциал рассчитывается по формуле:
Величина потенциала любого водородного электрода (соответствующего полуреакции 2Н+ + 2е = Н2), принимая активность водорода (Н2) равной единице, рассчитывается по формуле: Е(Н+/Н2) = Е0 (Н+/Н2) + 0,059 ∙ lg[H+]. С учетом того, что стандартный потенциал Е0 (Н+/Н2) равен нулю, а lg[H+] = -рН получаем: Е(Н+/Н2) = - 0,059 ∙ рН. Процессы коррозии и другие процессы окисления протекающие под действием атмосферного кислорода и воды соответствуют полуреакции: О2 + 4Н+ + 4е = 2Н2О Е0 = 1,228 В. Уравнение Нернста для этого процесса: Е = Е0 +0,059 ∙ lg[H+] + (0,059/4) ∙ lgP(O2), или Е = Е0 - 0,059 ∙ рН + (0,059/4) ∙ lgP(O2) где P(O2) – парциальное давление кислорода. Если парциальное давление кислорода равно одной атмосфере, то уравнение принимает вид: Е = Е0 - 0,059 ∙ рН
Поиск по сайту: |
 , где
, где
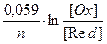
 ∙ ln[Меn+] = Е°(Меn+/Ме) +
∙ ln[Меn+] = Е°(Меn+/Ме) +  ∙ ln[Меn+]
∙ ln[Меn+] Как уже отмечалось, для водных растворов в качестве стандартного электрода обычно используют водородный электрод (Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциал которого при давлении водорода 0,101 МПа и термодинамич. активности а ионов Н+ в растворе, равной 1, принимают условно равным нулю (водородная шкала Э. п.).
Как уже отмечалось, для водных растворов в качестве стандартного электрода обычно используют водородный электрод (Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциал которого при давлении водорода 0,101 МПа и термодинамич. активности а ионов Н+ в растворе, равной 1, принимают условно равным нулю (водородная шкала Э. п.).