 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Физико-химические свойства растворов полиэлектролитов.
Полиэлектролиты – это полимеры, звенья которых содержат функциональные группы, способные к электролитической диссоциации (ионогенные группы). В зависимости от природы ионогенных групп полиэлектролиты, как и низкомолекулярные электролиты, могут быть сильными и слабыми. К числу сильных поликислот относятся, Примером слабых поликислот
SO3H n COOH n -СН2-С-
сульфоновая кислота СООН n кислота | SO3H n Полиметакриловая Полистиролсульфо- кислота новая кислота
| | | |
C = O | | | N n СН2 O NH2 n | | Поли-п-амино- Поли-4-винил- +N(CH3)3OH- n CH2-CH2-N+(CH3)3OH- n стирол пиридин Политриметиламмоний- Политриметиламмоний- п-метилстирол этилметакрилат Соли поликислот и полиоснований, как правило, представляют собой сильные полиэлектролиты. Полиэлектролиты, в макромолекулах которых содержатся как кислотные, так и основные группы, называются амфотерными или полиамфолитами. Типичный пример – сополимер винилпиридина и акриловой кислоты:
N n Линейные полиэлектролиты широко используются в различных отраслях техники в качестве флокулянтов и коагулянтов коллоидных дисперсий, например, для осветления отработанных и мутных вод, для стабилизации коллоидов, в частности, эмульсий и пен, для структурирования почв и грунтов. Они находят применение при шлихтовке, крашении и окончательной отделке волокон, при отделке и упрочнении бумаги, используются как загустители в пищевой, медицинской и фармацевтической промышленности. Сшитые полиэлектролиты служат ионообменными материалами и комплексонами и т.д. К полиэлектролитам (полиамфолитам) относятся такие биологически важные высокомолекулярные соединения, как белки и нуклеиновые кислоты. Белки представляют собой сополимеры до 20 видов различных α-аминокислот и имеют общую формулу ~NH-CH-C-NH-CH-C-NH-CH-C~ | ║ | ║ | ║ R O R´ S R˝ O где R, R´, R˝ - боковые заместители, некоторые из которых содержат кислотные и основные группы. Полиэлектролиты своеобразным образом сочетают некоторые важнейшие свойства неионогенных полимеров и низкомолекулярных электролитов. Так, растворы полиэлектролитов, как и растворы других полимеров, обладают аномально высокой вязкостью и, подобно растворам простых полиэлектролитов, хорошо проводят электрический ток. В то же время и гидродинамическое поведение, и электрохимические свойства полиэлектролитов в растворах характеризуются рядом особенностей, отличающих их как от растворов незаряженных полимеров, так и от растворов низкомолекулярных электролитов. Все специфические свойства полиэлектролитов проявляются лишь в условиях, в которых их макромолекулы несут локально нескомпенсированные заряды. Эти свойства в основном определяются взаимодействием заряженных групп полиионов между собой и с окружающими их низкомолекулярными противоионами. Поэтому наибольший интерес представляют водные растворы полиэлектролитов, в которых происходит электролитическая диссоциация соответствующих функциональных групп, входящих в состав звеньев молекулярных цепей.
Ионизационное равновесие в водных растворах полиэлектролитов
В растворе низкомолекулярного электролита, например, слабой кислоты, равновесие реакции электролитической диссоциации НА ↔ Н+ + А- описывается уравнением [H+][A-] [HA] К = ———— или [H+] = ——К [HA] [A-] Логарифмируя, находим после преобразований: pH = pК + lg [α/(1-α)] где К – константа электролитической диссоциации, α – степень диссоциации. Аналогично для слабых оснований рН = рК - lg [α/(1-α)]. Для низкомолекулярных электролитов константа диссоциации является характеристической величиной. Она не зависит от концентрации и степени диссоциации электролита. Картина значительно осложняется при переходе к рассмотрению ионизационного равновесия в растворе полиэлектролита, например, слабой поликислоты, каждый мономерный остаток которой содержит одну группу СООН. В результате диссоциации этой кислоты в водном растворе образуются высокомолекулярный анион и ионы водорода; степень диссоциации её α = z/P, где z – общий заряд макроиона, P – число ионогенных групп, равное степени полимеризации. В этом случае α и z фактически являются средними величинами, так как в растворе будут находиться частицы со всеми промежуточными степенями ионизации, начиная от недиссоциированных и кончая полностью ионизированными. Кроме того, на диссоциацию каждой ионогенной группы влияют все остальные, и наблюдаемая величина α будет зависеть от большого числа различных констант диссоциации. Например: ~(CH2-CH)P(1-α)-(CH2-CH)Pα-CH2-CH~ ↔ ~(CH2-CH)P(1-α)-(CH2-CH)Pα-CH2-CH~ + Н+ | | | | | | COOH COO- COOH COOH COO- COO- макромолекула А с зарядом z макромолекула В с зарядом z+1 Если z велико, то степень ионизации при этой реакции практически не изменяется. Скорость прямой реакции пропорциональна концентрации макромолекул [A] и количеству карбоксильных групп в макромолекуле Р(1-α), а обратной реакции – концентрации ионов водорода, концентрации молекул [B] и количеству карбоксилатных групп Рα. Таким образом, константа равновесия [H+][B]αP K = ———— [A](1-α)P Или учитывая, что при α ≠ 0 и при достаточно больших Р z >> 1, можно утверждать, что макромолекулы А и В практически неразличимы, т.е. [A] ≈ [B]. В связи с этим для ионизационного равновесия в растворах полиэлектролитов можно написать уравнение, которое по форме совпадает с уравнением для низкомолекулярной кислоты: рН = рК + lg [α/(1-α)] (1) Удаление первого протона от нейтральной макромолекулы описывается константой диссоциации К0 ионогенной группы, входящей в состав мономерного звена. Эта величина часто оказывается близкой к константе диссоциации низкомолекулярного аналога звена полиэлектролита. Однако для ионизации каждой последующей группы полимерной цепи необходимо совершить работу против сил электростатического поля, создаваемого уже заряженными группами. Эта дополнительная работа зависит от степени ионизации макромолекулы. Поэтому эффективная константа диссоциации полиэлектролита в отличие от таковой для низкомолекулярного электролита также зависит от степени его ионизации.
ионизации для поликислоты (1) и 6 её низкомолекулярного аналога (2).
0,2 0,4 0,6 0,8 α Эту зависимость можно учесть, выразив в уравнении (1) рК как сумму рК0 и дополнительного члена ΔрК: рН = рК0 + ΔрК + lg [α/(1-α)] (2) Величина pK0 связана с энергией, затраченной на электролитическую диссоциацию изолированной связи –СОО-Н, а ΔрК – с работой против электростатических сил, затраченной на удаление моля зарядов из моля частично ионизированных клубков. Очевидно, что эта работа зависит от заряда макромолекул, причём Аэл(z) = 2,3RTΔpK (3) Электростатическая составляющая энергии Гиббса для макромолекулы полиэлектролита, несущей заряд z, равна z α=z/P α ΔGэл(α) = Σ Аэл(z) = Σ Аэл(α)Р ≈ Р ∫ Аэл(α)dα (4) z=0 α=0 0 где dα - изменение степени ионизации макромолекулы при изменении заряда на единицу. Комбинируя уравнения (2), (3) и (4), получим выражение для электростатической составляющей энергии Гиббса полииона, приходящейся на моль макромолекул, как функцию степени ионизации: α α ΔGэл = 2,3PRT ∫ ( pH – lg α/(1-α) – pK0 ) dα = 2,3PRT ∫ pKdα - 2,3PRTαpK0 (5) 0 0 Величина ΔGэл зависит от ионной силы раствора. Повышение ионной силы приводит к ослаблению электростатических взаимодействий в полимерной цепи вследствие частичного экранирования зарядов и, следовательно, к уменьшению ΔGэл и увеличению эффективной константы диссоциации поликислоты. В результате кривая титрования полиэлектролита приближается к кривой титрования низкомолекулярного аналога. Однако эти кривые никогда не совпадают, поскольку даже при весьма высокой ионной силе раствора взаимодействия между ближайшими по цепи заряженными группами не экранируются полностью. На кривую титрования существенно влияет также строение полиэлектролитной цепи, в частности конфигурации звеньев, а также конформация, принимаемая ею в растворе. Изменение степени полимеризации (при достаточно больших Р) не влияет на ΔрК, так как электростатическое взаимодействие в достаточно длинной цепи определяется не зарядом макромолекулы, а его линейной плотностью на полиионе.
Особенности гидродинамических свойств полиэлектролитов
Важной характеристикой гидродинамического поведения растворов является их вязкость. Для незаряженных полимеров приведённая вязкость ηпр линейно убывает с уменьшением концентрации раствора, стремясь при экстраполяции к нулевой концентрации к своему пределу – характеристической вязкости [η]. Для растворов ионизированных макромолекул при низких ионных силах зависимость приведённой вязкости от концентрации раствора аномальна: их приведённая вязкость с уменьшением концентрации полиэлектролита нелинейно возрастает (рис. 2).
вязкости от концентрации раствора:
3 3 лиэлектролита в присутствии избытка
1 раствора; 4,5 – водный раствор поли- электролита в присутствии раствора низкомолекулрной соли, ионная сила 0,1 0,3 0,5 с которого выше (4) и ниже (5) ионной силы исходного раствора полиэлектролита.
Это делает невозможным определение характеристической вязкости раствора полиэлектролита путём экстраполяции измеренной в таких условиях приведённой вязкости к нулевой концентрации полимера. Возрастание приведённой вязкости при разбавлении раствора полиэлектролита вызвано т.н. полиэлектролитным набуханием, т.е. увеличением объёма и соответственно линейных размеров макромолекулярных клубков из-за увеличения электростатического отталкивания одноимённо заряженных звеньев цепи. При разбавлении раствора полиэлектролита ионная сила раствора, создаваемая самим полиэлектролитом, уменьшается. По мере разбавления всё большее число компенсирующих низкомолекулярных противоионов уходит из объёма заряженного макромолекулярного клубка, образуя вокруг него диффузный слой, расширяющийся с разбавлением. Эффективный заряд макромолекул соответственно возрастает, что и приводит к дополнительному набуханию макромолекулярных клубков. Следует отметить, что удельная вязкость раствора полиэлектролита при разбавлении уменьшается. Возрастает именно приведённая вязкость, которая, как и характеристическая вязкость, пропорциональна эффективному объёму, занимаемому полиионом в растворе. Полиэлектролитное набухание можно устранить путём введения в исходный раствор некоторого избытка нейтрального низкомолекулярного электролита или путём поддержания постоянной ионной силы раствора при разбавлении. Тогда концентрация компенсирующих противоионов в молекулярных клубках не изменяется при разбавлении, и полиэлектролит в растворе ведёт себя как незаряженный полимер: приведённая вязкость линейно уменьшается с уменьшением концентрации (см. рис. 2). Аналогичное поведение обнаруживает полиэлектролит в растворителях с относительно низкой диэлектрической проницаемостью, в которых электролитическая диссоциация практически полностью подавлена, например, в абсолютном метаноле или диоксане. Такими приёмами разбавления или подбором подходящего растворителя пользуются при определении молекулярной массы полиэлектролита вискозиметрическим методом. Наибольший интерес представляет изоионное разбавление, т.е. разбавление при постоянной ионной силе раствора. Для поддержания постоянной ионной силы необходимо уменьшение её при разбавлении компенсировать введением в раствор определённого количества низкомолекулярного электролита. Суммарная эффективная ионная сила раствора I определяется вкладами низкомолекулярного электролита Iнмэ и полиэлектролита Iпэ: I = Iнмэ + Iпэ Сложность поддержания постоянства ионной силы заключается в учёте вклада полиэлектролита. Если полиэлектролит сильный, т.е. каждое мономерное звено несёт ионизированную группу, то Iпэ = Сφ где С – концентрация полиэлектролита (осново-моль/л); φ – доля «собственных» противоионов, не связанных внутри клубка. Обычно φ < 1, поскольку часть противоионов всегда прочно удерживается полиионами. Водный бессолевой раствор полиэлектролита с концентрацией С0 разбавляют раствором нейтральной низкомолекулярной соли постоянной концентрации χ∞. Если при этом ионная сила раствора больше (меньше) ионной силы исходного раствора полиэлектролита, то зависимость приведённой вязкости от концентрации выражается вогнутой (соответственно, выпуклой) кривой (см. рис. 2). На практике разбавления производят растворами соли разных концентраций до тех пор, пока не получают прямолинейную зависимость. Это и означает, что ионная сила раствора в ходе разбавления остаётся постоянной, а подобранная концентрация низкомолекулярного электролита в точности равняется ионной силе исходного раствора полиэлектролита, т.е. χ∞ = С0φ Пользуясь этим уравнением, можно определить долю свободных противоионов в растворе и долю противоионов (1 – φ), связанных полиионами. Доля связанных противоионов зависит от молекулярной массы и заряда полиэлектролита, но практически не зависит от концентрации полимера и ионной силы раствора. Ассоциация противоположно заряженных ионов, как правило, может происходить и в растворах низкомолекулярных электролитов, на что указывает, в частности, образование ионных пар, особенно в неводных растворителях. В случае полиэлектролитов из-за высокого электростатического потенциала полиионов ассоциация низкомолекулярных противоионов с заряженными звеньями цепи выражена настолько сильно, что, например, при электролизе раствора полиакрилата натрия до 60% компенсирующих катионов натрия движутся в электрическом поле к аноду вместе с полиионами. Даже значительное повышение напряжённости электрического поля не приводит к отрыву основной массы противоионов от полиионов. Степень связывания низкомолекулярных ионов зависит от степени ионизации и химической природы полииона. Связывание может быть обусловлено как чисто электростатическим притяжением зарядов противоположного знака, так и другими более специфическими взаимодействиями. Полиэлектролитное набухание наблюдается также при изучении зависимости вязкости раствора слабого полиэлектролита от рН или от степени ионизации. При добавлении кислоты (или щёлочи) к слабому полиоснованию (или слабой поликислоте) образуется полисоль, которая хорошо диссоциирована в водном растворе. Поэтому по мере нейтрализации увеличивается число одноимённых зарядов в цепи, между ними возникают силы электростатического отталкивания, приводящие к тому, что конформации полиэлектролитных клубков становятся более вытянутыми. Изменение конформации сопровождается увеличением вязкости раствора в десятки и сотни раз (рис. 3). Максимальное разворачивание наблюдается не в точке полной нейтрализации, а при α = 0,5 ÷ 0,8. При более высоких значениях α вязкость уменьшается, что объясняется повышением ионной силы раствора и экранированием зарядов в цепи. Повышение ионной силы приводит к подавлению полиэлектролитного набухания. Поэтому максимум на кривых зависимости приведённой вязкости от рН снижается при повышении концентрации полиэлектролита или при введении в раствор низкомолекулярных солей.
С3 рН водного раствора поликислоты при разных
С2
С1 0,4
Наличие в молекулах полиэлектролитов групп различной природы определяет возможность возникновения взаимодействий разных видов (электростатических, гидрофобных, водородных связей) и повышенную по сравнению с нейтральными полимерами склонность цепей полиэлектролитов к конформационным изменениям при изменении рН, температуры раствора, природы растворителя. Об изменении конформации макромолекул можно судить по значению параметра а уравнения Марка – Куна – Хаувинка: [η] = КМа. Известно, что а зависит от конформации макромолекул в растворе и изменяется от нуля для очень компактных клубков до 2 для палочкообразных частиц. Для многих глобулярных белков а = 0. В растворе сильного полиэлектролита при достаточно высокой ионной силе раствора а = 0,5, т.е. цепь имеет конформацию статистического клубка; с уменьшением ионной силы параметр а увеличивается и при ионной силе, близкой к нулю стремится к а = 2. Для слабого полиэлектролита в заряженной форме, а также для полипептидов в конформации α-спирали а = 1,5 – 2.
Поиск по сайту: |

 например могут служить
например могут служить




 -СН2-СН- -СН2-СН- -СН2-СН- СН3
-СН2-СН- -СН2-СН- -СН2-СН- СН3 | | | |
| | | | Поливинил- Полиакриловая |
Поливинил- Полиакриловая |
 Типичные примеры сильных полиоснований: Слабые полиоснования:
Типичные примеры сильных полиоснований: Слабые полиоснования:




 -СН2-СН- CH3 -СН2-СН- -СН2-СН-
-СН2-СН- CH3 -СН2-СН- -СН2-СН-
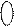



 -СН2-СН- - -СН2-СН-
-СН2-СН- - -СН2-СН- | |
| | COOH m
COOH m рК
рК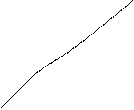 1 Рис. 1. Зависимость рК от степени
1 Рис. 1. Зависимость рК от степени 5
5
 2
2


 ηпр Рис. 2. Зависимость приведённой
ηпр Рис. 2. Зависимость приведённой 4 5 1 – бессолевой водный раствор поли-
4 5 1 – бессолевой водный раствор поли-
 1 электролита; 2 – водный раствор по-
1 электролита; 2 – водный раствор по- 4 нейтральной низкомолекулярной со-
4 нейтральной низкомолекулярной со- 2 2 ли; 3 – водный раствор полиэлектро-
2 2 ли; 3 – водный раствор полиэлектро-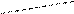 лита при постоянной ионной силе
лита при постоянной ионной силе
 ηпр Рис. 3. Зависимость приведённой вязкости от
ηпр Рис. 3. Зависимость приведённой вязкости от 2,0 концентрациях полиэлектролита (С1 > C2 > C3).
2,0 концентрациях полиэлектролита (С1 > C2 > C3). 1,2
1,2 5 7 9 рН
5 7 9 рН