|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
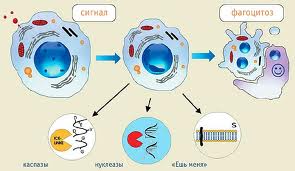
Руйнування клітинних структур при апоптозі
Фрагментація хромосомної ДНК - неактивний фермент CAD в комплексі з ICAD (інгібітор cad-чинник фрагментації ДНК) розщеплюється каспазою-3, вивільняючи CAD, розрізає ДНК нуклеосомома. Інактівація ферментів, залучених в репарацію ДНК - фермент полі (Adf-ribose) полімераза, або PARP- перший білок виявлений як субстрат для каспаз. PARP залучається до репарації ДНК і каталізує синтез (Adf-ribose) і закріплює на ланцюзі ДНК, руйнуюючи і змінюючи ядерні білки. Здатність PARP репарувати порушення розщепленням PARP каспазою-3. Інактивація білків, втягнених в реплікацію. Каспази можуть інактивувати ДНК топоізомеразу II, сприяючи руйнуванню ДНК. Руйнування структурних ядерних білків.Каспаза-6 руйнує ламіни, руйнуючи ядро, що приводить до конденсації хромосом. Чутливість клітин до стимул-реакцій змінюється залежно від експресії про- і анті-апоптозних білків (Bcl-2 білок інгібітору), складності стумулів і стадії клітинного циклу. Далі проходить розпад клітини на везикули, перехід фосфатіділсерину з внутрішнього моношару цитоплазматичної мембрани в зовнішній моношар, зменшення об'єму клітки, зморщування цитоплазматичної мембрани, конденсація ядра (апоптозні тільця), що фагоцитуються макрофагами і клітинами-сусідами.
Иніціатори апоптозу
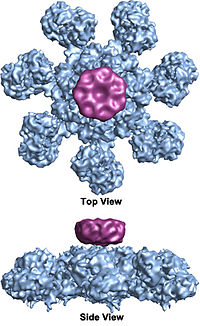
Зовнішні сигнали (зв'язування ліганда, що індукує смерть рецептором на клітинній поверхні), швидкий варіант, а гранзім B може доставлятися в клітини цитотоксичними T-лімфоцитами, коли вони впізнають інфіковану клітину, активує каспази-3, 7, 8 і 10. Клітинний стрес – радіація, хімікалії, вірусна інфекції, недолік факора росту, оксидазний стрес (кількість bcl-2 білків визначає кількість стресу, необхідного для запуску а. Якщо мітохондрії не справляються з видаленням активних форм O2, останні ініціюють відкриття пор у зовнішній мембрані і вихід в цитозоль білка, що відповідає за каскад реакцій, які приводять до синтезу протеаз, нуклеаз. Мітохондрія може бути ключовим регулятором каспазного каскаду і апоптозу - позбавлення від цитохрому-З в мітохондрії може вести до активації каспази 9 і потім каспази 3. Цей ефект досягається через утворення апоптосоми – мультипротеїнового комплексу, що включає цитохром C, Apaf-1, прокаспазу 9 і АТФ. Питання 4. Шляхи активації апоптозу Зовнішній шлях Клітина може отримувати сигнал, що індукує апоптоз, ззовні, наприклад, від цитотоксичних лімфоцитів. В такому разі активується так званий зовнішній шлях (extrinsic pathway), що починається із рецепторів смерті. Рецептори смерті — це трансмембранні білки, що належать до родини рецепторів фактора некрозу пухлин (ФНП), наприклад сам рецептор ФНП і рецептор смерті Fas. Вони формують гомотримери, в яких кожен мономер має позаклітинний ліганд-зв'язувальний домен, трансмембранний домен і цитоплазматичний домен смерті, що через адаптерні білки залучає та активує прокаспази[9]. Ліганди рецепторів смерті також є гомотримерами. Вони споріднені між собою і належать до родини сигнальних молекул фактора некрозу пухлин. Наприклад, цитотоксичні лімфоцити несуть на своїй поверхні ліганди Fas, що можуть приєднуватись до рецепторів смерті Fas на плазмалемі клітин-мішеней. В такому разі внутрішньоклітинні домени цих рецепторів з'єднуються із адаптерними білками (FADD, Fas-associated death domain), а ті у свою чергу залучають ініціаторні прокаспази 8 і/або 10. Внаслідок цієї серії подій формується сигнальний комплекс, що індукує смерть, — DISC (death inducing signaling complex). Після активації в цьому комплексі ініціаторні каспази розрізають ефекторні прокаспази і запускають апоптичний каскад[9]. Багато клітин синтезують молекули, що у певній мірі захищають їх від активації зовнішнього шляху апоптозу. Прикладом такого захисту може бути експресія так званих рецепторів-приманок (decoy receptors), що мають позаклітинні домени зв'язування лігандів, проте не мають цитоплазматичних доменів сметрі, а отже не можуть запускати апоптозу і конкурують зі звичайними рецепторами смерті за ліганди. Клітини також можуть продукувати білки, що блокують зовнішній шлях апоптозу, наприклад FLIP, що схожий за структурою до прокаспаз 8 і 10, проте не має протеалітичної активності. Він пригнічує зв'язування ініціаторних прокаспаз із комплексом DISC[9]. Внутрішній шлях Апоптоз також може запускатись із середини клітини, наприклад у випадку її травмування, пошкодження ДНК, нестачі кисню, поживних речовин або позаклітинних сигналів виживання. У хребетних цей сигнальний шлях називається внутрішнім (intrinsic pathway) або мітохондріальним, ключовою подією в ньому є вивільнення певних молекул із міжмембранного простору мітохондрій. До таких молекул зокрема належить цитхром c, що за звичайних умов входить до електрон-транспортного ланцюга мітохондрій, проте у цитоплазмі виконує іншу функцію — приєднується до адаптерного білка Apaf (apoptotic protease actiuating factor-l), викликаючи його олігомеризацію у колесоподібну семичленну структуру, що називається апоптосомою. Апоптосома залучає і активує ініціаторну прокаспазу-9, яка після цього може активувати ініціаторні прокаспази[10]. У деяких клітинах зовнішній шлях апоптозу повинен активувати внутрішній для того щоб ефективно знищити клітину. Внутрішній шлях строго регулюється білками родини Bcl-2[10]. Питання 5. Апоптосома Цитохром C звільняється з мітохондрій, зв'язуючись з цитозольним білком Apaf-1. Ця взаємодія змінює конформацію Apaf-1, яка стабілізується зв'язуванням ATP, дозволяючи молекулам Apaf-1 асоціювати один з одним в колесоподібний комплекс, що складається з 7 молекул. Apaf-1, цитохром C і ATP - апоптосома, що приєднує 7 молекул прокаспаз-9.
Рис. Апоптосома Можливі механізми: 1. Apaf-1, цитохром C і прокаспаза-9 – комплекс може активувати цитозольну прокаспазу-9, що входить в апоптосому. 2. Дві апоптосоми взаємодіють одна з одною, активуючи прокаспазу-9. Оксид азоту NO інгібірує апоптоз в лейкоцитах, гепатоцитах, трофобластах і ендотеліальних клітинахх. Ефект може бути викликаний через нітрозилюровання та інактівацію каспаз-3 -1, -8. NO взаємодіє з гемом гуанілат циклази-->синтез сgmp-->актівация cgmp-залежною протеїнкінази-->експресія протиапоптозних білків. bcl-2 - родина білків регуляторів апоптозу (bc-2, bcl-xl – протиапоптозні) (Bad, Вах – проапоптозні) | чутливість клітин до апоптозних стимул-реакцій може залежати від балансу проти- і проапоптозних bc-2 білків | стрес - проапоптозні bc-2 білки переміщаються на поверхню мітохондрій, інактивуючи антиапоптозні білки, що призводить до утворення пор в мітохондріях і випуску цитохрому з та інших про-апоптозних молекул з міжмембранного простору -->формується апоптосома-->активація каспазового каскаду.
Поиск по сайту: |