 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Применения азотных удобрений
Азотные удобрения в зависимости от содержащихся в них форм соединений азота подразделяются на шесть групп: нитратные (натриевая и кальциевая селитра); аммонийные (сульфат аммония, хлористый аммоний); аммонийно-нитратные (аммонийная селитра); амидные (мочевина); аммиачные (безводный аммиак, аммиачная вода); карбамид-аммонийно-нитратные (карбамид-аммонийная селитра – КАС). Производство азотных удобрений основано на получении синтетического аммиака из молекулярного азота воздуха и водорода, источником которого служат природный газ, нефтяные и коксовые газы. Этот процесс требует больших энергозатрат. Чтобы произвести 1 т азота, необходимо затратить энергию, эквивалентную 4 т нефти. В слое воздуха 15 км над площадью 1 га содержится около 78 тыс. тонн молекулярного азота, т.е. запасы этого элемента практически не ограничены. В конце XIX века в лабораторных условиях впервые был связан молекулярный азот с кислородом путем пропускания воздуха через пламя вольтовой дуги (температура около 3000оС): N2+О2=2NO . Окись азота окисляли до двуокиси(NO2), которая, соединяясь с водой, давала азотную кислоту. Вскоре, в Норвегии был построен первый в мире завод по производству в промышленных масштабах первого синтетического азотного удобрения – Са(NО3)2. Отсюда кальциевая селитра стала называться “норвежской”. Однако получение азотного удобрения таким способов требует затрат огромного количества энергии и не получило широкого распространения. В тоже время был предложен другой более дешевый способ связывания атмосферного азота, основанный на свойстве азота соединяться при определенных условиях (температура около 700–800оС) с карбидом кальция: N2+СаС2= СаСN2 + С. Однако этот способ также не получил широкого распространения, так как немецкий химик Табер предложил получать аммиак при взаимодействии чистых азота и водорода. Этот способ оказался наиболее дешевым и в настоящее время является основным при производстве азотных удобрений. Синтетический аммиак получают при взаимодействии химически чистых азота и водорода. Для этого смесь указанных газов в соотношении 1:3 вначале подвергают сжатию под высоким давлением, а потом падают в контактную печь (камеру синтеза), где при высокой температуре (400–5000 С) и давлении в присутствии катализаторов железа с добавлением оксидов алюминия и калия осуществляется синтез аммиака: N2+3Н2 → 2NН3 . Затем аммиак поступает в холодильник и сжижается. Источником молекулярного азота является воздух. Выделить его можно следующими способами: 1. Атмосферный воздух пропускают через генератор, наполненный горящим коксом. Кислород полностью сгорает. Из генератора поступает смесь азота с диоксидом углерода. СО2 под давлением в 25 атмосфер поглощается водой. 2. Воздух сжижается с последующим фракционированием перегонкой при разных температурах. Кислород кипит при температуре – 183оС, а азот – при – 196оС. Разница в температурах кипения позволяет разделить кислород и азот. В качестве источника водорода чаще всего используют природные и попутные нефтяные газы, а также отходящие газы коксовых печей. Возможно получение водорода из воды путем электролиза. Однако такой способ требует очень большого расхода электроэнергии. Полученный вышеуказанным способом аммиак может быть использован непосредственно в качестве удобрения (жидкий безводный аммиак), а также для получения аммонийных азотных удобрений и азотной кислоты. Азотную кислоту получают каталитическим окислением синтетического аммиака кислородом воздуха. Реакция идет в несколько этапов. Вначале аммиак окисляется до оксида азота (реакция идет с выделением тепла): NН3+5О2=4NO +6Н2О . После охлаждения оксид азота поступает в окислительные башни, где переводится в диоксид азота: 2NО+О2=2NO2 . Далее NO2 поступает в поглотительные башни, где поглощается водой с образованием азотной и азотистой кислот: 2NО2+Н2О=НNO3 + НNO2 , 3NО2+Н2О=2НNO3 + NO . Азотистая кислота не устойчива. Ангидрид (N2O3)быстро распадается: N2O3 = NO + NO2 . Оксиды азота NO и NO2 вновь возвращаются в туже систему окислительных и поглотительных установок, добиваясь, в конечном счете, их доокисления до азотной кислоты. Синтетический аммиак и азотная кислота являются основными исходными продуктами для производства как азотных, так и комплексных удобрений, содержащий азот. Основными формами азотных удобрений, которые выпускаются в Беларуси ОАО «Гродно Азот», являются карбамид, карбамид с гуматами, КАС, сульфат аммония. В перспективе планируется значительно расширить долю азота в комплексных удобрениях (табл. 1.6). Нитратные удобрения
Натриевая селитра NaNО3 содержит 16% азота и 26% натрия. Долгое время была единственным представителем группы нитратных удобрений, которую добывали из естественных залежей в Чили. В связи с этим натриевая селитра получила название чилийской селитры. С 1830 по 1914 гг. снабжение мирового рынка азотными удобрениями было в основном за счет природных залежей чилийской селитры в Южной Америке. Однако природные залежи ее исчерпались и в настоящее время натриевая селитра – побочный продукт при получении азотной кислоты из аммиака. Она представляет собой мелкокристаллическую соль белого или сероватого цвета, хорошо растворимую в воде. Гигроскопична и при неправильном хранении может слеживаться. В сухом состоянии хорошо рассеивается. Кальциевая селитра Ca(NО3)2 содержит 13 – 15% азота. Получается при нейтрализации азотной кислоты известью, а также в качестве побочного продукта при производстве комплексных удобрений способом азотнокислотной переработки фосфатов. Кристаллическая соль белого цвета, хорошо растворимая в воде. Обладает высокой гигроскопичностью и даже при нормальных условиях хранения сильно отсыревает и слеживается. Поэтому хранят и перевозят ее в специальной водонепроницаемой упаковке. В Беларуси в небольшом количестве используется для защищенного грунта. Натриевая и кальциевая селитры являются физиологически щелочными удобрениями. Растения усваивают из них больше анионы NО3-, чем катионыNa+ и Са+2, которые, оставаясь в почве, образуют основания и сдвигают реакцию почвенного раствора в сторону подщелачивания. В связи с этим нитратные удобрения весьма эффективны на кислых дерново-подзолистых почвах. В почве селитры быстро растворяются и вступают в обменные реакции с катионами почвенного поглощающего комплекса (ППК):
ППК) Са
ППК) Н
Катионы Na+ и Са2+ поглощаются почвой, а анионы NО3 остаются в почвенном растворе, сохраняя высокую подвижность. При внесении в почву нитратные удобрения сравнительно легко вымываются из пахотного слоя почвы, поэтому их применяют под предпосевную культивацию и для подкормки растений во время вегетации. Очень хорошо использовать нитратные удобрения для подкормки озимых, пропашных и других культур, а натриевую селитру – в рядки при посеве сахарной свеклы, кормовых и столовых корнеплодов, так как натрий усиливает отток углеводов из листьев в корни, повышая урожайность корнеплодов и содержание в них сахара.
Аммонийные удобрения
К аммонийным удобрениям относятся сульфат аммония, хлористый аммоний, а также углекислый аммоний. Более широко из этих форм удобрений применяется сульфат аммония, который в ассортименте азотных удобрений в настоящее время занимает около 13%. Сульфат аммония, или сернокислый аммоний, (NH4)2SО4 получают улавливанием серной кислотой аммиака из газов, образующихся при коксовании каменного угля, или нейтрализацией синтетическим аммиаком отработанной серной кислоты на различных химических производствах. Большое количество сульфата аммония вырабатывают в качестве побочного продукта при производстве капролактама. Синтетический сульфат аммония белого цвета, а коксохимический из-за органических примесей имеет серую, синеватую или красноватую окраску. Удобрение содержит 20,5 – 21 % азота и 24 % серы. Малогигроскопичен, поэтому при нормальных условиях хранения почти не слеживается и сохраняет хорошую рассеиваемость. После внесения в почву сульфат аммония быстро растворяется в почвенной влаге и вступает в обменные реакции с ППК:
ППК) Н
Поглощенный аммоний доступен для растений и хорошо закрепляется в почве. Поэтому сульфат аммония, как правило, вносят в качестве основного удобрения. Сульфат аммония физиологически кислое удобрение, так как растения быстрее и больше потребляют катионы NH4+, чем анионы S042-. Последний, соединяясь с водородом, образует серную кислоту, вызывая подкисление почвенного раствора. Для нейтрализации подкисляющего действия сульфата аммония требуется 1,3 ц СаСО3. При систематическом применении этого удобрения, особенно на малобуферных дерново-подзолистых почвах, повышается кислотность, уменьшается степень насыщенности почв основаниями. В результате ухудшаются условия роста растений и снижается эффективность удобрений. Особенно сильно подкисляющее действие сульфата аммония сказывается на культурах, чувствительных к почвенной кислотности: клевер, пшеница, ячмень, свекла и капуста, для них это удобрение менее эффективно, чем нитратные. Отрицательное влияние сульфата аммония устраняется известкованием кислых почв и хорошей заправкой органическими удобрениями. Для культур, положительно реагирующих на серу (картофель, капустные), сульфат аммония благодаря присутствию в нем серы является одним из лучших азотных удобрений.
5.2.4.3. Аммонийно-нитратные удобрения.
Аммонийная селитра NH4NО3 содержит 34,5 – 35 % азота. Получается нейтрализацией азотной кислоты аммиаком. Белое кристаллическое вещество, хорошо растворимое в воде. Выпускается в гранулированном виде, поэтому сохраняет хорошую сыпучесть и рассеиваемость. Взрывоопасна. Хранить ее необходимо в сухом помещении, оборудованном противопожарными средствами. В аммонийной селитре удачно сочетаются быстродействующий нитратный азот с менее подвижным аммонийным. Из раствора NH4NО3 растения быстрее поглощают катион NH4+, чем анион NО3-, поэтому аммонийная селитра физиологически кислое удобрение, однако подкисляющее действие ее на почву выражено слабее, чем сульфата аммония. В почве аммонийная селитра взаимодействует с почвенным поглощающим комплексом, катион NH4+ хорошо поглощается почвой, а анион, NО3- остается в почвенном растворе, сохраняя высокую подвижность:
ППК) Ca ППК) Са Са
На почвах, насыщенных основаниями, в растворе образуются азотнокислые соли кальция (или магния) и почвенный раствор не подкисляется даже при систематическом внесении удобрения. Для этих почв аммонийная селитра – одно из лучших азотных удобрений. На кислых дерново-подзолистых почвах, содержащих в поглощенном состоянии мало кальция, в почвенном растворе образуется азотная кислота, вследствие чего он подкисляется. Для нейтрализации подкисляющего Действия 1 ц аммонийной селитры требуется 0,75 ц СаСО3. Однако подкисление это недолговременно, так как оно исчезает по мере потребления нитратного азота растениями. Для повышения эффективности аммонийной селитры на кислых почвах большое значение имеет их известкование. После известкования аммонийная селитра пригодна для разных типов почв и под все культуры севооборота, но наиболее эффективно использовать ее для весенних поверхностных подкормок зерновых культур, сенокосов и пастбищ. Можно применять ее и для подкормки пропашных, овощных, плодовых и ягодных культур с обязательной заделкой в почву. Под яровые аммонийную селитру в виде основного удобрения вносят весной под предпосевную культивацию во избежание потерь азота от вымывания. Универсальные свойства аммонийной селитры позволяют широко дифференцировать нормы, сроки и способы ее применения в зависимости от свойств почвы, погодно-климатических условий и особенностей возделываемых культур.
Амидные удобрения Мочевина (карбамид) CO(NH2)2 содержит 46 % азота и является самым концентрированным из твердых азотных удобрений. Получают синтезом из аммиака и диоксида углерода при высоких давлении и температуре:
2NH3 + СО2 = CO(NH2)2 + Н2О.
Белое кристаллическое вещество, хорошо растворимое в воде. Гигроскопичность кристаллической мочевины при температуре до 20°С сравнительно небольшая, но с повышением температуры заметно увеличивается и при хранении может слеживаться. Поэтому для улучшения физических свойств в настоящее время мочевина выпускается в гранулированном виде с содержанием биурета не более 1 %, который в таких концентрациях не оказывает вредного влияния на растения. В почве мочевина полностью растворяется почвенной влагой и под влиянием удобрений, выделяющих фермент уреазу, за два-три дня аммонифицируется и превращается в углекислый аммоний:
CO(NH2)2 + 2Н2О = (NH4)2CО3.
Углекислый аммоний – соединение непрочное, на воздухе разлагается с образованием бикарбоната аммония и газообразного аммиака:
(NH4)2CО3 → NH4HCО3+ NH3.
Поэтому при внесении мочевины без заделки в почву и отсутствии осадков часть азота в виде аммиака может теряться. Эти потери больше на почвах с нейтральной и щелочной реакциями. В почве углекислый аммоний подвергается гидролизу с образованием бикарбоната аммония и гидроокиси аммония NH4OH:
(NH4)2CО3+ H2О = NH4HCО3+ NH4OH.
Образующийся при внесении мочевины в почву аммоний поглощается ее коллоидной фракцией и постепенно усваивается растениями. Установлено, что мочевина может поглощаться корнями, а также листьями растений без предварительного превращения в углекислый аммоний. Однако пока мочевина не подверглась аммонификации, она может вымываться из почвы. По мере аммонификации мочевины возможно временное локальное подщелачивание почвы из-за гидролиза углекислого аммония. С течением времени аммоний подвергается нитрификации, образуя азотную кислоту и сдвигая реакцию в сторону подкисления:
2NH3+ 3О2= 2HNО2+ 2H2О,
2HNО2 + О2 = 2HNО3.
Таким образом, мочевина является биологически кислым удобрением. Для нейтрализации подкисляющего действия 1 ц карбамида требуется 0,83 ц СаСО3. Однако после усвоения азота мочевины растениями в почве не остается ни щелочных, ни кислых остатков. Поэтому она является физиологически нейтральным удобрением. Мочевина оказывает примерно такое же действие на урожай сельскохозяйственных культур, как и аммонийная селитра, но лучший эффект дает при непосредственной заделке в почву. Поверхностные подкормки озимых культур, лугов и пастбищ мочевиной менее эффективны по сравнению с аммонийной селитрой из-за потерь аммиака, а также более медленного действия мочевины, чем аммонийной селитры. Однако при внесении мочевины в подкормки по влажной почве потери азота значительно снижаются. Эффективны также некорневые подкормки зерновых культур в период вегетации, особенно при возделывании их по энергосберегающим технологиям, 5 – 10%-ными растворами мочевины с добавлением ретардантов, гербицидов и пестицидов. Для сахарной и столовой свеклы концентрация мочевины при некорневых подкормках рекомендуется 1,5 – 2,0 %, картофеля, капусты – 0,8 – 1,6 %, кукурузы, томата – 0,4 – 0,6 %, огурец – 0,3 – 034 %, лук – 1,6 – 2,5, сельдерей – 0,8 – 1,0 %, яблоня, вишня, слива – 0,6 – 1,8 %. Аммиачные удобрения
К жидким аммиачным удобрениям относятся безводный аммиак и аммиачная вода. Безводный аммиак NH3 является самым концентрированным и самым дешевым удобрением, содержит 82,3% азота. Получается сжижением газообразного аммиака под давлением. Бесцветная, подвижная жидкость, плотность 0,61 г/см3 при 20°С, температура кипения 34°С. При хранении в открытых сосудах NH3 быстро испаряется. Безводный аммиак обладает высокой упругостью паров, поэтому его хранят и транспортируют в стальных цистернах, выдерживающих высокое давление (30 – 32 атм). Он хорошо используется растениями и по эффективности не уступает твердым азотным удобрениям. Аммиак поглощается почвой и не вымывается, поэтому его можно вносить осенью или весной. Внесенный в почву безводный аммиак превращается из жидкости в газ, который адсорбируется коллоидной фракцией и поглощается почвенной влагой, образуя гидроксид аммония. Взаимодействуя с анионами почвенного раствора, аммоний образует различные соли и, вступая в физико-химическое взаимодействие с почвенными коллоидами, поглощается твердой частью почвы. Одновременно с физико-химическими превращениями аммиак подвергается нитрификации. Скорость и степень поглощения аммиака почвой зависит от содержания в ней гумуса, гранулометрического состава и влажности, а также от способа и глубины заделки удобрения. На более связных, богатых органическим веществом, хорошо обработанных и нормально увлажненных почвах аммиак поглощается лучше, чем на легких, бедных гумусом. В песчаных и супесчаных почвах образование аммонийных солей из аммиака и адсорбция иона аммония происходят медленнее, чем в суглинистых почвах. В связи с этим на легких почвах удобрение продолжительное время сохраняется в виде NH3 и может улетучиваться. Из влажной почвы аммиак улетучивается меньше, чем из сухой. В течение 12 – 15 дней после внесения аммиак подщелачивает, а затем (после перехода его в нитраты) подкисляет почву. Для нейтрализации подкисляющего действия 1 ц жидкого аммиака требуется 1,5 ц СаСО3. Чтобы избежать потерь азота, безводный аммиак заделывают на глубину 12 – 16 см на дерново-подзолистых суглинистых и на глубину 16 – 20 см на супесчаных почвах. Для внесения используют специальные машины АБА-0.5М, АБА-1, АША-2 и другие в агрегате с культиватором КРН-4,2. Безводный аммиак можно вносить в качестве основного удобрения и в подкормку с обязательной заделкой в почву. Водный аммиак, или аммиачная вода, содержит 20,5% азота в форме NH3 и NH4OH, причем аммиака содержится значительно больше, чем аммония. Этим и обусловлена возможность потерь азота вследствие улетучивания аммиака при перевозке, хранении и внесении. Поэтому хранят и транспортируют аммиачную воду в стальных герметичных цистернах. Во избежание потерь аммиака аммиачную воду заделывают на глубину 10 – 12 см на суглинистых и 14 – 18 см на супесчаных почвах. На связных почвах аммиачную воду, как и безводный аммиак, можно вносить осенью в качестве основного удобрения практически под все культуры при температуре почвы ниже +10°С, а также весной перед севом. На почвах легкого гранулометрического состава эти удобрения желательно вносить весной. Аммиачная вода, как и безводный аммиак, подкисляет почву. Для нейтрализации ее подкисляющего действия требуется 0,3 – 0,4 ц СаСО3. Аммиачную воду вносят специальными машинами (ПОУ) с приспособлением УЛП-8 для заделки в почву. Учитывая, что аммиак в почве перемещается на 10 – 12 см, для культур сплошного сева расстояние между сошниками (наконечниками) при внесении аммиачных удобрений должно быть не более 20 – 25 см, а для пропашных культур должно равняться ширине одного междурядья. Наиболее эффективно внесение этих удобрений вместе с органическими. Нельзя вносить аммиачные удобрения на одном участке несколько лет подряд, так как они усиливают минерализацию органического вещества, что может привести к снижению содержания последнего в почве. Безводный аммиак и аммиачная вода в Беларуси в настоящее время не применяются, так как сняты с производства.
Поиск по сайту: |
 + 2NaNO3
+ 2NaNO3 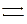 ППК)
ППК) 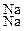 + Ca(NO3)2 ,
+ Ca(NO3)2 , + Са(NO3)2
+ Са(NO3)2  + 2НNO3 .
+ 2НNO3 .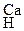 + (NH4)2SO4
+ (NH4)2SO4  + СаSО4.
+ СаSО4.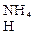 + НNО3.
+ НNО3.