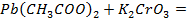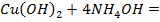|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Тест-комплект «Железо». ⇐ ПредыдущаяСтр 4 из 4
Состав тест-комплекта: бумага индикаторная универсальная; контрольная цветовая шкала; мерная склянка с пробкой; пипетка-капельница; растворы орто-фенантролина, буферный ацетатный, гидроксида натрия, соляной кислоты, солянокислого гидроксиламина. Проведение анализа: 1. Налить в склянку 10 мл анализируемого раствора, предварительно им же ополоснув 2-3 раза. С помощью универсальной индикаторной бумаги довести рН среды до рН 4-5 (прибавляя пипеткой раствор гидроксида натрия или соляной кислоты). 2. Добавить 4-5 капель раствора солянокислого гидроксиламина, 1,0 мл ацетатного буферного раствора и 0,5 мл раствора орто-фенантролина. После каждого добавления склянку закрывать пробкой и встряхивать. 3. Через 15-20 мин проведите визуальное колориметрирование пробы: склянку поместите на белое поле контрольной шкалы и определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение концентрации железа в мг/л. Тест-комплект «Активный хлор».Соединения, содержащие активный хлор, быстро распадаются, поэтому анализ проводится сразу после отбора пробы и длится не более 10 минут. Состав тест-комплекта: буферный раствор ацетатный (pH 4,5); калий йодистый; пипетки-капельницы; колба коническая на 100 мл; раствор тиосульфата натрия титрованный (0,0025 ммоль/л экв); раствор крахмала (0,5%); крахмал растворимый ГОСТ 10163-76 (в капсулах); хлороформ; шпатель; пипетка мерная со шприцом медицинским и соединительной трубкой. Проведение анализа при концентрации активного хлора 0,5-2,0 мг/л: 1. Налить в коническую колбу 50 мл анализируемого раствора, предварительно им же ополоснув 2-3 раза. 2. Добавить 1,0 мл ацетатного буферного раствора, перемешать. Добавить около 0,1 г (1/4 шпателя без горки) йодида калия, перемешать до растворения соли. При наличии активного хлора раствор приобретает желто-бурую окраску. 3. Набрать раствор тиосульфата в пипетку-капельницу и титровать пробу по каплям до слабо-желтой окраски раствора. После добавления каждой капли перемешивать покачиванием. Считать капли, добавляемые при титровании. 4. Добавить 0,5 мл раствора крахмала (раствор синеет) и продолжать титрование до полного обесцвечивания раствора. 5. Вычислить концентрацию активного хлора (САХ) в мг/л по формуле:
где: VTC = 0,04*N – количество раствора тиосульфата натрия, израсходованного на титрование, мл (N – количество капель); 0,089 – содержание остаточного активного хлора, эквивалентное содержанию в 1 мл раствора тиосульфата натрия с концентрацией 0,0025 моль/л экв; VПР – объем пробы воды, взятой для анализа, мл. При концентрации активного хлора более 2,0 мг/л титрование проводится не капельно, а по объему шприцом-дозатором. При концентрации активного хлора менее 0,5 мг/л проба раствора (воды) увеличивается до 250 мл и берется колба 500 мл (в комплект не входит). Тест-комплект «Нитриты».Продолжительность выполнения анализа не более 20 мин. Состав тест-комплекта: пробирка колориметрическая с пробкой; штатив для пробирок; реактив Грисса – 5,0 г (100 капсул по 0,05 г); контрольная цветовая шкала. Проведение анализа: 1. В колориметрическую пробирку налить 5 мл анализируемого раствора. 2. Добавить содержимое одной капсулы реактива Грисса. Закрыть пробирку пробкой и встряхивать до растворения кристаллов реактива. 3. Через 15-20 минут провести визуальное колориметрирование пробы. 3 ЛАБОРАТОРНЫЕ РАБОТЫ Лабораторная работа №1. Опыт 1. Определение содержания углекислого газа во вдыхаемом и выдыхаемом воздухе в городе (в помещении и на улице) Вводная информация: Углекислый газ (оксид углерода (IV), СО2) – газ, выделяемый в воздух всеми живыми существами. Кроме того, огромные количества этого газа выбрасываются в воздух при сгорании топлива при пожарах и т.п. Содержание СО2 в атмосфере непрерывно повышается в результате деятельности человека, что обуславливает потепление климата (парниковый эффект). Нормальное содержание СО2 в атмосфере составляет 0,03-0,04%, в то время как в выдыхаемом воздухе содержится около 4% этого газа. Оксид углерода (IV) не оказывает токсического действия на живые организмы (растения даже усваивают его в процессе фотосинтеза). Однако, находясь в избыточном количестве в воздухе аудитории, он вызывает у студентов снижение активности на уроке, повышенную утомляемость. А при концентрации СО2 на уровне 5% уже нельзя нормально работать и появляется угроза удушья (при соответствующем снижении концентрации кислорода). Таким образом, после выполнения данной работы вы сможете сами определить условия, при которых можно повысить результативность занятий, а также получить представление о естественном (фоновом) содержании СО2 в атмосфере и возможности его изменения в процессе антропогенной деятельности. Определение углекислого газа проводится по помутнению известковой воды с целью сравнения содержания данного компонента воздуха до и после дыхания. Уравнение химической реакции, которое объясняет помутнение известковой воды от воздействия воздуха, содержащего углекислый газ:
Помутнение объясняется образованием взвеси нерастворимого карбоната кальция. При дальнейшем пропускании воздуха либо при пропускании воздуха, содержащего большие концентрации углекислого газа, происходит реакция растворения карбоната кальция с образованием соответствующего гидрокарбоната:
Таким образом, помутнение исчезает быстрее (или исчезает вообще) в той колбе, через которую проходит выдыхаемый воздух. Эксперименты с индикаторными трубками проводятся ввиду простоты их применения для анализа воздуха и возможности получения количественной информации, а также хорошей наглядности экспериментов. С целью количественного определения концентрации углекислого газа как природного и техногенного компонента в составе воздуха проводятся демонстрационные опыты по анализу воздуха аудитории, улицы и т.п. Поправки на температуру и атмосферное давление при анализах не проводятся как малозначимые. Цель опыта: изучение относительного содержания углекислого газа в атмосферном и выдыхаемом воздухе пропусканием через известковую воду и с помощью индикаторных трубок. Оборудование и материалы:колбы конические на 50 мл с пробками и Г-образными газоотводными трубками – 2 шт.; отрезки резиновой трубки – 3 шт.; Т-образный стеклянный тройник; мундштук стеклянный; тампон; известковая вода; дезинфицирующий раствор; индикаторные трубки для определения углекислого газа; насос-пробоотборник; мешок полиэтиленовый объемом 3-5 л; термометр; секундомер.
Рис. 3. Прибор для определения состава вдыхаемого и выдыхаемого воздуха: 1 - мундштук, 2 - тройник, 3 - трубка резиновая,
Ход работы: 1. Сбор установки для изучения состава воздуха с помощью известковой воды. Соберите прибор, как показано на рис. 3; налейте в каждую коническую колбу на 1/4 объема известковой воды. Тщательно протрите мундштук тампоном, смоченным дезинфицирующим раствором. 2. Эксперимент с известковой водой. Сделайте подряд несколько вдохов и выдохов через мундштук. Наблюдайте за состоянием известковой воды в колбах. 3. Зафиксируйте результаты экспериментов в тетради. Сделайте вывод и напишите уравнения химических реакций, которые объясняют помутнение известковой воды и его последующее исчезновение. 4. Анализ воздуха индикаторными трубками (см. 2.3). Определите концентрацию СО2 в аудитории и на улице. Проведите анализ выдыхаемого воздуха: расправьте полиэтиленовый пакет из комплекта; сделайте выдох в пакет; зажмите горловину пакета рукой; приоткройте пакет и быстро поместите туда заранее приготовленную индикаторную трубку с насосом, после чего пакет снова зажмите рукой и проведите анализ. 5. Результаты анализа запишите в тетрадь в табличной форме. Сделайте выводы.
Опыт 2. Изучение состава атмосферных осадков и питьевой воды. Вводная информация: Дождевая (снеговая) вода обычно имеет слабокислые свойства. Происходит это, как правило, вследствие растворения в ней диоксида углерода СО2. Проблемы, связанные с кислотным или щелочным загрязнением атмосферной воды, происходят чаще всего из-за деятельности человека. Причиной возникновения кислотных дождей являются массовые промышленные выбросы оксида серы (IV) SO2 иоксидов азота NOx в атмосферу. В результате окисления этих веществ кислородом воздуха и взаимодействия с атмосферной влагой происходит образование азотистой (HNO2), азотной (HNO3), сернистой (H2SO3)и серной (H2SO4) кислот. Изменения кислотности воды водоема обычно могут вызвать загрязнения воздуха кислотными примесями, которые «вымываются» из воздуха дождями и попадают в водоем, а также загрязнения промышленными сточными водами. Кислотность природной воды может определяться также характером почвогрунтов ландшафта, в котором расположен водоем. Кислотность воды определяется значением водородного показателя (рН), который для природных вод обычно имеет значения от 6,5 до 8,5. Изменение рН природной воды сверх этих пределов создает среду, непригодную для существования большинства водных организмов, особенно простейших. Качество природной воды в значительной степени определяется концентрацией растворенных в ней минеральных солей. Можно выделить два больших класса минеральных солей, которые встречаются в природной воде в значительных концентрациях (см. табл. 1). Основной вклад в общее солесодержание вносят соли 1-го класса, которые следует определять в первую очередь. Соли 2-го класса также необходимо учитывать при оценке качества воды, т.к. на каждую из них установлено значение ПДК, хотя они вносят незначительный вклад в общее солесодержание природных вод. Концентрации растворенных в воде минеральных солей определяют методами аналитической химии. В первую очередь нарушенный минеральный состав воды сказывается на жизнедеятельности простейших организмов. Повышенная концентрация солей в воде пагубно сказывается на минеральном составе окружающей водоем почвы, вызывая ее засоление, как в процессе впитывания воды почвой, так и при орошении такой водой сельскохозяйственных полей. Источниками обогащения природной воды минеральными солями являются: посыпаемые солями зимой улицы городов и дороги; поля и газоны после применения на них минеральных удобрений; неочищенные сточные воды и рассолы, сбрасываемые промышленными предприятиями, и др. Повышенная концентрация солей ухудшает вкус питьевой воды. При концентрациях солей, превышающих соответствующие ПДК, вода становится непригодной для питья и использования на хозяйственные нужды.
Таблица 1 Основные компоненты, создающие минерализацию
Примечание: ПДК приведены для воды поверхностных источников хозяйственно-питьевого назначения.
Жесткость воды – одно из важнейших свойств, имеющее большое значение при водопользовании. Если в воде находятся ионы металлов, образующие с мылом нерастворимые соли жирных кислот, то в такой воде затрудняется образование пены при стирке белья или мытье рук, в результате чего возникает ощущение жесткости. К солям жесткости относятся, главным образом, соли кальция (Са+) и магния (Mg2+). Жесткость, обусловленная присутствием в воде гидрокарбонатов (HCO3–), называется временной, или карбонатной. Она устраняется при кипячении воды (точнее, при температуре более 60°С):
Жесткость, обусловленная присутствием хлоридов (Сl–) или сульфатов На правильность полученных результатов анализов влияет способ отбора пробы воды (осадков, питьевой) и условия ее хранения. Проба должна быть отобрана в чистую стеклянную или пластмассовую бутыль объемом не менее 0,5 л (в бутыли должно остаться не более 5-10 мл воздуха); пробы следует анализировать в течение нескольких часов после отбора либо хранить в холодильнике. Цель опыта: изучение и анализ состава атмосферных осадков и питьевой воды, методов устранения жёсткости воды. Оборудование и материалы:ложка, ножницы, пинцет, пробирки, штатив для пробирок, пипетка, держатель для пробирок, спиртовка, спички; раствор йода, раствор дифениламина в концентрированной серной кислоте, раствор соли бария (насыщенный), раствор соляной кислоты (1:5), раствор нитрата серебра (1%), раствор мыла; проба осадков (дождевая или талая вода), проба питьевой воды (водопроводная или минеральная), тест-комплект или тест-система «рН», тест-комплекты «Общая жесткость», «Хлориды», «Нитраты», «Сульфаты». Ход работы: Качественные реакции проводят в пробирках, наполняя их исследуемыми пробами воды до метки «5 мл», предварительно ополоснув исследуемой водой. Количественные измерения выполняют с применением тест-комплектов согласно инструкциям к ним (см. 2.4.). 1. Демонстрация жесткости воды. Добавьте в пробирки с модельными образцами жесткой воды (временная и постоянная жесткость) по 1 мл раствора мыла. Опишите наблюдаемое. 2. Демонстрация устранения временной жесткости. Налейте в пробирку модельную воду с временной жесткостью и доведите воду до кипения с помощью горелки. В случае образования осадка после кипячения дайте ему отстояться, а раствор перелейте в другую пробирку. С помощью раствора мыла убедитесь, что жесткость устранена. 3. Демонстрация устранения постоянной жесткости. В пробирку, содержащую модельную воду с постоянной жесткостью и раствор мыла, добавьте 2-3 мл раствора соды и встряхните пробирку. Опишите наблюдаемое и напишите уравнение реакции. 4. Определение рН исследуемых проб воды (осадков, питьевой). Проводится с помощью тест-комплекта «рН» или тест-системы «рН». 5. Определение жесткости исследуемых проб воды. Определите общую жесткость с помощью тест-комплекта «Общая жесткость». Устраните временную жесткость, как описано выше. Определите оставшуюся (постоянную) жесткость с помощью тест-комплекта «Общая жесткость». 6. Обнаружение хлорид-ионов. Добавьте в пробирки с исследуемыми пробами по каплям раствор нитрата серебра. При наличии хлорид-ионов наблюдается выпадение белого творожистого осадка или помутнение раствора (если содержание хлорид-ионов незначительно). В этом случае проведите количественный анализ с помощью тест-комплекта «Хлориды». 7. Обнаружение нитрат-ионов. Добавьте в пробирки с исследуемыми пробами 2-3 капли раствора дифениламина. При наличии нитрат-ионов раствор окрашивается в синий цвет. В этом случае проведите количественный анализ с помощью тест-комплекта «Нитраты». 8. Обнаружение сульфит-ионов. Добавьте в пробирки с исследуемыми пробами 10 капель раствора соляной кислоты (1:5) и 1-2 капли раствора йода. При наличии сульфит-ионов раствор обесцвечивается. 9. Обнаружение сульфат-ионов. Добавьте в пробирки с исследуемыми пробами 10 капель раствора соляной кислоты (1:5) и 2 капли раствора соли бария. При наличии сульфат-ионов в течение 3 мин раствор мутнеет. Количественное определение содержания сульфат-ионов при необходимости выполните с помощью тест-комплекта «Сульфаты». 10. Зафиксируйте результаты экспериментов в тетради в табличной форме. Используя полученные результаты экспериментов, сделайте вывод о возможных источниках загрязнения осадков и питьевой воды. Напишите соответствующие уравнения химических реакций.
Опыт 3. Изучение состава почвы. Вводная информация: Почва, или верхний поверхностный слой земной коры, формируется под воздействием различных факторов: почвообразующей породы, климата, жизнедеятельности растительных и животных организмов, антропогенных процессов и др. Характерным свойством почвы, отличающим ее от различных грунтов и пород, является плодородие. Одним из необходимых условий плодородия почвы является содержание в ней органического вещества, или гумуса. Не случайно почвы, содержащие много гумуса, называют богатыми. Источником формирования органического вещества в почве являются растительные остатки и, в меньшей степени, остатки микрофауны и макрофауны. Состав и содержание органического вещества в почве изменяются в процессе почвообразования. Простейший способ, с помощью которого можно определить примерное содержание в почве органического вещества, основан на его относительной легкости. В отличие от минеральных частиц, которые тонут при погружении образца почвы в воду, частицы органического вещества всплывают к поверхности, приводя к расслаиванию взвеси. Кислотность почвы – важный экологический фактор, определяющий условия жизнедеятельности почвенных организмов и высших растений, а также аккумуляцию и подвижность загрязнителей в почве (в первую очередь металлов). При высокой кислотности угнетается рост и развитие многих сельскохозяйственных культур, подавляется жизнедеятельность микроорганизмов. При высокой кислотности почвы необходимо проводить ее известкование. Кислотность почвы определяют, измеряя величину рН солевой вытяжки. В зависимости от величины рН почва может быть кислой, нейтральной или щелочной: рН=4 и менее – сильнокислая; рН=5 – кислая; рН=6 – слабокислая; рН=7 – нейтральная; рН=8 и более – щелочная. Засоленность почвы характеризуется повышенным содержанием легкорастворимых минеральных солей, что неблагоприятно сказывается на физических и химических свойствах почвы и создает неблагоприятные условия для развития и роста многих растений. Сильнозасоленные почвы обычно непригодны для выращивания сельскохозяйственных культур. У растений, произрастающих на засоленных почвах, задерживаются набухание семян, цветение, рост, снижается урожайность. При больших концентрациях солей наступает гибель растений. Наиболее вредное влияние оказывают карбонаты, хлориды и сульфаты натрия и калия. При выявлении сильного засоления почв сельскохозяйственных угодий необходимо проводить специальные гидромелиоративные мероприятия (орошение, дренаж, промывка). Цель опыта:изучение экологического состояния почвы через оценку количества органических веществ, кислотности, засоленности. Оборудование и материалы: лабораторный стакан объемом 1 л, пинцет, пипетка-капельница, пробирка, лупа, стекло предметное, линейка, ложка. спиртовка, спички, вода чистая, образцы почвы, почвенная солевая и водная вытяжки; тест-система или тест-комплект «рН». Ход работы: 1. Определение относительного богатства почвы органическими веществами. В стакан поместите образец почвы объемом около 0,3 л. Залейте его водой и доведите уровень воды в сосуде до объема немного менее 1 л. Содержимое колбы взболтайте для смачивания почвы и выхода пузырьков воздуха. Добавьте воду к взвеси, доведя объем до 1 л. Дождитесь расслоения взвеси, после чего измерьте линейкой значения высоты слоев отстоявшейся и всплывшей почвы линейкой. Проведите этот эксперимент для всех образцов почвы. 2. Опишите наблюдаемое. Объясните, почему часть почвы всплыла, а другая часть опустилась на дно сосуда в виде осадка. Результаты измерений высоты слоев почвы для каждого образца занесите в таблицу. Рассчитайте коэффициент содержания органических веществ:
Рис. 4. Измерение высоты слоев всплывшей и отстоявшейся почвы
3. Определите рН солевой почвенной вытяжки для каждого образца с помощью тест-комплекта или тест-системы «рН». Внесите в таблицу описание внешнего вида солевой вытяжки, рН и кислотность почвы. 4. Определение засоленности почвы по солевому остатку. Нанесите 1 каплю почвенной водной вытяжки на предметное стекло и осторожно нагревайте до испарения влаги, не допуская перегрева стекла во избежание его растрескивания. Рассмотрите сухой солевой остаток на стекле невооруженным глазом и в лупу. Повторите эксперимент для каждого образца. Зарисуйте наблюдаемый солевой остаток в каждом случае. 5. Сопоставьте данные таблицы и сделайте вывод о состоянии почвы на основе полученных результатов.
Контрольные вопросы 1. Химический состав атмосферного воздуха. Углекислый газ, его место в круговороте углерода и влияние на живые организмы. 2. Природные и антропогенные источники углекислого газа. 3. Требования к концентрации углекислого газа в воздухе. Экологические проблемы, связанные с повышением концентрации углекислого газа. 4. Классификация природной воды по степени минерализации. До какой степени минерализации вода считается пресной? 5. Жесткость воды: постоянная, временная, общая. Какими солями обусловлен каждый вид жесткости? Способы устранения жесткости. 6. Экологические проблемы, связанные с пресной водой. 7. Состав и структура почвы. Факторы почвенного плодородия. 8. Влияние кислотности и засоления почвы на растения и почвенные микроорганизмы. Лабораторная работа №2. Опыт 1. Оценка качества продуктов питания по содержанию в них нитратов. Вводная информация: Проблема загрязнения продуктов питания нитратами (повышенное содержание нитратов в продуктах питания) актуальна для оценки качества различных овощей, фруктов, соков. Эта проблема возникла сравнительно недавно, в связи с развитием знаний о причинах онкологических заболеваний. Загрязнение почв и поверхностных вод соединениями азота обусловлено не столько глобальными процессами их образования в атмосфере, сколько бесконтрольным использованием азотных удобрений (в основном нитратов) в сельском хозяйстве. Нитрат-анион очень подвижен в естественных условиях, так как нитраты хорошо растворимы в воде и не связываются частицами почвы. Говоря о нитратах, мы подразумеваем, в основном, растворимые соли азотной кислоты с катионами Na+, К+, Са2+, Mg2+. Нитраты являются естественным компонентом почвенного раствора. Попадая в растения, они частично усваиваются и становятся естественным компонентом тканей организма. Нитраты являются легкорастворимыми солями (в 1 л воды или почвенной влаги при 20°С может раствориться до 88 г NaNO3 или 126 г Ca(NO3)2), и легко разносятся грунтовыми водами. Нитратные удобрения (аммиачная, калийная и натриевая селитры) следует вносить в почву, строго соблюдая агротехнические рекомендации. В противном случае основная масса нитратов попадает в водоемы, вызывая их загрязнение и ускоренную эвтрофикацию. По этой причине внесение нитратных удобрений в почву, имеющее часто неконтролируемый характер, ученые называют намеренным загрязнением окружающей среды. Существует несколько механизмов токсического воздействия нитратов на организм человека. Сами по себе нитраты относительно малотоксичны (относительно других распространенных токсикантов), но в биологической среде в результате биохимических реакций они превращаются в нитриты, или соли азотистой кислоты (HNO2). Нитриты далее в желудочно-кишечном тракте человека (в кислой среде) взаимодействуют с соединениями, имеющими вторичные аминогруппы, и превращаются в N-нитрозоамины[1], которые являются канцерогенными соединениями, т.е. способствуют образованию злокачественных опухолей. Процесс образования N-нитрозоаминов можно приближенно описать следующей схемой:
Нитриты токсичнее нитратов в 450 раз. Поступая в кровь, взаимодействуют с гемоглобином крови и блокируют его дыхательную функцию, превращая часть гемоглобина в метгемоглобин, не способный переносить кислород от легких к тканям. При образовании большого количества метгемоглобина (30-40%) возникает кислородное голодание тканей, что может вызвать поражение центральной нервной системы. При содержании в крови метгемоглобина 15-20% у человека возникает легкая слабость, головная боль, синюшность. Таким образом, бороться надо не с нитратами, а с нарушениями агротехнических норм и правил, приводящими к загрязнению окружающей среды и избыточному содержанию нитратов в продуктах. Кроме того, превращение нитратов в тканях овощей и фруктах протекает, как и любая химическая реакция, во времени. Поэтому для «самоочищения» овощей и фруктов от нитратов существенным является срок хранения. Так, зимой и особенно весной нитраты в количествах, превышающих ПДК, можно встретить лишь в свежей зелени. Полезно привести следующие справочные данные: смертельная доза нитратов для человека составляет 8-15 г; допустимое суточное потребление – не более 5 мг на 1 кг веса человека. ПДК нитратов в воде водоемов – 45 мг/л; в почве – 130 мг/кг (класс опасности 3). Данные о допустимом содержании нитратов в овощах и фруктах приведены в табл. 2.
Таблица 2 Предельно допустимые уровни содержания нитратов в продуктах растительного происхождения (СанПиН 42-123-4619-88)
Цель опыта:оценка качества продуктов питания и формирование навыков рационального потребления продуктов на основе сведений о содержании в них нитратов. Оборудование и материалы: ножницы, пинцет, скальпель, чашка Петри, овощи, фрукты, зелень, минеральная или питьевая вода, соки, тест-система «Нитрат-тест». Ход работы: 1. Подготовьте к тестированию овощи, фрукты и зелень, надрезав их. Опишите внешний вид каждого из продуктов, отметив свежесть, яркость окраски, наличие пятен, плесени. По возможности определите вкус и привкус (сладкий, кислый, горький, пресный и т.п.). Нарежьте объект кусочками так, чтобы выступил сок. 2. Проведите тестирование выделившегося сока с помощью тест-системы «Нитрат-тест». 3. Результаты наблюдений зафиксируйте в тетради в табличной форме. Сделайте вывод о пригодности исследуемых продуктов и напитков для питания.
Опыт 2. Воздействие неблагоприятных факторов среды на организм человека. Вводная информация. В качестве индикатора последствий для организма человека воздействия химических факторов служат амилазы – химические соединения, относящиеся к классу ферментов. Амилазы содержатся в слюне человека. Как и другие ферменты, амилазы имеют белковую природу и проявляют каталитические свойства, влияют на скорость биохимических реакций. Активность амилаз обусловлена их способностью ускорять реакцию гидролиза содержащегося в слюне крахмала. В ответ на воздействие повышенной кислотности как химического фактора происходит снижение активности амилаз. рН-оптимум ферментов слюны человека составляет 6,8-7,0. Получаемые в практикуме результаты соответствуют зоне оптимума (контрольная пробирка) и экстремальным зонам (опытные пробирки). Курение считается вредной привычкой в силу воздействия на организм нескольких факторов. Одним из них является попадание в организм содержащегося в растениях табака (а следовательно, и в сигаретах) никотина. Для организма человека никотин является вредным воздействующим химическим фактором. Одним из проявлений вредного влияния никотина при курении является ухудшение способности слюны к гидролитическому расщеплению крахмала. Это ухудшение может быть вызвано как снижением активности содержащихся в слюне ферментов амилаз, так и снижением их концентрации в слюне из-за пониженной секреции (выделения ферментов в слюну особыми железами). Антибиотики способны в малых дозах оказывать избирательное токсическое действие на микроорганизмы и клетки. Продающиеся в аптеках антибиотики (например, олететрин, эритромицин) также вызывают снижение активности ферментов слюны амилаз к гидролитическому расщеплению крахмала. Цель опыта:изучение влияния факторов кислотности, щелочности, никотина и антибиотиков на активность ферментов слюны – амилаз. Оборудование и материалы: пипетки-капельницы, пронумерованные пробирки с метками – 5 шт, штатив для пробирок, стакан на 200 мл, раствор слюны курящего и некурящего человека, раствор крахмала, раствор йода, раствор соляной кислоты (1:10), раствор гидроксида натрия (0,5%), раствор антибиотика, чистая теплаявода, тест-система «рН». Ход работы: 1. Налейте в пробирку №1 (контрольную) до первой метки раствор слюны, до второй – воду, до третьей – раствор крахмала. 2. Налейте в пробирку №2 до первой метки – раствор слюны, до второй – раствор соляной кислоты, до третьей – раствор крахмала. 3. Налейте в пробирку №3 до первой метки – раствор слюны, до второй – раствор гидроксида натрия, до третьей – раствор крахмала. 4. Налейте в пробирку №4 до первой метки – раствор слюны курильщика, до второй – воду, до третьей – раствор крахмала. 5. Налейте в пробирку №5 до первой метки – раствор слюны, до второй – раствор антибиотика, до третьей – раствор крахмала. 6. Поставьте все пробирки в стакан с теплой водой на 10 мин для протекания биохимической реакции гидролиза крахмала. 7. С помощью тест-системы «рН» определите значение рН растворов во всех пробирках. Запишите полученные результаты в тетрадь. 8. Добавьте в каждую пробирку по 2 капли раствора йода. Для предотвращения взаимодействия йода со щелочью нейтрализуйте содержимое пробирки № 3, внося по каплям в пробирку раствор соляной кислоты (2-4 капли), контролируя результат с помощью тест-системы «рН». 9. Наблюдайте за окраской растворов во всех пробирках. Зафиксируйте выполненные эксперименты в тетради в табличной форме. Охарактеризуйте активность ферментов слюны по изменению интенсивности или исчезновению окраски раствора. тетради. Сделайте вывод о воздействии неблагоприятных факторов среды на активность ферментов слюны по их способности к расщеплению крахмала.
Опыт 3. Влияние неблагоприятных факторов среды на свойства белка Вводная информация: Под влиянием внешних факторов (изменение температуры, солевого состава среды, рН, действия радиации) химические связи в макромолекуле белка разрываются, и структура белка, а следовательно, и его свойства меняются. Этот процесс называется денатурацией. Денатурация может быть обратимой и необратимой. Алкоголь (винный, он же этиловый спирт) действует на нервные клетки, подавляя передачу нервных сигналов. Это ухудшает в целом работу мозга, искажает скоординированность движений. Отрицательно воздействует алкоголь и на сердечнососудистую систему. В этом – пагубное действие алкоголя на организм в целом и его функции. Спирт работает в организме также на молекулярном уровне, представляя особую опасность для микроорганизмов и клеток как химический яд. Спирт может изменить структуру белка, вызвать его денатурацию. Но в этом состоит и полезное свойство спирта как дезинфицирующей жидкости. Под воздействием солей также может происходить обратимая или необратимая денатурация белка. Вредное влияние загрязнений окружающей среды солями сказывается, преимущественно, на простейших организмах, составляющих основу пищевых цепей в живой природе. Если окружающая среда загрязняется солями тяжелых металлов (например, меди, свинца, кадмия и т.п.), возникают также медико-экологические проблемы, связанные с повышенной заболеваемостью населения. Цель опыта: изучение денатурации белка под влиянием неблагоприятных факторов среды. Оборудование и материалы:пипетки-капельницы, пронумерованные пробирки – 7 шт., штатив для пробирок, раствор соляной кислоты (1:5), раствор гидроксида натрия (10%), раствор азотной кислоты (1:3), раствор сульфата аммония (насыщенный), раствор сульфата меди (II) (насыщенный), этиловый спирт (96% или одеколон), раствор яичного белка, чистая вода, тест-система «рН». Ход работы: 1. В каждую из семи пробирок налейте по 2 мл раствора яичного белка. 2. Налейте, используя разные пипетки: в пробирку №1 (контрольную) – 2 мл воды; в пробирку №2 – 2 мл раствора азотной кислоты; в пробирку №3 – 2 мл раствора соляной кислоты; в пробирку №4 – 2 мл раствора гидроксида натрия. 3. С помощью тест-системы «рН» определите кислотность в пробирках №1-4. Запишите в тетради значения рН, внешний вид и состояние растворов. Сделайте вывод о влиянии кислотности среды на свойства белка. 4. В пробирки №2 и №3 по каплям добавляйте раствор гидроксида натрия, тщательно взбалтывая после добавления каждой капли, до тех пор, пока раствор не станет полностью прозрачным. В пробирку №4 аналогичным образом добавьте раствор соляной кислоты. Определите рН полученных растворов. Зафиксируйте результаты в тетради. Сделайте вывод об обратимости процесса изменения свойств белка при изменении кислотности. 5. В пробирку №5 добавьте этиловый спирт до появления осадка. Добавьте 1-2 мл воды и перемешайте. Растворился ли осадок? Зафиксируйте результаты в тетради. Сделайте вывод о воздействии алкоголя на белок. 6. В пробирку №6 добавьте по каплям раствор сульфата аммония до образования осадка и перемешайте. Добавьте 2 мл воды и снова перемешайте. Растворился ли осадок? 7. В пробирку №7 добавьте по каплям раствор сульфата меди до образования осадка и перемешайте. Добавьте 2 мл воды и снова перемешайте. Растворился ли осадок? 8. Зафиксируйте результаты в тетради. Сделайте вывод о воздействии нейтральных солей и солей тяжелых металлов на белок.
Контрольные вопросы 1. Причины повышенного содержания нитратов в продуктах питания. 2. Влияние повышенного содержания нитратов на организм человека. 3. Как можно уменьшить содержание нитратов в потребляемых продуктах? 4. Ферменты, их биологические функции в организме. Влияние рН среды на активность ферментов. 5. Никотин как негативный фактор среды, его воздействие на организм. 6. Достоинства и недостатки антибиотиков. Их влияние на микроорганизмы и на здоровье человека. 7. Белки, их химическая структура и свойства. Роль белков для живых организмов. 8. Обратимая и необратимая денатурация белка. Влияние кислотности среды, водоотнимающих веществ и нейтральных солей на свойства белка. 9. Как действуют на белки соли тяжелых металлов? Как может отражаться на здоровье человека присутствие в воде и пищевых продуктах солей тяжелых металлов? Лабораторная работа №3 Внимание:рекомендуется начинать работу с выполнения п.1 опыта 2 и п.1 опыта 6 (вариант 2), поскольку для этих опытов необходима длительная экспозиция. Опыт 1. Изучение запыленности воздуха в помещении и на улице. Вводная информация: Запыленность воздуха – важнейший экологический фактор, сопровождающий нас повсюду. Пылью считаются любые твердые частицы, взвешенные в воздухе. Безвредных пылей не существует. Экологическая опасность пылей для человека определяется их природой и концентрацией в воздухе. В 1 см3 воздуха в закрытом помещении может содержаться до 106 пылинок различного размера, природы и степени опасности. Пыли можно подразделить на две большие группы: мелкодисперсная пыль состоит из легких и подвижных частиц, крупнодисперсная пыль – из тяжелых и малоподвижных частиц. Отложения пыли являются источником вторичного загрязнения воздуха. Способность пылей растворяться в воде или кислотах позволяет определять их химическую природу. Например, силикатная пыль (песок) не растворяется ни в воде, ни в растворах кислот, в то время как карбонатная пыль (известняк) растворяется в разбавленной соляной кислоте, но не растворяется в воде. Зеленые насаждения выполняют самые различные функции, важнейшими из которых являются оздоровление воздушного бассейна города и улучшение микроклимата. В литературе приводятся следующие данные, характеризующие способность зеленых насаждений оздоровлять воздушную среду. Так, один гектар леса в течение года очищает от пыли и многих вредных примесей более 18 млн. м3 воздуха; деревья и кустарники, произрастающие на площади 1 га, улавливают за сезон до 60 т пыли. Очищая от пыли воздух, деревья и кустарники собирают ее, главным образом, на своих листьях. Поэтому изучение содержания пыли на листве из различных мест может дать ценную информацию о чистоте воздушной среды. В данной работе вы получаете сравнительную информацию о запыленности зеленых насаждений, используя свойства липкой прозрачной ленты собирать на себя частички пылевых загрязнений, в результате чего они становятся хорошо различимыми. Для характеристики сравнительной запыленности можно воспользоваться шкалой относительных единиц – баллов (табл. 3).
Таблица 3 Относительная шкала для оценки степени запыленности поверхности
Цель опыта:изучение состава и свойств пылей, встречающихся в помещении и на улице, изучение сравнительной запыленности. Оборудование и материалы:пипетка-капельница, скальпель, стекла покровные, стекла предметные, микроскоп, раствор соляной кислоты (10%), вода дистиллированная или чистая кипяченая, скотч, листы писчей бумаги. Ход работы: 1. Приготовление микропрепаратов сухой пыли. В помещении (аудитории) соберите скальпелем образцы пыли в двух-трех местах, например на мебели, на поверхности пола, на листьях комнатных растений. Пыль каждого образца поместите на два предметных стекла и накройте покровными стеклами. 2. Рассмотрите микропрепараты (по одному каждого образца) под микроскопом при увеличении «х56» или «х80» раз. Опишите форму, размеры, цвет пылинок. Мысленно разделите по величине частицы на три группы и сосчитайте их количество. Зафиксируйте результаты в табличной форме. Сравните образцы по количеству, характеру и составу частиц. 3. На рассмотренные микропрепараты сухой пыли, подняв покровное стекло, нанесите по 1-2 капли воды. Сразу же накройте смоченные микропрепараты покровными стеклами. Рассмотрите смоченные микропрепараты под микроскопом, опишите и объясните изменения, происходящие с пылью в воде. Зафиксируйте результаты экспериментов. 4. Аналогичным образом смочите неиспользованные микропрепараты сухой пыли раствором соляной кислоты. Рассмотрите микропрепараты под микроскопом, опишите и объясните изменения, происходящие с пылью в растворе кислоты. При объяснении учитывайте, какие соединения могуг растворяться в растворе соляной кислоты. Зафиксируйте результаты экспериментов. Сделайте выводы о составе и свойствах (в том числе о химической природе) пылей, отобранных для изучения.
5. Соберите листья с деревьев на разных участках городской территории (у дороги, у жилых домов, в парке) и, по возможности, на разной высоте. Приложите к поверхности листьев клейкую ленту (скотч). Снимите пленку с листьев вместе со слоем пыли и приклейте ее на лист белой бумаги, подписав место произрастания растения, высоту нахождения каждого листа. 6. Оцените степень запыленности по пятибалльной шкале. По результатам наблюдений заполните таблицу. Сделайте вывод о сравнительной степени и причинах запыленности территории города.
Опыт 2. Влияние загрязнения воздуха на живые организмы. Вводная информация: Можно прожить около месяца без еды, несколько дней без воды, но без воздуха не проживешь и несколько минут. Мы редко думаем об океане газа без цвета и запаха вокруг нас. И о более 14 кг воздуха, которые проходят через наши легкие за день, мы думаем не больше, чем рыба о воде, в которой плавает. Главные виновники химических загрязнений воздуха – промышленность и хозяйственная деятельность человека, связанная со сжиганием горючих материалов, включая автотранспорт и теплоэлектростанции. К примеру, среднегодовая концентрация аммиака в крупном городе может превысить санитарную норму в 1,5 раза. Аммиак (NH3) представляет собой бесцветный газ с характерным резким запахом «нашатырного спирта». Он легче воздуха и очень хорошо растворяется в воде. При высоких концентрациях в воздухе (0,5% объема и более) аммиак сильно раздражает слизистые оболочки, вызывает поражение глаз? расстройство пищеварения, катары верхних дыхательных путей и ослабление слуха. Негативное влияние загрязненный аммиаком воздух оказывает и на растения, вызывая хорошо заметные изменения в растительных тканях. Тем не менее, аммиак, при внесении его в почву в виде водного раствора и в химически связанном виде, является удобрением. Цель опыта: изучение загрязненности воздуха вредными химическими веществами. Оборудование и материалы: мешок полиэтиленовый объемом 3-5 л, пипетка-капельница, ножницы, колба 500 мл с пробкой, флакон 30 мл, бумажный фильтр, скотч, листья или побеги растения, аммиачная вода, секундомер, тест-система «Аммиак». Ход работы: 1. Соберите прибор для оценки влияния аммиака на растения, как показано на рис. 5: на дно колбы положите бумажный фильтр и.; лист или побег растения закрепите во флаконе и осторожно опустите флакон в колбу; внесите в колбу 3-4 капли аммиачной воды, быстро и герметично закройте колбу пробкой.
Рис. 5. Установка для исследования влияния повышенного содержания аммиака в атмосфере на растения
2. Подготовьте полоску тест-системы «Аммиак»: срежьте поперек упаковки ножницами не более 2 мм индикаторной полоски и прикрепите ее к ленте скотча. 3. Поместите в расправленный полиэтиленовый мешок 1-2 капли аммиачной воды, герметично закройте его и для насыщения воздуха аммиаком выдержите 3-5 мин. 4. Поместите подготовленную полоску в мешок и снова загерметизируйте его (полоска не должна соприкасаться с каплей аммиачной воды). Отметьте время начала эксперимента пуском секундомера. 5. Отмерьте по секундомеру время появления синего порогового окрашивания (индикационного эффекта). Оцените уровень концентрации аммиака в зависимости от времени возникновения пороговой окраски по таблице:
6. Занесите полученные результаты в тетрадь в табличной форме. Проанализируйте полученные результаты и сделайте выводы об уровне загрязненности воздуха аммиаком. Используя данные о ПДК аммиака (среднесуточная – 0,04 мг/м3; максимально разовая – 0,2 мг/м3), ответьте на вопрос: допустима ли такая загрязненность воздуха аммиаком? 7. В конце занятия зафиксируйте в тетради изменения, происшедшие с листом или побегом, сделайте вывод о влиянии аммиака на растения. Запишите уравнение образования «щелочного» дождя из аммиака.
Опыт 3. Методы обнаружения тяжелых металлов в окружающей среде. Вводная информация: В земной коре и в почве встречаются все химические элементы, в том числе так называемые «тяжелые» металлы: ртуть, свинец, кадмий, медь, железо и др. В результате деятельности человека уже на протяжении многих десятков и сотен лет происходит поступление тяжелых металлов в биосферу, что привело к значительному увеличению содержания этих элементов в окружающей среде. Загрязнение водоемов, почвы и продуктов питания тяжелыми металлами представляет серьезную угрозу для здоровья людей. Проводимые в данной работе эксперименты позволяют ознакомиться с качественными реакциями на ионы распространенных в почвах и водоемах тяжелых металлов – свинца, меди, железа. Цель опыта: ознакомление с методами обнаружения тяжелых металлов в окружающей среде. Оборудование и материалы: пробирки, штатив для пробирок, пипетки-капельницы, петля из нихромовой проволоки, пинцет, спиртовка; растворы солей 5%-ные: хлорида калия или натрия, йодида калия, хромата калия, железистосинеродистого калия, железосинеродистого калия, роданида калия или аммония, раствор аммиака (10%); модельные растворы, содержащие свинец (ацетат свинца), медь (сульфат меди), железо II (сульфат железа) и железо III (хлорид железа). Ход работы: 1. В три пробирки пипеткой налейте по 3-4 мл модельного раствора свинца; добавьте в первую пробирку 1 мл раствора хлорида натрия или калия, во вторую – 1 мл раствора йодида калия, в третью – 1 мл раствора хромата калия. Результаты зафиксируйте в табличной форме. 2. В пробирку пипеткой налейте 2-3 мл модельного раствора меди; Прокалите в пламени спиртовки петлю из нихромовой проволоки докрасна, окуните петлю в раствор меди и вновь внесите ее в пламя. Наблюдайте изменения пламени. Добавьте в пробирку 2-3 мл (избыток) раствора аммиака, перемешайте содержимое пробирки. В другую пробирку налейте 3-4 мл модельного раствора меди и добавьте 1 мл раствора железистосинеродистого калия. Результаты зафиксируйте в табличной форме. 3. В две пробирки налейте по 3-4 мл модельного раствора железа (III); добавьте в первую пробирку 1 мл раствора железистосинеродистого калия, во вторую – 1 мл раствора роданида калия или аммония. В третью пробирку налейте 3-4 мл модельного раствора железа (II) и добавьте 1 мл раствора железосинеродистого калия. Результаты зафиксируйте в табличной форме. 4. Допишите уравнения проведенных качественных реакций.
Опыт 4. Экспресс-анализ загрязнений сточных вод и водоемов. Вводная информация: В наше время качество воды стало проблемой, волнующей всех. К сожалению, не все вещества, которые могут растворяться в воде, полезны или хотя бы безвредны для здоровья. Высокие концентрации веществ, содержащих железо, придают воде плохой вкус и вызывают нежелательные отложения в трубах. Соединения, содержащие серу, придают воде неприятный запах. Вещества, содержащие такие элементы, как ртуть, свинец, кадмий и мышьяк, могут растворяться в воде и даже в малых концентрациях опасны для здоровья людей. Даже солнечный свет может вызвать образование потенциально вредных веществ при освещении хлорированной воды, если она содержит некоторые примеси. Предельно допустимые концентрации некоторых загрязнителей в воде хозяйственно-бытового назначения приведены в табл. 4. Модельные загрязнения (искусственно приготовленные образцы) воды моделируют сточные воды с их типичными загрязнителями.
Таблица 4 Нормативы качества воды по некоторым показателям
Цель опыта: изучение загрязнений природной воды различными сточными водами. Оборудование и материалы: пронумерованные пробирки – 6 шт., пинцет, штатив для пробирок, модельные сточные воды, проба воды из водоема, тест-системы «рН», «Активный хлор», «Нитраты», «Феррум-тест». Ход работы: 1. Опишите внешний вид модельных сточных вод и пробы воды из водоема – цвет и мутность. 2. С помощью тест-систем определите рН исследуемых образцов (пробирки №1,2,6); примерные концентрации активного хлора (пробирки №3,6), нитратов (пробирки №4,6), солей железа (пробирки №5,6). Результаты зафиксируйте в табличной форме. 3. Сравните полученные концентрации с ПДК и при необходимости рассчитайте количество чистой воды, необходимое для разбавления загрязненной сточной воды до допустимых норм; внесите полученные результаты в таблицу.
Опыт 6. Оценка загрязнения почвы путем химического анализа вытяжек Вводная информация: В почве часто обнаруживаются такие химические загрязнители, как кислоты и щелочи (изменение рН), соли: карбонаты, гидрокарбонаты, хлориды, сульфаты (засоление почвы), соли тяжелых металлов. Более подробная информация о влиянии этих веществ на почву приведены во вводной информации к лабораторной работе №1 (3 опыт) и №3 (2 опыт). Концентрации легкорастворимых солей определяют в водной вытяжке, проводя ее химический анализ. Данные о степени и типах засоленности почвы, в зависимости от концентрации солей, приведены в табл. 5 и 6.
Таблица 5 Типы засоленности почв в зависимости от соотношения анионов
©2015-2020 studopedya.ru Все права принадлежат авторам размещенных материалов.
|

 .
. .
.
 .
.



 ;
; .
.