|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Скользящие зажимы – факторы процессивности ДНК-полимераз
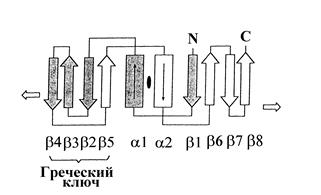
Особый класс субъединиц холоферментов ДНК-полимераз образуют белки-зажимы (clamps), которые связываются с другими компонентами комплекса (часто с каталитической субъединицей) и одновременно топологически ассоциируются с ДНК. Топологическая мода ассоциации означает, что в отличие от сайт-специфически связывающихся с ДНК белков (например, факторов транскрипции), во взаимодействии которых с определенными участками последовательности ДНК участвуют физические контакты (например, водородные связи), зажимы не образуют таких стабилизирующих связей и прикрепляются к ДНК только за счет их специфической топологии. Все белки-зажимы имеют форму кольца, надетого на дуплекс ДНК и способного достаточно свободно скользить вдоль ДНК в обоих направлениях. После погрузки на кольцевую ДНК такие скользящие зажимы остаются ассоциированными с нею длительное время, но после разрезания ДНК рестрикционными эндонуклеазами соскальзывают в месте двунитевого разрыва. В репликативных комплексах белки-зажимы располагаются позади ДНК-полимеразы, перемещающейся вдоль матричной нити. Главная функция скользящих зажимов состоит в повышении процессивности ДНК-полимераз. Рассмотрим структурные особенности скользящих зажимов ДНК-полимераз на примерах бактериального белка DnaN (b-субъединицы ДНК-полимеразы III E. coli) и эукариотического белка PCNA. Белок DnaN имеет длину 366 остатков и состоит из 3 доменов длиной ~ 110 остатков, имеющих очень низкий уровень гомологии первичной последовательности. Тем не менее, все 3 домена имеют одинаковую общую структуру и состоят из двух a-спиралей и восьми b-нитей в линейной последовательности babbbbabbb (рис. 1.15, А). Эти участки в каждом домене белка DnaN уложены в одинаковые симметричные топологические структуры: в середине расположены две a-спирали, а по краям - два мотива греческого ключа, каждый из которых образован 4 b-нитями (рис. 1.16). Такая укладка наблюдается не только в центральном домене 2, но и продолжается в смежных доменах 1 и 3. Рентгеноструктурный анализ с разрешением 2,5 Å показал, что димерный белок DnaN состоит из 2 тождественных субъединиц, соединенных друг с другом в ориентации «голова к хвосту» (N-конец одной субъединицы взаимодействует с С-концом второй). Димер белка DnaN имеет форму тороидального кольца с внешним диаметром ~ 80
Рис. 1.15. Доменная организация скользящих зажимов ДНК-полимераз. А – белок DnaN E. coli, В – эукариотический белок PCNA - ядерный антиген пролиферирующих клеток. В домене 2 указано взаимное расположение a-спиралей и b-нитей в первичных последовательностях этих белков, которое сохраняется и в доменах 1 и 2
Рис. 1.16. Схема укладки a-спиралей и b-нитей в каждом домене скользящих зажимов ДНК-полимераз. Стрелки указывают на переход в соседние домены с такой же организацией укладки
Рис. 1.17. Структура кольцевых форм скользящих зажимов ДНК-полимераз. А. Димер бактериального белка DnaN; в центре – дуплекс ДНК. В. Тример эукариотического белка PCNA (B).
Å, внутренним диаметром 38 Å и толщиной ~ 30 Å (рис. 1.17, А). Внутренний диаметр кольца b-субъединицы ДНК-полимеразы III позволяет пройти через центр кольца дуплексу ДНК в А-форме или В-форме (диаметр 21 и 18 Å соответственно). Толщина кольца DnaN соответствует длине одного витка двойной спирали ДНК. Это кольцо имеет псевдо-6-кратную симметрию и состоит из 6 глобулярных доменов. В 3-мерной структуре DnaN слой из переплетенных b-нитей расположен на внесшей поверхности кольца, а внутреннюю поверхность канала, через который может проходить ДНК, выстилают 12 a-спиралей. Белок DnaN имеет большой валовой отрицательный заряд (-22), но большинство отрицательно заряженных остатков распределено по внешней поверхности, что исключает электростатическое взаимодействие свободного димера с отрицательно заряженной ДНК. С другой стороны, поверхность внутреннего канала заряжена положительно, так что фосфатные группы остова ДНК могут проходить через этот канал без электростатического отталкивания. Каждая из 12 центральных a-спиралей перпендикулярна двойной спирали ДНК в центре кольца. Это предотвращает тесный контакт белка DnaN с обеими канавками ДНК и ограничивает ДНК-белковые взаимодействия неспецифическими контактами a-спиралей с фосфатным остовом. Такая организация кольца DnaN обеспечивает тесное топологическое связывание с ДНК и в то же время не препятствует свободному скольжению вдоль ДНК. Контактная поверхность между субъединицами в димере DnaN похожа на продолжение b-слоя на междоменных границах в мономере. В стабилизацию этой контактной границы вносят вклад сильные водородные связи и электростатические взаимодействия между положительно заряженными остатками на N-конце одного мономера и отрицательно заряженными остатками на С-конце второго. Эукариотический белок PCNA длиной 258 остатков короче, чем белок DnaN, и состоит из 2 доменов с такой же организацией, как и у доменов белка DnaN (рис. 1.15, В). Рентгеноструктурный анализ обнаружил, что PCNA образует кольцевые тримеры с организацией «голова к хвосту». Общая топология этих тримеров очень похожа на топологию димеров DnaN (рис. 1.17, В), хотя первичные последовательности этих белков не гомологичны. Кольцо белка PCNA также образовано 6 симметрично расположенными доменами и по размеру не отличается от кольца DnaN, только имеет чуть меньший диаметр внутреннего канала (34 Å). В кольце PCNA внутренний канал также состоит из 12 положительно заряженных a-спиралей, а большой отрицательный валовой заряд (-60) распределен по внешнему b-слою. Таким образом, белок PCNA также может связываться с ДНК топологически, сохраняя свободу миграции вдоль ДНК. Такой консерватизм 3-мерных структур про- и эукариотических зажимов хорошо соответствует их функциям как факторов процессивности ДНК-полимераз. Кроме этой главной функции, белки DnaN и PCNA играют еще одну существенную роль: они организуют белок-белковые взаимодействия с другими компонентами репликативных комплексов, и, прежде всего с минимальными ферментами ДНК-полимераз. В случае бактериального белка DnaN во взаимодействии с a-субъединицей ДНК-полимеразы III E. coli участвует мотив MPMRL, расположенный на самом конце b-субъединицы и выступающий над поверхностью ее кольца. Партнером этого мотива в a-субъединице PolIII является область остатков 800-950, содержащая важный для связывания DnaN мотив QADMF в положениях около 920. У E.coli связывание свободного кольца DnaN с сердцевиной ДНК-полимеразы является довольно слабым, но оно усиливается после ассоциации PolIII с ДНК. Помимо главного репликативного фермента PolIII, белок DnaN может связываться и со всеми минорными ДНК-полимеразами, включая PolII, PolIV (DinB) и PolV (UmuC). Более того, бактериальный белок DnaN может связывать белок UmuC системы коррекции ошибочно спаренных оснований, а также ДНК-полимеразу I и ДНК-лигазу, участвующие в процессинге фрагментов Оказаки. Многие из бактериальных белков, связывающихся с DnaN, содержат консенсусный мотив QL[SD]LF, который, вероятно, необходим для стабилизации гидрофобных взаимодействий с комплементарной областью поверхности скользящего зажима. Эукариотический белок PCNA также связывается не только с сердцевинами ДНК-полимераз d и e, но и со многими другими белками. Некоторые из этих взаимодействий могут играть регуляторную роль. Хорошо изученным партнером PCNA является ингибитор p21CIP1/WAF1 циклин-зависимых протеинкиназ, регулирующих движение по клеточному циклу. Белок р21 взаимодействует своей С-концевой с 4 петлями, расположенными вне кольца PCNA, включая большие междоменные петли (см. рис. 1.17, В). Три из этих внешних петель необходимы для связывания с ДНК-полимеразой d. Связывание р21 с PCNA конкурентно тормозит включение PCNA в холофермент ДНК-полимеразы и ингибирует элонгацию в репликации ДНК при участии Pold, но не влияет на активность Pold в эксцизионной репарации. Экспрессия белка р21, индуцируемая белком-регулятором клеточного цикла р53 в условиях повреждения ДНК, может понижать скорость движения репликативных вилок в фазе S и отсрочивать репликацию до завершения репарации поврежденной ДНК. С PCNA связываются также циклин-зависимые протеинкиназы и свободные циклины D. Это взаимодействие, вероятно, предотвращает преждевременный синтез ДНК во время фазы G1 клеточного цикла. За последнее время обнаружены новые взаимодействия PCNA: с белком XPG эксцизионной репарации, белками MSH3, MSH6, MLH1 и PMS2 системы коррекции ошибочно спаренных оснований и с эндонуклеазой Fen1 и ДНК-лигазой I, участвующими в созревании фрагментов Оказаки. Способностью вербовать в холоферменты ДНК-полимераз многочисленные вспомогательные белки PCNA напоминает С-концевой домен самой большой субъединицы эукариотической РНК-полимеразы II, с которым связываются разнообразные компоненты систем процессинга мРНК (сплайсинга и 3’-расщепления-полиаденилирования). Многие эукариотические белки ассоциирующиеся с PCNA, имеют в контактном участке для PCNA аминокислотный мотив QxxLxxFF, близкий к мотиву связывания бактериальных белков с белком DnaA.
Поиск по сайту: |